Для устранения незначительно выраженных болевых синдромов пациенты применяют препараты анальгезирующего действия, однако при этом редко советуются с врачом по поводу того, какой именно анальгетик им следует применять. В лучшем случае они следуют рекомендациям провизора, который может помочь им выбрать необходимый препарат из широкого ассортимента представленных в аптеке безрецептурных болеутоляющих средств. Только в России в настоящее время зарегистрировано более 200 различных торговых наименований и свыше 1500 различных лекарственных форм анальгетиков и нестероидных противовоспалительных препаратов (НПВП) [1].
В других странах несколько иная ситуация — доля продаж анальгетиков с доказанной минимальной токсичностью остается стабильно высокой, в то время как такие потенциально опасные препараты, как метамизол натрий (Анальгин) и содержащие его лекарственные средства, традиционно применяющиеся для устранения болевых синдромов в странах СНГ, либо вовсе не представлены на фармацевтическом рынке, либо объем их реализации ничтожно мал [2]. Тем не менее, проблема безопасности анальгетиков существует и в экономически развитых странах, что обусловлено трудностями учета столь широкого рынка лекарственных средств. Появилось даже новое понятие «OTS-препараты» («off-the-shelf» — «лекарства с полки»), которое употребляют взамен привычного «ОТС-препараты» («over-the-counter» — «лекарства, продающиеся помимо прилавка»). Использование термина «OTS» свидетельствует о том, как изменилась психология пациента в отношении выбора безрецептурных лекарств, в том числе и анальгетиков. Все большее значение в принятии решения о покупке того или иного препарата приобретает реклама на телевидении и в прессе. Сложившаяся ситуация вызывает тревогу врачей и фармацевтов всего мира.
Среди препаратов с анальгезирующим действием, которые получили широкое распространение в странах СНГ, можно выделить метамизол натрий (Анальгин), парацетамол, ацетилсалициловую кислоту и ибупрофен.
Пиразолоновые производные, к которым относится метамизол натрий, оказывают более выраженное анальгезирующее, чем противовоспалительное действие, за счет стимуляции неопиатной антиноцицептивной системы. Метамизол натрий в течение нескольких десятилетий остается в России базисным неопиатным анальгетиком, активно применяющимся в различных лекарственных формах: его приобретают до 79% покупателей и используют при болевых синдромах различной локализации, о чем свидетельствуют опросы врачей [3]. При умеренно выраженном болевом синдроме этому препарату отдали предпочтение большинство принявших участие в анкетировании (24%).
Однако следует отметить, что метамизол натрий и содержащие его препараты не соответствуют критерию «надежной безопасности». Об этом свидетельствуют результаты широкомасштабного исследования IAAAS (International Agranulocytosis and Aplastic Anemia Study), проведенного в середине 80-х годов в нескольких странах. Зарегистрированные случаи агранулоцитоза в популяции более 22 млн человек, получавших метамизол натрий, позволили рассчитать риск развития этого гематологического осложнения (1 случай на 1 млн человек в неделю) [4]. Реальный риск развития агранулоцитоза выше, поскольку результаты исследования включали только документированные случаи нарушения кроветворения. Фармакоэпидемиологические данные, полученные из других источников, свидетельствуют о более высоком риске, который не менее чем в 50 раз превышает выявленный в исследовании ISAAAS [5]. Если эти данные достоверны, то частота «метамизолового» агранулоцитоза выше, чем общий показатель распространенности этого состояния во Франции в 8 раз, а в Швеции — в 4 раза [6]. Поскольку с возрастом частота развития любого нарушения кроветворения под действием лекарственных средств повышается [7], можно предположить более высокую уязвимость лиц пожилого возраста, принимающих метамизол натрий. Летальность при развитии агранулоцитоза вследствие использования метамизола натрия достигает 10–30% и возрастает при позднем обращении за медицинской помощью.
Учитывая способность метамизола натрия вызывать агранулоцитоз даже при его непродолжительном (менее 10 дней) использовании независимо от пути введения [8], он запрещен к применению во многих странах мира: в Великобритании — 35 лет назад, в США — с 1977 года, в Саудовской Аравии — с 1980 года. Поэтому метамизол натрий даже не упоминается в обзорах последних лет, посвященных гематотоксичности лекарственных средств в отличие от препаратов других групп (антитиреоидные, сульфаниламиды, нейролептики, антисекреторные) [9]. Пока в России отсутствует единая система регистрации побочных эффектов лекарственных средств, а объем производства метамизола натрия отечественной фармацевтической промышленностью остается стабильно высоким, его широкое потребление создает реальную угрозу развития серьезных побочных эффектов [10].
Конечно, выраженность токсического действия препарата зависит также от генетических факторов, обусловливающих нарушение его фармакокинетики и возникновение токсичных метаболитов. Возможно, поэтому у разных больных побочные реакции на применение метамизола натрия развиваются не только в виде апластических состояний, а также нарушений функций печени, почек и легких [11]. Интерстициальный нефрит, гепатит, альвеолит могут быть не менее опасными для жизни и здоровья пациентов, чем агранулоцитоз. Кратковременное применение пиразолоновых производных у больных, не имеющих аллергических реакций на препараты этой группы, часто не приводит к развитию существенных побочных эффектов. Однако при повторном приеме риск токсического действия метамизола натрия может возрастать многократно и проявиться в любой момент. Более того, у детей младшего возраста пиразолоновые производные могут оказать негативное действие достаточно быстро, даже после однократного применения. Следовательно, метамизол натрий не соответствует требованиям, предъявляемым к «идеальному» безрецептурному анальгетику: наличие лекарственных форм для приема внутрь, которые быстро абсорбируются в слизистой оболочке желудка и кишечника; быстрое достижение максимальных концентраций в плазме крови; наличие относительно короткого периода полувыведения из плазмы крови (предупреждение кумулятивного эффекта) и вместе с тем достаточно продолжительного анальгезирующего действия; отсутствие побочных эффектов при эпизодическом и повторном приемах.
К другой распространенной группе НПВП относят препараты, содержащие ацетилсалициловую кислоту. Они оказывают анальгезирующее, жаропонижающее и противовоспалительное действие, а также уменьшают агрегацию тромбоцитов. Поэтому в некоторых случаях, например при альгодисменорее, болевом синдроме после экстракции зуба, различных пункций даже однократное применение ацетилсалициловой кислоты может увеличить или спровоцировать кровопотерю.
Ибупрофен и парацетамол не оказывают антитромбоцитарного действия. Применение парацетамола не приводит к развитию побочных эффектов, которые возникают при взаимодействии с другими лекарственными препаратами, его можно использовать для лечения пациентов с «аспириновой» астмой, а также в педиатрической практике. За последние годы в США количество детей с синдромом Рейе значительно уменьшилось благодаря ограничению применения салицилатов, что может служить примером эффективности профессиональной информации о лекарственных средствах [12]. Жаропонижающие (антипиретические) свойства ибупрофена выражены слабее, чем парацетамола и ацетилсалициловой кислоты.
Анальгезирующее действие достигается сочетанием периферического и центрального компонентов фармакокинетики препаратов. Центральный анальгетический эффект обусловлен их непосредственным влиянием на синтез простагландинов в головном и спинном мозге. Этот эффект выявлен у парацетамола, ибупрофена и, по данным экспериментальных исследований, присущ ряду других анальгетиков и НПВП. Периферическое действие этих препаратов обусловлено в основном влиянием на циклооксигеназный путь превращений арахидоновой кислоты. Они угнетают синтез простагландинов в спинном мозге и периферических тканях, уменьшая выраженность болевого синдрома при повреждении или воспалении тканей [13].
Существуют две формы циклооксигеназы (ЦОГ) — конституционная (ЦОГ-1), в результате деятельности которой образуются «гомеостатические» простагландины (I2, E2, тромбоксан А2), и индуцированная (ЦОГ-2), появляющаяся только при воспалении и контролирующая синтез простагландинов, поддерживающих воспалительный процесс [14]. Противовоспалительный эффект препаратов достигается ингибированием ЦОГ-2, в то время как при блокаде ЦОГ-1 развивается их побочное действие. Противовоспалительные простагландины способны не только напрямую стимулировать, но и вызывать десенситизацию первичных афферентных ноцицептивных волокон, причем эта гиперадгезия является ЦОГ-2-зависимым феноменом [15].
Известно, что парацетамол, применяемый как антипростагландиновый препарат, проявляет более высокую активность в головном и спинном мозге (что даже позволило высказать предположение о существовании третьей изоформы ЦОГ-3, к которой он обладает тропностью). В то же время на различных экспериментальных моделях доказано также его периферическое действие. Салицилаты и ибупрофен эффективно подавляют воспалительную реакцию в тканях, сохраняя влияние на нервную систему. Существуют доказательства их спинального антиноцицептивного эффекта посредством влияния на опиодергическую систему [16]. Налоксон устраняет спинальный антиноцицептивный эффект НПВП только при воспалительной этиологии болевого синдрома [17], следовательно, анальгезирующее действие рассматриваемых препаратов, которое наблюдается и у больных без воспалительных реакций (например, при головной, менструальной и другой боли), обусловлено воздействием на другие механизмы антиноцицепции.
Подавление ЦОГ-1 приводит к снижению содержания «гомеостатических» простагландинов, основными эффектами которых являются:
— сохранение кровотока желудка, обеспечение его функции и репаративных процессов;
— стабилизация и увеличение толщины слизистого барьера, защищающего желудок и кишечник от агрессивных воздействий;
— стимуляция секреции бикарбонатов за счет активации натриевого насоса слизистой оболочки желудка, что способствует нейтрализации ионов водорода и предупреждает их обратную диффузию;
— стабилизация микроциркуляции в слизистой оболочке желудка;
— ингибирование секреции соляной кислоты в желудке;
— стимуляция ростковых факторов эпителия слизистой оболочки желудка;
— стабилизация почечной гемодинамики за счет регулирования почечного кровотока.
Негативный эффект НПВП на слизистую оболочку желудка и двенадцатиперстной кишки обусловлен сочетанием местного повреждающего и системного действия (ингибиция ЦОГ-1 — нарушение синтеза гастропротекторных простагландинов). Ацетилсалициловая кислота, диффундируя в цитоплазму эпителиальных клеток, ионизируется (под влиянием высокой внутриклеточной рН) и накапливается в относительно высокой концентрации, что повреждает эпителий желудка. Кроме того, локальные токсические эффекты могут быть обусловлены способностью индуцировать образование свободных радикалов, влиять на внутриклеточную концентрацию кальция, снижать образование глутатиона, разобщать окислительное фосфорилирование [18]. Эти факты заставляют скептически относиться к утверждениям о том, что ацетилсалициловая кислота в форме шипучих растворимых таблеток потенциально менее токсична для желудка, поскольку речь идет о внутриклеточной альтерации эпителиальных клеток. Таким образом, растворимые формы салицилатов имеют только одно преимущество — быстроту развития основных эффектов препарата вследствие большой поверхности всасывания. Уменьшение интенсивности местного действия наблюдается при парентеральном или ректальном введении ацетилсалициловой кислоты, хотя ульцерогенный эффект ее от этого не снижается, так как он обусловлен подавлением активности ЦОГ-1. Кроме того, предполагается, что с повышением доз салицилатов активизируется липооксигеназный путь метаболизма арахидоновой кислоты с индукцией синтеза лейкотриенов, обладающих выраженным токсическим действием на желудок [19].
Ультраструктурные поверхностные повреждения слизистой оболочки желудка при применении НПВП возникают уже через несколько минут, а определяемые эндоскопически гастродуоденальные субэпителиальные кровоизлияния и эрозии — через несколько часов после приема препаратов [20]. Характерно, что у всех здоровых добровольцев начальные повреждения развивались даже после однократного применения ацетилсалициловой кислоты в дозе 500 мг. Вероятность развития и тяжесть гастроинтестинальных осложнений НПВП в значительной степени зависят от факторов риска (таблица).
Таблица
Факторы риска развития осложнений со стороны пищеварительного тракта при использовании НПВП
|
Доказанные факторы риска |
Вероятные факторы риска |
| Возраст старше 65 лет | Женский пол |
| Наличие язвенной болезни желудка в анамнезе | Курение |
| Высокие дозы и/или частое использование НПВП | Злоупотребление алкоголем |
| Сопутствующее применение кортикостероидов | Инфицирование H. рylori |
| Длительное лечение с применением НПВП (>3 месяцев) | Системные заболевания соединительной ткани |
| Одновременное применение НПВП с антикоагулянтами | Тяжелые сопутствующие заболевания |
| Одновременное применение разных НПВП |
Все вышеназванные факторы риска не следует рассматривать в качестве абсолютных или относительных противопоказаний при выборе НПВП. При прочих равных условиях меньше факторов риска вызывает применение ибупрофена.
Следует различать реальную опасность развития побочных эффектов при использовании нестероидных средств для лечения лихорадки различного генеза и воспалительных процессов (длительное, периодически повторяющееся применение) с однократным купированием боли, в том числе в домашних условиях. Результаты исследований, в которых раздельно оценивали безопасность анальгетиков, свидетельствуют, что парацетамол и ибупрофен больные переносили достоверно лучше, чем ацетилсалициловую кислоту.
Безопасность анальгетиков, как и многих других лекарственных средств, обусловлена также особенностями метаболизма. Парацетамол метаболизируется в печени тремя путями: конъюгацией с глюкуронидами (60%), сульфатированием (35%) и биотрансформацией в системе ферментов цитохрома Р450 (5%) [21]. Последний путь вызывает образование парацетамоловых конъюгатов — производных цистеина и меркаптуровой кислоты, которые проявляют гепато- и нефротоксичность, что может представлять опасность, особенно при применении у детей [22]. Токсические эффекты парацетамола развиваются, как правило, при превышении среднетерапевтических доз (если его не применяют одновременно с такими активаторами системы цитохрома Р450, как барбитураты, рифампицин, теофиллин). Ацетилсалициловая кислота значительно активнее взаимодействует с системой микросомального окисления печени, поэтому она потенциально более гепатотоксична, чем парацетамол или ибупрофен. С особой осторожностью ацетилсалициловую кислоту и парацетамол следует назначать пациентам, у которых диагностирован алкоголизм, гепатит и висцеральные формы ревматоидного артрита [24, 25] (рисунок). В связи с этим актуальным является вопрос о безопасности парацетамолсодержащих препаратов для устранения похмельного синдрома.
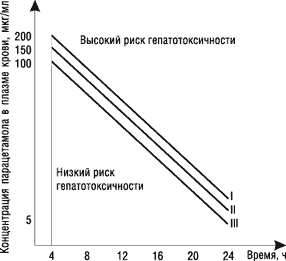
|
I — при нормальной функции печени II — при легких нарушениях функции печени III — у больных алкоголизмом или при приеме препаратов, активирующих систему цитохрома Р450 (барбитураты, дифенин, глюкокортикоиды и др.) |
Рисунок. Номограммы для определения риска гепатотоксичности парацетамола
Токсическое действие препарата во многом зависит от его распределения в организме, оцениваемого по объему распределения (Vd), т.е. теоретическому объему, в котором вещество может быстро и полностью раствориться в биологических жидкостях организма. Способность молекулы лекарственного вещества достичь ткани во многом зависит от его растворимости и связывания с белками плазмы крови. Оно легко диффундирует в ткани, если обладает высокой липофильностью, неионизировано и имеет высокий Vd. Объем распределения рассматривается в сравнении с контрольным объемом в 0,6 л/кг, что соответствует объему обменной воды, т.е. плазмы, интерстициальной жидкости и цитозольной воды. Если Vd ниже чем 0,1 л/кг, то это значит, что вещество не распределяется в ткани, а действует в просвете кишечника. В диапазоне 0,1–0,6 л/кг лекарство выходит из плазменного компонента, проникает в интерстициальную жидкость, но не поступает в клетки, если показатель Vd превышает 0,6 л/кг, это свидетельствует о проникновении вещества в клетку и связывании его с клеточными структурами. Последнее может быть причиной токсического, повреждающего действия на клетку. С этой точки зрения ибупрофен, у которого Vd равно 0,26 л/кг, потенциально менее цитотоксичен, чем парацетамол, у которого Vd равно 0,62 л/кг [25, 26]. Клинически подтвержденное гепатотоксическое действие парацетамола развивается при его приеме в суточной дозе выше 10 г, что в 2,5 раза превышает рекомендуемую терапевтическую дозу препарата для взрослых.
Необходимость в устранении болевого синдрома часто возникает при инфекционных заболеваниях верхних и нижних дыхательных путей. Несмотря на отсутствие патогенетической направленности такой терапии, она значительно улучшает субъективное состояние больного. Наиболее безопасными анальгетиками для такого краткосрочного применения признаны ибупрофен и парацетамол. F. Boureau и соавторы [27] в ходе двойного слепого исследования выявили, что ибупрофен в дозе 400 мг/сут значительно превосходил по анальгезирующей активности парацетамол в дозе 1000 мг/сут. Частота слабо выраженных побочных эффектов изученных в этом исследовании анальгетиков была одинаковой.
Исследование PAIN, посвященное сравнению безопасности ацетилсалициловой кислоты, парацетамола и ибупрофена, продемонстрировало преимущества ибупрофена [28]. В исследовании приняли участие более 8000 пациентов в возрасте от 18 до 75 лет, которым было показано проведение короткого курса лечения по поводу болевого синдрома слабой и умеренной интенсивности при заболеваниях опорно-двигательного аппарата, острых бактериальных и вирусных респираторных инфекциях. Это рандомизированное, многоцентровое слепое контролированное исследование проводили в 3 группах больных одновременно, что позволило достоверно сравнить изучаемые признаки в разных группах. Больные получали ацетилсалициловую кислоту (500 мг) либо парацетамол (500 мг), либо ибупрофен (200 мг), рекомендуемая доза любого препарата составляла до 6 таблеток в сутки. Длительность лечения составляла от 1 до 7 дней, оценку его результатов проводили по данным, представляемым больными и врачами, с использованием современных методов статистики.
У 74,2% пациентов, получавших ибупрофен, оценивали результаты лечения как отличные или хорошие, что являлось достоверно более высоким показателем эффективности, чем у получавших парацетамол (69,2%) и ацетилсалициловую кислоту (68,6%). Наименее часто развитие побочных эффектов наблюдалось в группе больных, лечившихся ибупрофеном (19,5%), и наиболее часто — в группе больных, принимавших салицилаты (25,9%).
Результаты данного крупномасштабного исследования свидетельствуют, что применение парацетамола и ибупрофена в принципиально равноэффективных анальгетических дозах демонстрируют лучшую переносимость по сравнению с ацетилсалициловой кислотой. В то же время ибупрофен реже вызывает развитие побочных эффектов со стороны пищеварительного тракта, чем парацетамол. Эти данные послужили основанием для модификации тактики применения НПВП и рекомендации врачам общей практики использовать ибупрофен в качестве анальгетика первой линии для устранения болевого синдрома. Потенциально более низкий риск развития токсических эффектов ибупрофена в сравнении с парацетамолом наблюдают также в педиатрической практике [29].
Таким образом, применение безрецептурных НПВП оправдано только в тех случаях, когда сведено к минимуму вредное воздействие препарата на здоровье и не «смазывается» картина серьезного соматического заболевания. Необходим дифференцированный подход к выбору безрецептурного препарата, основанный прежде всего на глубоких знаниях врача. Специалист может и обязан влиять на выбор больным того или иного лекарства. Особенно это актуально для назначения анальгетиков, которые могут вызывать развитие побочных эффектов. Представленные в обзоре доказательства и собственный экспериментальный и клинический опыт авторов позволяют утверждать, что вместо метамизола натрия следует использовать препараты с более высоким уровнем безопасности, а также экономически более доступные — ибупрофен и парацетамол. Они эффективны для краткосрочного устранения болевых синдромов.
Если определенные значения концентрации парацетамола в соответствующий момент времени у данной категории лиц выше значений номограмм, существует высокий риск развития гепатотоксического действия препарата.
По материалам статьи А.А. Зайцева, Ю.Д. Игнатова, О.И. Карпова,
предоставленной компанией
«Boots Healthcare International»
|
ЛИТЕРАТУРА |
|
|

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим