На початку червня цього року в мальовничому передмісті Києва — Пущі-Водиці відбувся триденний інформаційно-консультативний семінар для інспекторів територіальних Державних інспекцій з контролю якості (ДІКЯ) лікарських засобів з питань удосконалення порядку проведення інспекційних перевірок та організаційно-методичної роботи. Семінар було організовано ДП «Український науково-дослідний центр фармації» спільно з ДІКЯ лікарських засобів МОЗ України. Головували на семінарі заступник Головного державного інспектора з контролю якості лікарських засобів МОЗ України С.В. Сур та директор ДП «Український науково-дослідний центр фармації» В.П. Соболевський. Перед учасниками семінару з доповідями та повідомленнями виступили провідні вчені та фахівці Державного науково-дослідного центру лікарських засобів (м. Харків), ДП «Державний фармакологічний центр» (м. Київ), МОЗ України, центрального апарату ДІКЯ лікарських засобів МОЗ України, Центральної лабораторії з аналізу якості лікарських засобів, територіальних державних інспекцій.
З доповіддю про систему державного контролю якості ЛЗ в Україні та роль інспекторів у системі державного контролю якості ЛЗ виступив Сергій Сур.
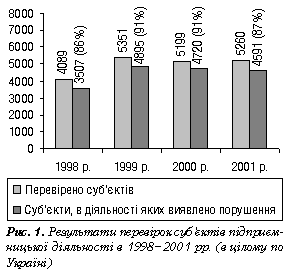
Він зупинився на питаннях історичного розвитку системи державного контролю якості ЛЗ та її нормативно-правового забезпечення, структури ДІКЯ лікарських засобів та її ролі в забезпеченні якості ЛЗ. Доповідач підбив підсумки інспекційних перевірок, проведених територіальними ДІКЯ у 1998–2001 рр. Незважаючи на певну структуризацію оптового та роздрібного секторів фармацевтичного ринку кількість виявлених порушень досить велика, і тенденція до їх зменшення нечітко виражена (рис. 1): з 5260 перевірених у 2001 р. суб’єктів господарювання порушення вимог чинних законодавчих та нормативно-правових актів щодо забезпечення якості ЛЗ виявлено у 4531, що складає 87% (у 1999–2000 рр. — 91%).
 |
Основними порушеннями у 2001 р. були:
• неналежні умови зберігання ЛЗ;
•? недотримання санітарних норм і правил;
•? реалізація ЛЗ, що не відповідають вимогам аналітично-нормативної документації (АНД);
•? реалізація незареєстрованих ЛЗ.
Виходячи з кількості виявлених порушень серед перевірених суб’єктів в окремих регіонах України, у доповідача виникло закономірне питання щодо об’єктивності перевірок. Водночас він звернув увагу на недосконалість матеріалів перевірок суб’єктів господарювання (в діяльності яких виявлено порушення), що направляються до Ліцензійної комісії Державного департаменту з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення.
Сергій Сур зупинився на останніх нормативних документах МОЗ України щодо контролю якості ЛЗ (накази від 30.10.2001 р. № 436 «Про затвердження Інструкції про порядок контролю якості лікарських засобів під час оптової та роздрібної торгівлі», від 12.12.2002 р. № 497 «Про затвердження Порядку заборони (зупинення) та вилучення з обігу лікарських засобів на території України»), відзначив підвищення ролі ДІКЯ у забезпеченні взаємодії із суб’єктами фармацевтичного ринку, спрямовану на недопущення в обіг субстандартних ЛЗ, забезпечення населення України якісними та безпечними ЛЗ. Було звернено увагу на принципові зміни в системі контролю якості ЛЗ в Україні у зв’язку з набуттям чинності зазначених вище наказів МОЗ України.
Доповідь доктора фармацевтичних наук, професора, завідувача лабораторії колоїдної хімії дисперсних лікарських форм Державного наукового центру лікарських засобів (м. Харків) М.О. Ляпунова була присвячена системі законодавчих і нормативних документів ЄС та України як основі забезпечення якості і сертифікації ЛЗ. Доповідач охарактеризував основні принципи забезпечення якості ЛЗ під час їх виробництва та дистриб’юції, продемонстрував останні нормативні документи МОЗ України, які адаптовані до вимог Європейського законодавства.
Начальник відділу з контролю за виробництвом, оптовою і роздрібною реалізацією лікарських засобів ДІКЯ лікарських засобів МОЗ України В.В. Онищенко ознайомив присутніх з порядком організації перевірок суб’єктів господарської діяльності та підприємств — виробників ЛЗ. Він зосередив увагу на видах та етапах перевірок, відповідальності інспекторів та їх поведінці під час перевірок, на підготовці до перевірок, процесі самої перевірки та складанні акта перевірки.
Начальник загального відділу ДІКЯ МОЗ України С.М. Старунська ознайомила учасників семінару з принципами організації діловодства в територіальних інспекціях. Вона зазначила, що відповідальність за організацію діловодства в територіальних інспекціях, структурних підрозділах, своєчасне та якісне ведення документації, а також її зберігання несуть керівники структурних підрозділів та начальники територіальних інспекцій, які призначають відповідального за діловодство.
Документи, які надходять до територіальної інспекції, класифікуються за такими ознаками: зміст, назва, місце складання, термін виконання, вид діяльності тощо. Особливу увагу було акцентовано на одному з етапів надходження документів — реєстрації, основний принцип якої — однократність.
Другий день семінару розпочався з ознайомлення його учасників з роботою провідних підприємств фармацевтичної галузі — ВАТ «Фармак» та ЗАТ «Фармацевтична фірма «Дарниця». Відвідання цих підприємств стало практичним продовженням теми доповіді В. Онищенка щодо інспекційних перевірок. Учасники семінару змогли ознайомитися з реальними умовами виробництва та системами забезпечення якості.
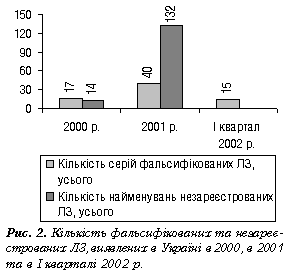
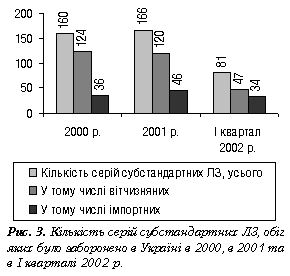
Далі теоретичне висвітлення питань продовжила начальник відділу Державної інспекції з контролю якості лікарських засобів МОЗ України І.В. Пилипенко, яка виступила з доповіддю про діяльність територіальних ДІКЯ щодо виявлення субстандартних і фальсифікованих ЛЗ та боротьби з їх поширенням. Результати перевірок ДІКЯ в 2001 р. щодо кількості виявлених субстандартних, фальсифікованих і незареєстрованих ЛЗ невтішні. Так, у 2001 р. ДІКЯ вилучено 166 серій субстандартних ЛЗ, а в І кварталі 2002 р. — 81 серію; 40 і 15 серій фальсифікованих ЛЗ відповідно (рис. 2, 3, таблиця).
 |
||||||||||||
 |
||||||||||||
|
Таблиця Фальсифіковані ЛЗ, виявлені в Україні в І кварталі 2002 р.
|
Найбільша кількість суб’єктів господарської діяльності, в яких під час перевірок у І кварталі 2002 р. виявлено субстандартні ЛЗ, зосереджена у Дніпропетровській, Донецькій, Житомирській, Запорізькій, Миколаївській областях та м. Києві. Численні виявлення порушень у різних регіонах України свідчать як про невідповідність умов зберігання ЛЗ вимогам АНД, так і про нестабільність препаратів унаслідок:
• неправильно підібраного співвідношення активних і допоміжних інгредієнтів у лікарській формі;
• невідповідної упаковки тощо.
Діяльність територіальних ДІКЯ повинна бути спрямована на виявлення шляхів поширення фальсифікованих ЛЗ за схемою:
• повідомлення ДІКЯ лікарських засобів МОЗ України або територіальної інспекції про постачальника підозрілого або фальсифікованого ЛЗ є підставою для обов’язкової термінової перевірки діяльності цього постачальника територіальною ДІКЯ;
• обов’язкове надсилання результатів перевірки до ДІКЯ лікарських засобів МОЗ України.
І.В. Пилипенко повідомила про субстандартні і фальсифіковані ЛЗ, що виявлені в Україні у І кварталі 2002 р., зупинилася на основних факторах, що сприяють поширенню фальсифікованих ЛЗ, та необхідності створення ефективної системи, що перешкоджатиме поширенню фальсифікованих і субстандартних ЛЗ, ролі територіальних ДІКЯ.
Начальник ДІКЯ в Житомирській області К.Л. Косяченко поділився досвідом роботи провадження справ з адміністративних правопорушень, висвітливши як правові, так і професійні аспекти і проблеми, що виникають під час складання актів, накладання штрафів тощо.
З порядком перевірок аптечних закладів учасників семінару ознайомила головний спеціаліст відділу забезпечення якості робіт ДІКЯ лікарських засобів МОЗ України С.А.?Кравчук. Вона докладно висвітлила основні етапи перевірки аптечних закладів, які займаються виготовленням, роздрібною або оптовою торгівлею ЛЗ. Доповідач звернула увагу присутніх на необхідність здійснення вибіркового візуального контролю під час перевірки та належного оформлення результатів перевірки аптечного закладу.
З доповіддю про порядок відбору зразків ЛЗ під час інспектування виступила завідувач Центральної лабораторії з контролю якості лікарських засобів МОЗ України Т.В. Герасимчук. Вона охарактеризувала загальні вимоги до процедури відбору середньої проби ЛЗ для аналізу, зупинилася на практичних питаннях і проблемах, які можуть виникнути під час відбору зразків ЛЗ.
Третій, заключний, день семінару розпочався з виступу заступника Головного державного інспектора України з контролю якості лікарських засобів С.В. Сура. Доповідач зупинився на конкретних функціональних обов’язках Уповноважених осіб, зростанню їх ролі в сучасній системі забезпечення якості ЛЗ на фармацевтичному ринку України.
Цікавою для учасників семінару була доповідь заступника директора ДП «Державний фармакологічний центр» (ДФЦ) МОЗ України, кандидата хімічних наук В.Т. Чумака про систему державної реєстрації ЛЗ, роботу, що виконується ДФЦ з приведення нормативно-правових документів до вимог законодавства та директив ЄС, спільні з ДІКЯ лікарських засобів МОЗ України заходи щодо запобігання появі на ринку України субстандартних ЛЗ та ЛЗ з терапевтичними і кінетичними властивостями, що не відповідають реєстраційному досьє.
Жвава дискусія розгорнулася з приводу впровадження наказів МОЗ України від 30.10.2001 р. № 436 та від 12.12 2001 р. № 497 у практичну діяльність.
У своїх запитаннях та виступах учасники семінару загострювали увагу на проблемах, з якими вони стикаються щодня, зокрема недосконалість, а в окремих випадках і відсутність нормативно-правового регулювання діяльності з виготовлення, зберігання, транспортування, реалізації та медичного застосування ЛЗ.
?
В.П. Соболевський, Н.В. Маршаленко,
ДП «Український науково-дослідний центр фармації»

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим