Додаток 12
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Перелік документів
для проведення експертизи матеріалів для державної перереєстрації лікарського засобу
1. Супровідний лист.
2. Повний зміст.
3. Заява про проведення експертизи матеріалів на лікарські засоби, які подаються для державної перереєстрації (додаток 4 до Порядку).
4. Інформація про уповноважених осіб (кваліфікований працівник заявника в Україні для здійснення фармаконагляду);
5. Висновки про відповідність належній виробничій практиці (GMP) (зроблені уповноваженим органом не пізніше як за три роки);
6. Копія ліцензії на виробництво (якщо згідно з законодавством країни-виробника, ліцензія на виробництво існує лише у електронному вигляді (наприклад, США), має бути надана роздруківка із посиланням на відповідний офіційний сайт, засвідчена підписом/печаткою заявника) або іншого дозвільного документа на виробництво заявленої лікарської форми у країні виробника;
7. Перелік країн, де препарат представлений на ринку, якщо такі є;
8. Перелік одержаних за останні 5 років в Україні рекламацій на препарат (у хронологічному порядку) з докладним аналізом причин, що слугували підставами для видачі рекламацій, та заходів, вжитих заявником для запобігання їх у майбутньому.
9. Перелік гарантій заявника та зобов’язань, наданих після реєстрації/перереєстрації (у хронологічному порядку) із зазначенням характеру, стану виконання, дати подання та дати, коли проблема була вирішена (рекомендації щодо післяреєстраційних досліджень, усунення будь-яких недоліків, що надавалися контролюючими та іншими органами тощо).
10. Переглянутий перелік усіх гарантій та зобов’язань, які залишилися, і підписаний лист зобов’язань (за необхідності).
11. Оновлену коротку характеристику лікарського засобу/інструкцію для медичного застосування, затверджені відповідно до вимог в країні виробника/заявника, затверджені при реєстрації інструкція для медичного застосування та коротка характеристика лікарського засобу (за наявності); проект оновленої інструкції для медичного застосування (на паперовому та електронному носіях).
12. Затверджені при реєстрації (перереєстрації) та оновлені методи контролю якості готового лікарського засобу.
13. Відомості про технологію виробництва та інформація щодо відсутності/наявності змін у технологічному процесі.
14. Звіт за результатами післяреєстраційного нагляду (регулярно оновлюваний звіт з безпеки) та/або узагальнюючий звіт.
15. Зведені дані заявника про стан безпеки медичного застосування лікарського засобу в Україні за період дії останнього реєстраційного посвідчення згідно з формою, передбаченою вимогами чинного законодавства.
Примітки. При перереєстрації лікарських засобів у формі in bulk необхідно надавати документи, перелічені у пп. 1, 2, 3, 5, 6, 9, 10 (за необхідності), 12, 13.
Якщо при поданні заяви для державної перереєстрації лікарського засобу декларуються зміни до реєстраційних матеріалів, які не були схвалені у встановленому порядку під час дії реєстраційного посвідчення, заявник разом з заявою для державної перереєстрації подає заяву про внесення змін до реєстраційних матеріалів та документи, які обґрунтовують внесення таких змін.
Додаток 13
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Перелік документів
для проведення експертизи матеріалів для державної перереєстрації традиційних лікарських засобів та лікарських засобів, що виробляються згідно з затвердженими прописами
1. Заява про проведення експертизи матеріалів на лікарські засоби, які подаються для державної перереєстрації згідно з додатком 2 до Порядку.
2. Інформація про уповноважену особу заявника для здійснення фармаконагляду.
3. Перелік одержаних за останні 5 років в Україні рекламацій на препарат (у хронологічному порядку) з докладним аналізом причин, що слугували підставами для видачі рекламацій, та заходів, вжитих заявником для запобігання їм у майбутньому.
4. Переглянутий перелік усіх гарантій та зобов’язань, які залишились, і підписаний лист зобов’язань (за необхідності).
5. Копія ліцензії на виробництво або іншого дозвільного документа на виробництво заявленої лікарської форми у країні виробника.
6. Проект інструкції для медичного застосування лікарського засобу.
7. Затверджені при реєстрації та оновлені методи контролю якості готового лікарського засобу.
8. Для традиційних лікарських засобів — відомості про технологію виробництва та інформація щодо відсутності/наявності змін у технологічному процесі.
9. Лист-підтвердження щодо того, що склад, виробництво та контроль лікарського засобу відповідають пропису, наведеному у Переліку лікарських засобів, що виробляються згідно із затвердженими прописами, затвердженому МОЗ.
Додаток 14
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Вимоги до документів,
що подаються для експертизи при внесенні змін типу І до реєстраційних матеріалів протягом дії реєстраційного посвідчення
А. АДМІНІСТРАТИВНІ ЗМІНИ
|
А.1. Зміна назви та/або адреси заявника (власника реєстраційного посвідчення) |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
1 |
1, 2 |
IА |
Умови
1. Власником реєстраційного посвідчення повинна залишатися одна й та сама юридична особа.
Документація
1. Документ відповідного компетентного уповноваженого органу, в якому зазначено нову назву та/або нову адресу заявника (власника реєстраційного посвідчення).
2. Оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
|
А.2. Зміна назви лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
1 |
1, 2 |
IБ |
Умови
Запропонована назва не порушує права третіх сторін.
Документація
1. Обґрунтування зміни назви.
2. Оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці.
|
А.3. Зміна назви субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
1, 2 |
1, 2 |
IА |
Умови
Субстанція повинна залишатися тією ж самою.
Документація
1. Підтвердження рекомендованих ВООЗ МНН або копія переліку МНН. Для рослинних лікарських засобів — заява про те, що назва відповідає чинним вимогам або Керівництву з якості рослинних лікарських засобів та керівним принципам для декларування рослинних субстанцій та рослинних препаратів, що входять до складу (традиційних) рослинних лікарських засобів (чинне видання).
2. Оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці.
|
А.4. Зміна назви та/або адреси виробника (включаючи, за необхідності місце проведення контролю якості) або постачальника субстанції/вихідного матеріалу/реагенту/проміжного продукту, що застосовуються у виробництві субстанції (за відсутності сертифікату відповідності Європейській Фармакопеї у затвердженому досьє) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1, 2, 3 |
IА |
Умови
Виробнича дільниця та усі виробничі операції залишаються незмінними.
Документація
1. Документ відповідного уповноваженого органу, у якому зазначено нову назву та/або адресу.
2. Зміни до відповідних розділів реєстраційного досьє.
3. У разі зміни в назві власника мастер-файла на субстанцію — поновлений дозвіл на користування даними, що містяться у мастер-файлі.
|
А.5. Зміна назви та/або адреси виробника готового лікарського засобу, включаючи місце проведення контролю якості |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) виробнича дільниця випуску серій |
1 |
1, 2 |
IА |
|
б) усі інші дільниці |
1 |
1, 2 |
IА |
Умови
1. Виробнича дільниця та всі виробничі операції залишаються незмінними.
Документація
1. Копію оновленої ліцензії на виробництво (якщо згідно з законодавством країни-виробника, ліцензія на виробництво існує лише у електронному вигляді (наприклад, США), має бути надана роздруківка із посиланням на відповідний офіційний сайт, засвідчена підписом/печаткою заявника) або іншого дозвільного документа на виробництво заявленої лікарської форми у країні виробника, у якому зазначено нову назва та/або адресу.
2. Зміни до відповідних розділів реєстраційного досьє, включаючи оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці. (за необхідності).
|
А.6. Зміна коду АТХ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1, 2 |
IА |
Умови
Присвоєння нового або зміна ВООЗ коду АТХ.
Документація
1. Підтвердження присвоєння ВООЗ коду АТХ або копія переліку кодів АТХ.
2.Оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
|
А.7. Вилучення виробничої дільниці (включаючи дільниці для субстанції, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
1, 2 |
IА |
Умови
1. Необхідно залишити принаймні одну затверджену дільницю/виробника, що виконують таку ж саму функцію, що й вилучені.
2. Вилучення не обумовлено непередбаченими обставинами у виробничому процесі.
Документація
1. Заява про внесення змін має чітко визначати затвердженого та запропонованого виробників, як зазначено в розділі 2.5 форми заяви для державної реєстрації лікарського засобу.
2. Зміни до відповідних розділів реєстраційного досьє, включаючи оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
Б. ЗМІНИ З ЯКОСТІ
Б.I. субстанція
Б.I.а) Виробництво
|
Б.I.а.1. Зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі субстанції, або зміна виробника (включаючи де необхідно місце проведення контролю якості) субстанції (за відсутності сертифікату відповідності Європейській Фармакопеї у затвердженому досьє) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) запропонований виробник належить до тієї ж виробничої групи підприємств, що й затверджений |
1, 2, 3 |
1, 2, 3, 4, 5, 6, 7 |
IА |
|
б) введення нового виробника субстанції з наданням мастер-файла на субстанцію |
II |
||
|
в) запропонований виробник використовує спосіб синтезу, що суттєво відрізняється від попереднього, або умови виробництва, які потенційно можуть змінити важливі характеристики якості субстанції, такі як якісний та/або кількісний профіль домішок, що потребує кваліфікації, або фізико-хімічні властивості субстанції, що впливають на біодоступність |
II |
||
|
г) новий виробник вихідного продукту, для якого вимагається попередня оцінка вірусної безпеки та/або ризику передачі збудників ГЕ |
II |
||
|
ґ) зміна у субстанції біологічного походження або вихідному матеріалі/реагенті/проміжному продукті, що використовуються для виробництва лікарського засобу біологічного походження |
II |
||
|
д) зміни у методах контролю якості субстанції або додавання дільниці для проведення контролю серії/випробування |
2, 4 |
1, 5 |
IА |
Умови
1. Для вихідних матеріалів та реагентів специфікації (включаючи контроль під час виробництва, методи аналізу всіх матеріалів) ідентичні затвердженим. Для проміжних продуктів та субстанцій специфікації (включаючи контроль під час виробництва, методи аналізу всіх матеріалів), спосіб виробництва (включаючи розмір серії) та детальний опис методу синтезу ідентичні затвердженим.
2. Субстанція не є стерильною або речовиною біологічного/імунобіологічного походження.
3. Якщо у процесі виробництва використовуються матеріали людського або тваринного походження, виробник не використовує будь-якого нового постачальника, для якого потрібна оцінка вірусної безпеки або відповідності виробництва Керівництву з мінімізації ризику передачі збудників губчатої енцефалопатії тварин з лікарськими засобами (чинне видання).
4. Перенесення способу виробництва з попередньої дільниці до нової було успішно виконано.
Документація
1. Зміни до відповідних розділів реєстраційного досьє (за необхідності).
2. Заява від власника реєстраційного посвідчення або від власника мастер-файла на субстанцію, за необхідності, що метод синтезу (або у разі лікарських засобів рослинного походження, за потреби, метод приготування, місце походження, виробництво рослинної субстанції та спосіб виробництва), методи контролю якості та специфікації на субстанцію та вихідний матеріал/реагент/проміжний продукт у виробництві субстанції не відрізняються від затверджених, за потреби.
3. ГЕ Сертифікат відповідності Європейській Фармакопеї для нового вихідного продукту або, якщо необхідно, документальне підтвердження того, що вихідний продукт для отримання субстанції, який має ризик передачі збудників ГЕ, попередньо оцінений уповноваженим органом країни-виробника та продемонстрована його відповідність Керівництву з мінімізації ризику передачі збудників губчатої енцефалопатії тварин з лікарськими засобами (чинне видання). Інформація повинна містити: назву виробника, види та тканини тварин, з яких одержано вихідний продукт, назву країни походження тваринної сировини, її використання та попередній дозвіл.
4. Дані аналізів (у вигляді таблиць порівняння) принаймні для двох серій (мінімум дослідно-промислових) субстанції від затвердженого та запропонованого виробників/дільниць.
5. Заява про внесення змін має чітко визначати «затвердженого» та «запропонованого» виробників, як зазначено в розділі 2.5 форми заяви для державної реєстрації лікарського засобу.
6. Заява уповноваженої особи (УО) кожного з власників ліцензії на виробництво, перелічених у заяві, якщо субстанція використовується як вихідний матеріал, та заява УО кожного з власників ліцензії на виробництво, перелічених у заяві як відповідальних за випуск серії. У заявах необхідно зазначити, що виробник(-и) субстанції діє відповідно до Керівництв з належної виробничої практики щодо вихідних матеріалів (чинне видання). Узагальнена заява може бути прийнятною за певних умов — див. Примітку до п. Б.II.б.1.
7. Зобов’язання виробника субстанції інформувати власника реєстраційного посвідчення про будь-які зміни у процесі виробництва, специфікаціях та методах аналізу субстанції (за необхідності).
|
Б.I.а.2. Зміни в процесі виробництва субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначна зміна у процесі виробництва субстанції |
1, 2, 3, 4, 5, 6, 7 |
1, 2, 3 |
IА |
|
б) значна зміна у процесі виробництва субстанції, що може мати істотний вплив на якість, безпеку або ефективність лікарського засобу |
II |
||
|
в) зміна стосується субстанції біологічного/імунологічного походження або використання хімічних субстанцій у виробництві лікарського засобу біологічного/імунологічного походження і не відноситься до протоколу |
II |
||
|
г) зміна у лікарському засобі рослинного походження та стосується однієї з таких характеристик: джерело походження сировини, спосіб виробництва або виготовлення |
II |
||
|
ґ) незначна зміна у закритій частині мастер-файла на субстанцію |
1, 2, 3, 4 |
IБ |
Умови
1. Не повинно бути жодних змін у якісному та кількісному складі домішок або змін фізико-хімічних властивостей субстанції.
2. Шлях синтезу не змінюється, а саме проміжні продукти залишаються незмінними, і не використовуються нові реагенти, каталізатори або розчинники. Для рослинних лікарських засобів — джерело походження сировини, виробництво субстанції та спосіб виробництва залишаються незмінними.
3. Специфікації на субстанцію або проміжні продукти залишаються незмінними.
4. Зміна цілком описана у відкритій («для заявника») частині мастер-файла на субстанцію (за необхідності).
5. Субстанція не є субстанцією біологічного/імунологічного походження.
6. Зміна не стосується джерела походження та способу виробництва рослинного лікарського засобу.
7. Зміна не стосується закритої частини мастер-файла на субстанцію.
Документація
1 Зміни до відповідних розділів реєстраційного досьє та затвердженого мастер-файла на субстанцію (за можливості), включаючи результати порівняння узгодженого та запропонованого виробничого процесу.
2. Дані аналізів (у вигляді таблиці порівняння) принаймні для двох серій (мінімум дослідно-промислових), виготовлених відповідно до узгодженого та запропонованого виробничого процесу.
3. Копія затверджених специфікацій на субстанцію.
4. Заява від власника реєстраційного посвідчення або власника мастер-файла на субстанцію, за необхідності, що будь-які зміни у якісному та кількісному профілі домішок або у фізико-хімічних властивостях відсутні, метод синтезу не змінюється, а також не змінюються специфікації на субстанцію або проміжні продукти.
Примітка до п. Б.I.а.2.б. Для хімічних субстанцій це стосується значних змін у методі синтезу або умовах виробництва, що потенційно можуть змінювати важливі характеристики субстанції, такі як якісний та/або кількісний профіль домішок, що потребує кваліфікації, або фізико-хімічні властивості субстанції, що впливають на біодоступність.
|
Б.I.а.3. Зміна розміру серії (включаючи діапазони) субстанції або проміжного продукту |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) збільшення до 10 разів порівняно із затвердженим розміром |
1, 2, 3, 4, 6, 7, 8 |
1, 2, 5 |
IА |
|
б) зменшення обсягу виробництва |
1, 2, 3, 4, 5 |
1, 2, 5 |
IА |
|
в) зміна, що потребує доведення подібності субстанції біологічного/імунологічного походження порівняно із затвердженою |
II |
||
|
г) збільшення у понад 10 разів порівняно із затвердженим розміром |
1, 2, 3, 4 |
IБ |
|
|
ґ) розмір серії субстанції біологічного/імунологічного походження збільшився/зменшився без зміни параметрів процесу (наприклад, дублювання лінії) |
1, 2, 3, 4 |
IБ |
Умови
1. Зміни у процесі виробництва обумовлені тільки збільшенням або зменшенням об’єму виробництва, наприклад використанням обладнання іншої продуктивності.
2. Наявність результатів аналізу принаймні двох серій запропонованого розміру відповідно до специфікацій.
3. Субстанція не є речовиною біологічного/імунологічного походження.
4. Зміна не повинна впливати на відтворюваність процесу виробництва.
5. Зміна не повинна бути обумовлена непередбаченими обставинами в процесі виробництва або проблемами, пов’язаними зі стабільністю.
6. Специфікації на субстанцію/проміжні продукти залишаються незмінними.
7. Субстанція не є стерильною.
8. Затверджений розмір серії не був схвалений при внесенні змін типу IА.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Номери серій запропонованого розміру, які проходять випробування.
3. Дані аналізів (у вигляді таблиці порівняння) принаймні однієї промислової серії субстанції або проміжного продукту для затвердженого та запропонованого розмірів (за необхідності). Дані про наступні дві повні промислові серії мають бути надані на вимогу, а також заява про те, що у разі невідповідності специфікаціям буде повідомлено Центр (з відповідною пропозицією).
4. Копія затверджених специфікацій на субстанцію (та проміжні продукти, за потреби).
5. Заява від власника реєстраційного посвідчення або власника мастер-файла на субстанцію про те, що зміни у процесі виробництва обумовлені тільки збільшенням або зменшенням об’єму виробництва, наприклад, використанням обладнання іншої продуктивності, що зміна не впливає на відтворюваність процесу і не обумовлена непередбаченими обставинами в процесі виробництва або проблемами, пов’язаними зі стабільністю, і, що специфікації на субстанцію/проміжні продукти залишаються незмінними.
|
Б.I.а.4. Зміни випробувань або допустимих меж, що встановлені у специфікаціях, в процесі виробництва субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
а) звуження допустимих меж |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) додавання нового випробування та допустимих меж |
1, 2, 5, 6 |
1, 2, 3, 4, 6 |
IА |
|
в) вилучення несуттєвого випробування |
1, 2 |
1, 2, 5 |
IА |
|
г) розширення затверджених допустимих меж для показників, які можуть істотно вплинути на якість субстанції |
II |
||
|
ґ) вилучення випробування, що може мати істотний влив на загальну якість субстанції |
II |
||
|
д) додавання або заміна випробування за результатами досліджень з безпеки або якості |
1, 2, 3, 4, 6 |
IБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду показників, зазначених у специфікації (наприклад, проведеною під час подання заяви на реєстрацію або внесення змін типу II).
2. Зміна не обумовлена непередбаченими обставинами в процесі виробництва, наприклад, появою нової некваліфікованої домішки; зміною меж загального вмісту домішок.
3. Будь-які зміни не повинні виходити за допустимі межі затвердженої специфікації.
4. Методи випробувань залишилися незмінними або такі зміни є незначними.
5. Будь-який новий метод випробувань не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
6. Новий метод випробувань не належить до біологічних/імунобіологічних/імунохімічних методів або методу, при якому використовується біологічний реагент для аналізу субстанції біологічного походження (за включенням стандартних фармакопейних мікробіологічних методів).
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця щодо затверджених та запропонованих методів випробувань.
3. Опис нового нефармакопейного методу випробування та дані з його валідації (за необхідності).
4. Дані аналізів для двох промислових серій (трьох промислові серії для субстанцій біологічного походження, якщо не обґрунтовано інше) субстанції за всіма показниками, що зазначені у специфікації.
5. Обґрунтування/оцінка ризику від власника реєстраційного посвідчення або власника мастер-файла на субстанцію (за необхідності), що підтверджує незначність зміненого параметру.
6. Обґрунтування від власника реєстраційного посвідчення або власника мастер-файла на субстанцію (за необхідності) введення нового методу випробування або допустимих меж, визначених у специфікаціях.
|
Б.I.а.5. Зміни у субстанції для сезонних, передпандемічних або пандемічних вакцин проти вірусу грипу людини |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
а) заміна штаму(-ів) у сезонних, передпандемічних або пандемічних вакцинах проти вірусу грипу людини |
II |
Б.1.б) Контроль субстанції
|
Б.I.б.1. Зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на субстанцію, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
а) звуження допустимих меж, визначених у специфікації на лікарські засоби, що підлягають офіційному випуску серії |
1, 2, 3, 4 |
1, 2 |
IA |
|
б) звуження допустимих меж, визначених у специфікації |
1, 2, 3, 4 |
1, 2 |
IA |
|
в) доповнення специфікації новим показником якості та відповідним методом випробування |
1, 2, 5, 6, 7 |
1, 2, 3, 4, 7 |
IA |
|
г) вилучення незначного показника якості, (наприклад, вилучення застарілого показника) |
1,2 |
1, 2, 6 |
IА |
|
ґ) вилучення параметра специфікації, який може мати суттєвий влив на якість субстанції та/або готового лікарського засобу |
II |
||
|
д) розширення допустимих меж, визначених у специфікації на субстанцію |
II |
||
|
е) розширення допустимих меж, визначених у специфікаціях на вихідні матеріали/проміжні продукти, які мають істотний вплив на якість субстанції та/або готового лікарського засобу |
II |
||
|
є) доповнення або заміна параметру специфікації за результатами досліджень з безпеки або якості (за виключенням субстанції біологічного або імунологічного походження) |
1, 2, 3, 4, 5, 7 |
IБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду показників, зазначених у специфікації (наприклад, проведеною під час подання заяви на реєстрацію або внесення змін типу II).
2. Зміна не обумовлена непередбаченими обставинами в процесі виробництва, наприклад, появою нової некваліфікованої домішки; зміною меж загального вмісту домішок.
3. Будь-які зміни не повинні виходити за допустимі межі затвердженої специфікації.
4. Методи випробувань залишилися незмінними або такі зміни є незначними.
5. Будь-який новий метод випробувань не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
6. Новий метод випробувань не належить до біологічних/імунобіологічних/імунохімічних методів або методу, при якому використовується біологічний реагент для аналізу субстанції біологічного походження (за включенням стандартних фармакопейних мікробіологічних методів).
7. Зміна не стосується домішки, яка має генотоксичну дію.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця щодо затверджених та запропонованих специфікацій.
3. Опис нового аналітичного методу та дані з його валідації (за необхідності).
4. Результати аналізу для двох промислових серій (трьох промислові серії для субстанцій біологічного походження, якщо не обґрунтовано інше) субстанції за всіма показниками, що зазначені у специфікації.
5. Порівняльні дані щодо профілю розчинення готового лікарського засобу для принаймні однієї дослідно-промисловій серії, що містить субстанцію за затвердженою та запропонованою специфікаціями (за необхідності) Для рослинних лікарських засобів можуть бути прийнятні дані щодо розпадання.
6. Обґрунтування/оцінка ризику від власника реєстраційного посвідчення або власника мастер-файла на субстанцію (за необхідності), що підтверджує незначність зміненого параметру.
7. Обґрунтування від власника реєстраційного посвідчення або власника мастер-файла на субстанцію (за необхідності) введення нового методу випробування або допустимих меж, визначених у специфікаціях.
|
Б.I.б.2. Зміна у методах випробування субстанції або вихідного/проміжного продукту/реагенту, що використовується у процесі виробництва субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
а) незначні зміни у затверджених методах випробування |
1, 2, 3, 4, |
1, 2 |
IА |
|
б) видалення методу випробування для субстанції/реагенту/проміжного продукту, якщо альтернативний метод вже затверджений |
7 |
1 |
IА |
|
в) інші зміни в методах випробування (включаючи заміну або доповнення) для реагенту, що не спричиняє істотного впливу на якість субстанції |
1, 2, 3, 5, 6 |
1, 2 |
IA |
|
г) зміна (заміна) у біологічному/імунологічному/імунохімічному методі випробування або методі, у якому використовується біологічний реагент для субстанції біологічного походження, наприклад, пептидні карти, глік-карти тощо |
II |
||
|
ґ) інші зміни у методах випробування (включаючи заміну або доповнення) субстанції або вихідного/проміжного продукту |
1, 2 |
IБ |
Умови
1. Дослідження з валідації, які були проведені відповідно до чинних фармакопейних вимог або Керівних принципів з валідації (чинне видання), підтверджують, що результати аналізу, отримані за затвердженою та запропонованою методиками, ідентичні.
2. Не відбулося жодних змін меж загального вмісту домішок, не виявлено нових некваліфікованих домішок.
3. Методи випробувань залишилися незмінними (наприклад, змінилась довжина колонки або температура проведення аналізу але тип колонки або методика не змінні).
4. Новий метод випробувань не належить до біологічних/імунобіологічних/імунохімічних методів або методу, при якому використовується біологічний реагент для аналізу субстанції біологічного походження (за включенням стандартних фармакопейних мікробіологічних методів).
5. Будь-який новий метод випробування не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
6. Субстанція не є речовиною біологічного/імунологічного походження.
7. Існує затверджений метод випробування для показника специфікації і цей метод не затверджений при внесенні зміни типу ІА.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи опис методів контролю, звіт про дані з валідації, переглянуті допустимі межі для домішок (за необхідності).
2. Порівняльні дані з валідації, або, якщо обґрунтовано, порівняльні результати аналізу, які підтверджують, що затверджена та запропонована методики випробування ідентичні. Ця вимога не стосується випадку додавання нової методики випробування.
Б.I.в)Система упаковка/укупорка
|
Б.I.в.1. Зміна у безпосередній упаковці субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
а) якісні та/або кількісні зміни складу |
1, 2, 3 |
1, 2, 3, 4, 6 |
IА |
|
б) якісні та/або кількісні зміни складу для стерильних та не заморожених субстанцій біологічного/імунологічного походження |
II |
||
|
в) рідких субстанцій (не стерильних) |
1, 2, 3, 5, 6 |
IБ |
Умови
1. Запропонований пакувальний матеріал має бути ідентичним затвердженому за відповідними показниками якості.
2. Дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів ІСН щодо випробування стабільності (чинне видання) принаймні для двох дослідно-промислових або промислових серій субстанції і на момент випуску у розпорядженні заявника були задовільні дані по стабільності принаймні за три місяці. Однак, якщо запропонована упаковка більш стійкіша ніж затверджена, дані щодо стабільності за три місяці ще можуть бути не доступні. При цьому мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності невідповідності специфікаціям наприкінці терміну придатності/періоду повторного випробування (із запропонованими заходами).
3. Не стосується стерильних рідких субстанцій та субстанцій біологічного/імунологічного походження.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Відповідні дані щодо нової упаковки (наприклад, порівняльні дані про проникність, наприклад, для О2, СО2, вологи), включаючи підтвердження того, що пакувальний матеріал відповідає чинним фармакопейним вимогам щодо пакувальних матеріалів або законодавству ЄС щодо безпеки взаємодії пластикових пакувальних матеріалів та упаковок з харчовими продуктами.
3. Підтвердження відсутності будь-якої взаємодії між субстанцією та пакувальним матеріалом (наприклад, відсутнє перенесення компонентів запропонованого пакувального матеріалу до субстанції та немає жодних втрат компонентів упаковки), включаючи підтвердження того, що пакувальний матеріал відповідає чинним фармакопейним вимогам щодо пакувальних матеріалів або законодавству ЄС щодо безпеки взаємодії пластикових пакувальних матеріалів та упаковок з харчовими продуктами.
4. Підтвердження від власника реєстраційного посвідчення або власника мастер-файла на субстанцію (за необхідності), що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів ІСН щодо випробування стабільності (чинне видання) (із зазначенням кількості та номерів серій субстанції) та підтвердження (за необхідності), що на момент внесення змін заявником було надано мінімум, який вимагається, даних щодо стабільності та наявні дані не вказують на будь-яку проблему, пов’язану зі стабільністю. Мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності невідповідності специфікаціям наприкінці терміну придатності/періоду повторного випробування (із запропонованими заходами).
5. Результати дослідження стабільності, проведених згідно з Настановою або Керівними принципами ІСН щодо випробування стабільності (чинне видання) за відповідними параметрами принаймні для двох дослідно-промислових або промислових серій субстанції із задовільними показниками щодо стабільності принаймні за три місяці. При цьому мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності невідповідності специфікаціям наприкінці терміну придатності/періоду повторного випробування (із запропонованими заходами).
6. Порівняльна таблиця вимог затвердженої та запропонованої специфікацій (за необхідності).
|
Б.I.в.2. Зміни у параметрах специфікацій та/або допустимих меж, зазначених у специфікаціях, для первинної упаковки субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представ-лені |
Тип зміни |
|
а) звуження допустимих меж, зазначених у специфікаціях |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) доповнення специфікації новим показником та відповідним методом випробування |
1, 2, 5 |
1, 2, 3, 4, 6 |
IА |
|
в) вилучення незначного показника (наприклад, вилучення застарілого показника) |
1, 2 |
1, 2, 5 |
IА |
|
г) доповнення або заміна показника за результатами досліджень з безпеки або якості |
1, 2, 3, 4, 6 |
IБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду показників, зазначених у специфікації (наприклад, проведеною під час подання заяви на реєстрацію або внесення змін типу II), якщо раніше вона була розглянута і затверджена як частина послідовних змін.
2. Зміна не обумовлена непередбаченими обставинами, що виникли в процесі виробництва пакувального матеріалу або зберігання субстанції.
3. Будь-які зміни не повинні виходити за допустимі межі затвердженої специфікації.
4. Методи випробувань залишилися незмінними або такі зміни є незначними.
5. Новий метод випробування не належить до нестандартного методу або стандартного методу, що використовується у новий спосіб.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця вимог затвердженої та запропонованої специфікацій.
3. Опис нового методу випробування та дані з його валідації (за необхідності).
4. Результати аналізу для двох серій первинної упаковки за всіма показниками, зазначеними у специфікації.
5. Обґрунтування від власника реєстраційного посвідчення або власника мастер-файла на субстанцію, що показник якості не є суттєвим (за необхідності).
6. Обґрунтування від власника реєстраційного посвідчення або власника мастер-файла на субстанцію нових показників якості та допустимих меж, зазначених у специфікації.
|
Б.I.в.3. Зміна в методах випробування первинної упаковки субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначні зміни у затверджених методах випробування |
1, 2, 3 |
1, 2 |
IА |
|
б) інші зміни в методах випробування (включаючи заміну або доповнення) |
1, 3, 4 |
1, 2 |
IА |
|
в) вилучення методу випробування, якщо альтернативний метод випробування вже затверджений |
5 |
1 |
IА |
Умови
1. Відповідні дослідження з валідації, які були проведені відповідно до чинних фармакопейних вимог або Керівних принципів з валідації (чинне видання), та результати підтверджують, що затверджена та запропонована методики ідентичні.
2. Методи випробувань залишилися незмінними (наприклад, змінилась довжина колонки або температура проведення аналізу але тип колонки або методика не змінні).
3. Новий метод випробування не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
4. Субстанція не є речовиною біологічного/імунологічного походження.
5. Існує затверджений метод випробування для показника специфікації і цей метод не затверджений при внесенні змін типу ІА.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, які включають опис методу випробування та звіт про дані з валідації.
2. Порівняльні дані з валідації або, якщо обумовлено, порівняльні результати аналітичних випробувань, які підтверджують ідентичність результатів, отриманих за затвердженим та новим методами. Це не стосується випадків додавання нового методу випробування.
Б.I.г) Стабільність
|
Б.I.г.1. Зміна періоду повторних випробувань/терміну придатності або умов зберігання субстанції (за наявності у затвердженому досьє сертифікату відповідності Європейській фармакопеї, що включає період повторного випробування) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) період повторного випробування/термін придатності |
|||
|
1. зменшення |
1 |
1, 2, 3 |
ІА |
|
2. збільшення періоду повторного випробування на основі екстраполяції результатів дослідження стабільності, проведених не у відповідності до Настанови або Керівних принципів ІСН щодо випробування стабільності (*) |
ІІ |
||
|
3. збільшення терміну придатності субстанції біологічного/імунологічного походження на основі результатів досліджень, виконаних не у відповідності до затвердженого протоколу |
ІІ |
||
|
4. збільшення або введення періоду повторного випробування/терміну придатності на основі результатів досліджень у реальному часі |
1, 2, 3 |
ІБ |
|
|
б) умови зберігання |
|||
|
1. обмеження умов зберігання |
1 |
1, 2, 3 |
ІА |
|
2. зміна умов зберігання субстанції біологічного/імунологічного походження, якщо дослідження стабільності ще не проводились відповідно до затвердженого протоколу |
II |
||
|
3. зміна умов зберігання субстанції |
1, 2, 3 |
ІБ |
Умови
Зміна не обумовлена непередбаченими обставинами у процесі виробництва або проблемами щодо стабільності.
Документація
1. Зміни до відповідних розділів реєстраційного досьє повинні містити результати досліджень стабільності, представлені у реальному часі, і проведені відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання), принаймні для двох (трьох — для лікарських засобів біологічного походження) дослідно-промислових або промислових серій субстанції у затвердженій упаковці з відповідним періодом повторного випробування у визначених умовах зберігання.
2. Підтвердження, що дослідження стабільності виконані відповідно до затвердженого протоколу. Дослідження повинні підтвердити відповідність специфікацій.
3. Копії затверджених специфікацій на субстанцію.
(*) Період повторного випробування не застосовується до субстанцій біологічного/імунологічного походження.
Б.1.ґ) Проектний простір
|
Б.I.ґ.1. Введення нового проектного простору або розширення затвердженого для субстанції щодо |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) одного елементу виробничого процесу субстанції, включаючи контроль в процесі виробництва та/або методи випробування |
1, 2, 3 |
II |
|
|
б) методів випробувань для вихідних матеріалів/реагентів/проміжних продуктів та/або субстанції |
1, 2, 3 |
II |
Документація
1. Проектний простір був розроблений відповідно до Європейських та міжнародних наукових керівництв. Результати досліджень розробки препарату, виробничого процесу або методів випробувань (наприклад, необхідно вивчити взаємодію різних параметрів, що формують проектний простір, включаючи дослідження оцінки ризику та багатомірні дослідження, якщо необхідно), які демонструють, що функціональна взаємодія властивостей матеріалу та параметрів процесу, які можуть впливати на критичні характеристики якості субстанції, була досягнута.
2. Опис проектного простору у формі таблиці, включаючи змінні (властивості матеріалу та параметри процесу, якщо необхідно) та їх запропоновані діапазони.
3. Зміни до відповідних розділів реєстраційного досьє.
|
Б.I.ґ.2. Внесення змін після затвердження протоколу управління для субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
II |
Документація
1. Детальний опис запропонованої зміни.
2. Протокол управління змінами для субстанції.
|
Б.I.ґ.3. Вилучення затвердженого протоколу управління змінами для субстанції |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1 |
IА |
Умови
Вилучення не спричинене непередбаченими обставинами або результатами випробувань, що виходять за межі специфікацій під час внесення зміни, описаної у протоколі.
Документація
Обґрунтування запропонованого вилучення.
Б.II. Готовий лікарський засіб
Б.II.а) Опис та склад
|
Б.II.а.1. Зміна або додавання штампів, потовщень або інших маркувань, уключаючи заміну або додавання фарб для маркування лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) зміни штампів, потовщень або інших маркувань |
1, 2, 3 |
1, 2 |
IА |
|
б) зміни риски, призначеної для розділу таблетки на рівні дози |
1, 2, 3 |
IБ |
Умови
1. Специфікації при випуску і наприкінці терміну придатності готового лікарського засобу не змінилися (крім зовнішнього вигляду).
2. Будь-яка фарба повинна відповідати вимогам до фармацевтичної продукції.
3. Риски не призначені для розділу на рівні дози.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи детальне зображення або опис затвердженого та запропонованого вигляду лікарського засобу, а також оновлену коротку характеристику лікарського засобу (за необхідності).
2. Зразки готового лікарського засобу (за потреби).
3. Результати фармакопейних випробувань, що підтверджують відповідність характеристик/правильного дозування лікарського засобу.
|
Б.II.а.2. Зміна форми або розмірів лікарської форми |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) таблетки з негайним вивільненням, капсули, супозиторії та песарії |
1, 2, 3, 4 |
1, 4 |
IА |
|
б) лікарські форми, стійкі до дії шлункового соку, з модифікованим або пролонгованим вивільненням та ділимі таблетки, призначені для розділу на рівні дози |
1, 2, 3, 4, 5 |
IБ |
Умови
1. Порівняння профілів розчинення лікарського засобу з новими та затвердженими формою або розмірами (за необхідності). Для рослинних лікарських засобів, коли випробування на розчинення не може бути проведене — дані щодо розпадання.
2. Специфікації при випуску та наприкінці терміну придатності лікарського засобу не змінюються (крім розміру).
3. Якісний та кількісний склад, середня маса лікарського засобу залишаються незмінними.
4. Зміни не стосуються таблеток з рискою, призначеною для розподілу на рівні дози.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи детальне зображення затверджених та запропонованих форми або розміру, а також оновлену коротку характеристику лікарського засобу (за необхідності).
2. Порівняльні дані досліджень для принаймні однієї дослідно-промислової серії лікарського засобу, які підтверджують відсутність змін у профілі розчинення (див. Керівництво з дослідження біодоступності) для нового та затвердженого розміру або форми. Для рослинних лікарських засобів можуть бути прийнятними дані щодо розпадання.
3. Обґрунтування відсутності необхідності проведення нового дослідження з біоеквівалентності у відповідності до Керівництва з дослідження біодоступності.
4. Зразки готового лікарського засобу з новим розміром або формою (за потреби).
5. Результати фармакопейних випробувань, що підтверджують відповідність характеристик/правильного дозування лікарського засобу.
|
Б.II.а.3. Зміна у складі (допоміжних речовинах) готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) смакові добавки або барвники |
|||
|
1. додавання, вилучення або заміна |
1, 2, 3, 4, 5, 6, 7, 9 |
1, 2, 4, 5, 6 |
IА |
|
2. збільшення або зменшення |
1, 2, 3, 4 |
1, 2, 4 |
IА |
|
б) інші допоміжні речовини |
II |
||
|
1. будь-яка незначна зміна кількісного складу допоміжних речовин у готовому лікарському засобі |
1, 2, 4, 8, 9, 10 |
1, 2, 7 |
IА |
|
2. якісні або кількісні зміни щодо однієї або декількох допоміжних речовин, які можуть значно вплинути на безпеку, якість або ефективність готового лікарського засобу |
II |
||
|
3. зміна у лікарському засобі біологічного/імунологічного походження |
II |
||
|
4. будь-яка нова допоміжна речовина, що включає використання матеріалів людського або тваринного походження, для яких вимагається оцінка даних з вірусної безпеки або ризику передачі збудників ГЕ |
II |
||
|
5. зміна, яка підтверджується дослідженнями з біоеквівалентності |
II |
||
|
6. заміна однієї допоміжної речовини на іншу з тими самими функціональними характеристиками та на тому ж рівні |
1, 3, 4, 5, 6, 7, 8, 9 |
IБ |
Умови
1. Не відбулося будь-яких змін функціональних характеристик лікарської форми, наприклад часу розпадання, профілю розчинення.
2. Будь-яке незначне коригування складу для збереження загальної маси повинно проводитись у відношенні допоміжної речовини, що становить основну частину складу готового лікарського засобу.
3. Специфікації готового лікарського засобу змінилися тільки у частині зовнішнього вигляду/запаху/смаку і, за потреби, вилучений показник якості щодо ідентифікації.
4. Розпочаті дослідження стабільності відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) (із зазначенням номерів серій) для принаймні двох дослідно-промислових або промислових серій із задовільними результатами стабільності протягом трьох місяців (на час подання змін типу IA або IБ), які демонструють подібність профілю стабільності до вже затвердженого. Заявник гарантує, що дослідження будуть завершені, і одразу по завершенні досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або за наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (з відповідною пропозицією). Крім того, за потреби, мають бути проведені дослідження фотостабільності готового лікарського засобу.
5. Будь-які нові компоненти повинні відповідати встановленим вимогам.
6. Будь-який новий компонент не повинен передбачати використання матеріалів людського або тваринного походження, для яких необхідна оцінка вірусної безпеки або ризику передачі збудників ГЕ.
7. Зміна не впливає на відмінності між дозуваннями та не спричиняє негативного впливу на смакову прийнятність педіатричних форм (за потреби).
8. Профіль розчинення принаймні двох дослідно-промислових серій запропонованого складу та у затвердженим складом лікарського засобу демонструє відсутність будь-яких відмінностей (див. Керівництво з дослідження біодоступності) Для рослинних лікарських засобів, коли випробування на розчинення не може бути проведене — дані щодо розпадання.
9. Зміна не обумовлена проблемами зі стабільністю та/або не повинна спричиняти можливі проблеми, пов’язані з безпекою, тобто розходження між дозуваннями.
10. Лікарський засіб не відноситься до препаратів біологічного/імунологічного походження.
Документація
1. Зміни до відповідних розділів реєстраційного досьє (включаючи метод ідентифікації будь-якого нового барвника, за потреби), а також оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
2. Підтвердження, що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) (із зазначенням номерів серій) та підтвердження, за необхідності, що на момент внесення змін заявником було надано мінімум, який вимагається, даних щодо стабільності, а також наявні дані не вказували на будь-яку проблему, пов’язану зі стабільністю. Мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
3. Результати дослідження стабільності, розпочатими до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання), за відповідними параметрами принаймні для двох дослідно-промислових або промислових серій субстанції із задовільними показниками стабільності принаймні за три місяці. При цьому мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
4. Зразок готового лікарського засобу з новим складом (за потреби).
5. ГЕ Сертифікат відповідності Європейській Фармакопеї на будь-який новий вихідний матеріал тваринного походження або, якщо необхідно, документальне підтвердження того, що вихідне джерело одержання допоміжної речовини, яке має ризик передачі збудників ГЕ, попередньо оцінено вповноваженими органами країни-виробника та відповідає Керівництву з мінімізації ризику передачі збудників губчатої енцефалопатії тварин з лікарськими засобами (чинне видання). Інформація повинна містити: назву виробника, види та тканини тварин, з яких було одержано вихідний матеріал, назву країни-постачальника тваринної сировини, її використання.
6. Дані, які підтверджують, що нова допоміжна речовина не впливає на методи контролю готового лікарського засобу, визначені у специфікації (за потреби).
7. Обґрунтування зміни/вибору допоміжних речовин тощо, що має бути представлено відповідно до фармацевтичної розробки (включаючи стабільність та антимікробні консерванти, за необхідності).
8. Для твердих лікарських форм порівняльні дані щодо профілю розчинення принаймні для двох дослідно-промислових серій лікарського засобу з новим та затвердженим складом. Для рослинних лікарських засобів можуть бути прийнятними дані щодо розпадання.
9. Обґрунтування відсутності необхідності проведення нового дослідження біоеквівалентності відповідно до Настанови або Керівництва з дослідження біодоступності та біоеквівалентності (чинне видання).
|
Б.II.a.4. Зміна маси покриття лікарських форм для перорального застосування або зміна маси оболонки капсул |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) тверді лікарські форми для перорального застосування |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) лікарські форми, стійкі до дії шлункового соку, з модифікованим вивільненням або пролонгованої дії, для яких покриття є вирішальним чинником механізму вивільнення |
II |
Умови
1. Відсутність змін у профілі розчинення принаймні двох дослідно-промислових серій лікарського засобу із запропонованим та затвердженим складом. Для рослинних лікарських засобів, коли випробування на розчинення не може бути проведене — дані щодо розпадання.
2. Покриття не є вирішальним чинником механізму вивільнення.
3. Специфікації готового лікарського засобу змінені тільки щодо маси і розміру (за необхідності).
4. Дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання), для принаймні двох дослідно-промислових або промислових серій із задовільними результатами стабільності протягом трьох місяців або більше. Заявник гарантує, що дослідження будуть завершені, і одразу по завершенні досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або за наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (з відповідною пропозицією).
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Підтвердження, що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання), (із зазначенням номерів серій), та підтвердження, за необхідності, що на момент внесення змін заявником було надано мінімум, який вимагається, даних щодо стабільності. Мають бути надані гарантії того, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами). Крім того, у відповідних випадках, мають бути проведені дослідження фотостабільності готового лікарського засобу.
|
Б.II.a.5. Зміна концентрації в окремій дозі багатодозового лікарського засобу для парентерального застосування, коли кількість діючої речовини на одиницю дози (тобто сила дії) не змінюється |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
II |
|||
|
Б.II.a.6. Вилучення контейнера з розчинником з упаковки |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
IБ |
Документація
1. Обґрунтування вилучення, включаючи заяву щодо альтернативних шляхів отримання розчинника, необхідного для безпечного та ефективного застосування лікарського засобу.
2. Оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці.
Б.II.б)Виробництво
|
Б.II.б.1. Заміна або введення додаткової дільниці виробництва для частини або всього виробничого процесу готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) дільниця для вторинного пакування |
1, 2 |
1, 3, 8 |
IА |
|
б) дільниця для первинного пакування |
1, 2, 3, 4, 5 |
1, 2, 3, 4, 8, 9 |
IА |
|
в) дільниця, на якій проводяться будь-які виробничі стадії, за виключенням випуску серій, проведення контролю якості та вторинного пакування, для лікарських засобів біологічного/імунологічного походження |
II |
||
|
г) дільниця, яка вимагає проведення первинної перевірки виробництва або перевірки виробництва конкретного готового лікарського засобу |
II |
||
|
ґ) дільниця, на якій проводяться будь-які виробничі стадії, за виключенням випуску серій, контролю якості, первинного та вторинного пакування, для нестерильних лікарських засобів |
1, 2, 3, 4, 5, 6, 7, 8, 9 |
IБ |
|
|
д) дільниця, на якій проводяться будь-які виробничі стадії, за виключенням випуску серії, контролю якості та вторинного пакування для стерильних лікарських засобів, що вироблені з використанням асептичного методу, за виключенням лікарських засобів біологічного/імунологічного походження |
1, 2, 3, 4, 5, 6, 7, 8 |
IБ |
Умови
1. Задовільні результати перевірки виробництва за останні три роки, що проведена компетентними уповноваженими органами держав, які входять до PIC/s, Інспекцією ВООЗ або уповноваженим органом України.
2. Дільниця має дозвіл (ліцензію) на виробництво відповідних лікарських форм або лікарського засобу.
3. Даний лікарський засіб є нестерильним.
4. У разі необхідності, наприклад, для суспензій та емульсій проведена схема валідації процесу або успішно виконана валідація виробництва на новій дільниці, відповідно до затвердженого протоколу принаймні на трьох промислових серіях.
5. Даний лікарський засіб не є лікарським засобом біологічного/імунологічного походження.
Документація
1. Підтвердження, що запропонована дільниця виробництва має відповідний дозвіл на виробництво лікарської форми або лікарського засобу, а саме:
- для виробничої дільниці в Україні — копія чинної ліцензії на виробництво;
- для виробничої дільниці поза межами України, якщо існує взаємна угода про підтвердження GMP — копія чинної ліцензії на виробництво, копія сертифіката GMP або документа, еквівалентного сертифікату GMP, виданого уповноваженим органом країни-виробника протягом останніх трьох років;
- для виробничої дільниці поза межами України, якщо відсутня взаємна угода про підтвердження GMP — документ, виданий уповноваженим органом України, або копія чинної ліцензії на виробництво, копія сертифіката GMP або документа, еквівалентного сертифікату GMP, виданого уповноваженим органом країни-виробника протягом останніх трьох років.
2. Інформація щодо кількості (3), номерів, розміру та дати виробництва серій, які використовуються у дослідженнях з валідації, дані з валідації або протокол (схема) валідації (за потреби).
3. Заява про внесення змін має чітко визначати «затвердженого» та «запропонованого» виробників готового лікарського засобу, як зазначено в розділі 2.5 форми заяви про державну реєстрацію.
4. Копії затверджених специфікацій при випуску та наприкінці терміну придатності (за потреби).
5. Порівняльні дані аналізів однієї промислової та двох дослідно-промислових серій (або двох промислових серій), вироблених на запропонованій дільниці та трьох серій, вироблених на затвердженій дільниці. Дані про наступні дві промислові серії мають бути надані на вимогу або, у разі невідповідності специфікаціям, представлені в Центр (з відповідною пропозицією).
6. Для м’яких та рідких лікарських форм, у яких субстанція присутня у нерозчиненій формі, мають бути надані необхідні дані з валідації, мікроскопічне зображення розподілу та морфологія часток.
7. Якщо нова виробнича дільниця використовує субстанцію як вихідний матеріал — заява уповноваженої особи (УО), яка відповідає за випуск серії на дільниці, що субстанція виробляється згідно з Керівництвами з належної виробничої практики щодо вихідних матеріалів (чинне видання).
8. Зміни до відповідних розділів реєстраційного досьє.
9. Якщо виробництво готового лікарського засобу та його первинне пакування здійснюється на різних виробничих дільницях, слід визначити умови транспортування та зберігання готового лікарського засобу у формі in bulk та провести дослідження з їх валідації.
Примітки. За відсутності сертифіката GMP, визнаного в Україні, власникам реєстраційного посвідчення рекомендується проконсультуватися з відповідними вповноваженими органами до подання заяви та надати інформацію про будь-яку інспекцію виробництва за останні 2-3 роки та/або будь-які заплановані інспекції, включаючи дати інспекцій, категорію лікарського засобу, що інспектується, наглядовий орган та іншу відповідну інформацію. Це полегшить організацію проведення інспекції з GMP, якщо необхідно.
Заяви УО щодо субстанцій
Виробники повинні використовувати у якості вихідних матеріалів тільки ті субстанції, що виробляються відповідно до GMP, таким чином, кожний виробник, що використовує субстанції у якості вихідного матеріалу, повинен надати необхідну заяву. Крім того, оскільки УО, відповідальна за сертифікацію серії, несе сукупну відповідальність за кожну серію, у разі, коли контроль серії відбувається на інший дільниці, необхідна додаткова заява від УО, відповідальної за контроль.
У багатьох випадках виробником виступає одна особа, тож необхідно надавати тільки одну заяву. Однак, якщо виробників більше одного, то заявник може надати тільки одну заяву, підписану одною УО, за умови, що:
- із заяви зрозуміло, що вона складена від імені всіх задіяних УО;
- є у наявності письмовий контракт між заявником та виробником, у якому чітко визначені обов’язки кожної зі сторін, а УО, що надає заяву, зазначена у контракті як особа, що несе відповідальність за дотримання вимог GMP при виробництві субстанції.
Примітка. Заходи підлягають інспектуванню компетентними органами.
Заявником підтверджується, що він користується послугами, принаймні однієї УО, яка знаходиться в ЄЕЗ. Тому заяви від персоналу, який найнятий виробниками у третіх країнах, включаючи тих, що знаходяться у країнах-партнерах за угодою про взаємне визнання, не можуть бути прийняті.
Виробництво лікарського засобу — діяльність, пов’язана з серійним випуском лікарських засобів, яка включає всі або хоча б одну зі стадій технологічного процесу, у тому числі процеси фасування, пакування і маркування, контроль якості в процесі виробництва, контроль якості готової продукції.
Заява не вимагається для крові або компонентів крові, що повинні відповідати вимогам Директиви 2002/98/ЄС.
|
Б.II.б.2. Зміни, що стосуються випуску серії та контролю якості готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) заміна або додавання дільниці, на який здійснюється контроль/випробування серії |
2, 3, 4 |
1, 2, 5 |
IА |
|
б) заміна або додавання виробника, відповідального за випуск серії |
|||
|
1. не включаючи контроль/випробування серії |
1, 2 |
1, 2, 3, 4, 5 |
IА |
|
2. включаючи контроль/випробування серії |
1, 2, 3, 4 |
1, 2, 3, 4, 5 |
IА |
|
3. включаючи контроль/випробування серії для лікарського засобу біологічного/імунологічного походження та один з методів аналізу, що застосовується на дільниці, є біологічним/імунологічним/імунохімічним методом |
II |
Умови
1. Місцезнаходження виробника, відповідального за випуск серії, повинно бути на території ЄЕЗ.
2. Дільниця повинна мати відповідний дозвіл.
3. Лікарський засіб не є лікарським засобом біологічного/імунологічного походження.
4. Перенесення з затвердженої до нової дільниці або лабораторії має бути успішно виконано.
Документація
1. для виробничої дільниці в Україні — копія чинної ліцензії на виробництво;
для виробничої дільниці поза межами України, якщо існує взаємна угода про підтвердження GMP — копія чинної ліцензії на виробництво, копія сертифіката GMP або документа, еквівалентного сертифікату GMP, виданого уповноваженим органом країни-виробника протягом останніх трьох років. Якщо відсутня взаємна угода про підтвердження GMP — документ, виданий уповноваженим органом України, або копія чинної ліцензії на виробництво, копія сертифіката GMP або документа, еквівалентного сертифікату GMP, виданого уповноваженим органом країни-виробника протягом останніх трьох років.
2. Заява про внесення змін має чітко визначати «затвердженого» та «запропонованого» виробників готового лікарського засобу, як зазначено в розділі 2.5 форми заяви про державну реєстрацію.
3. Заява уповноваженої особи (УО), яка відповідає за контроль якості серії, що субстанція виробляється згідно з Керівництвами з належної виробничої практики щодо вихідних матеріалів. Узагальнена заява може бути прийнятною за певних умов (див. примітку до п. Б.II.б.1.).
4. Зміни до відповідних розділів реєстраційного досьє, включаючи оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
|
Б.II.б.3. Зміни у процесі виробництва готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначна зміна у процесі виробництва твердої лікарської форми для перорального застосування з негайним вивільненням або розчинів для перорального застосування |
1, 2, 3, 4, 5, 6, 7 |
1, 3, 4, 6, 7, 8 |
ІА |
|
б) зміна у процесі виробництва, яка може мати істотний влив на якість, безпеку та ефективність лікарського засобу |
II |
||
|
в) лікарський засіб є лікарським засобом біологічного/імунологічного походження та зміна вимагає проведення порівняльних досліджень |
ІІ |
||
|
г) ведення нестандартного методу кінцевої стерилізації |
ІІ |
||
|
ґ) введення або збільшення припустимого надлишку діючої речовини |
ІІ |
||
|
д) незначна зміна у процесі виробництва водної суспензії для перорального застосування |
1, 2, 4, 6, 7, 8 |
IБ |
Умови
1. Немає жодних змін у якісних або кількісних показниках профілю домішок або у фізико-хімічних властивостях.
2. Даний лікарських засіб не є лікарським засобом біологічного/імунологічного або рослинного походження.
3. Виробничий процес, який включає окремі стадії, залишається таким самим, наприклад обробка проміжних продуктів, і немає жодних змін у будь-якому розчиннику, що використовується у процесі виробництва.
4. Затверджений виробничий процес має контролюватися відповідним методами і ці методи не потребують жодних змін (розширення або вилучення допустимих меж).
5. Специфікації на готовий лікарський засіб або проміжні продукти залишаються незмінними.
6. Новий виробничий процес повинен забезпечити виготовлення аналогічного попередньому лікарського засобу за усіма показниками якості, безпеки та ефективності.
7. Розпочаті дослідження стабільності відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) для принаймні однієї дослідно-промислової або промислової серії із задовільними результатами стабільності протягом трьох місяців або більше. Заявник гарантує, що дослідження будуть завершені, і одразу по завершенні досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або за наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (з відповідною пропозицією).
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи порівняння затвердженого та запропонованого виробничого процесу.
2. Для м’яких та рідких лікарських форм, у яких діюча речовина міститься у нерозчинній формі — відповідні дані з валідації змін, включаючи мікроскопію часток для перевірки видимих змін у морфології; порівняльні дані гранулометричного складу за відповідним методом.
3. Для твердих лікарських форм — дані, що підтверджують відсутність змін у профілі розчинення однієї промислової серії, виробленої за зміненою технологією порівняно з останніми трьома серіями, виробленими за узгодженою технологією. Дані про наступні дві повні промислові серії мають бути надані на вимогу, або у разі невідповідності специфікаціям буде повідомлено Центр (з відповідною пропозицією). Для рослинних лікарських засобів можуть бути прийнятними дані щодо розпадання.
4. Обґрунтування відсутності необхідності проведення досліджень біоеквівалентності відповідно до Настанови або Керівництв з дослідження біодоступності (чинне видання).
5. У разі зміни у процесі стерилізації, необхідно надати дані з валідації.
6. Копія затверджених специфікацій при випуску та наприкінці терміну придатності.
7. Дані аналізів (у вигляді порівняльної таблиці) принаймні однієї промислової серії, виробленої за узгодженою та запропонованою технологіями. Дані про наступні дві повні промислові серії мають бути надані на вимогу, або у разі невідповідності специфікаціям буде повідомлено Центр (з відповідною пропозицією).
8. Підтвердження, що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) (із зазначенням номерів серій) для принаймні однієї дослідно-промислової або промислової серії із задовільними результатами стабільності протягом трьох місяців або більше та профілем стабільності, подібним до профілю стабільності лікарського засобу, виробленого за узгодженою технологією. Мають бути надані гарантії того, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
|
Б.II.б.4. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) збільшення до 10 разів порівняно із затвердженим розміром |
1, 2, 3, 4, 5, 7 |
1, 4 |
IА |
|
б) зменшення до 10 разів |
1, 2, 3, 4, 5, 6 |
1, 4 |
IА |
|
в) зміна вимагає оцінки порівнянності (проведення порівняльних досліджень) лікарського засобу біологічного/імунологічного походження |
ІІ |
||
|
г) зміна стосується всіх інших лікарських форм сукупного (комплексного) виробничого процесу |
ІІ |
||
|
ґ) збільшення більш ніж у 10 разів порівняно із затвердженим розміром для твердих лікарських форм з негайним вивільненням |
1, 2, 3, 4, 5, 6 |
ІБ |
|
|
д) масштаб для лікарського засобу біологічного/імунологічного походження збільшився/зменшився без зміни виробничого процесу (наприклад, дублювання лінії) |
1, 2, 3, 4, 5, 6 |
ІБ |
Умови
1. Зміна не впливає на відтворюваність та/або постійність лікарського засобу.
2. Зміна стосується тільки твердих лікарських форм з негайним вивільненням для перорального застосування або нестерильних рідких лікарських форм.
3. Будь-які зміни методу виробництва та/або контролю у процесі виробництва спричинені зміною розміру серії, наприклад, використанням обладнання іншої продуктивності.
4. Існує схема валідації або валідація виробництва була успішно проведена згідно із затвердженим протоколом з використанням принаймні трьох серій лікарського засобу нового розміру відповідно до Настанови або Керівництв з валідації виробництва (чинне видання).
5. Даний лікарський засіб не є лікарським засобом біологічного/імунологічного походження.
6. Зміна не обумовлена непередбаченими обставинами у процесі виробництва або пересторогами щодо стабільності.
7. Попередній розмір серії не був затверджений під час внесення зміни типу ІА.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Дані аналізів (у вигляді порівняльної таблиці) принаймні однієї промислової серії затвердженого та запропонованого розмірів. Дані про наступні дві повні промислові серії мають бути надані на вимогу або у разі невідповідності специфікаціям, буде повідомлено Центр (з відповідною пропозицією).
3. Копії затверджених специфікацій при випуску та наприкінці терміну придатності.
4. Інформація щодо кількості (3), номерів, розмірів серій лікарських засобів та дат їх виробництва, що використовуються у дослідженнях з валідації, або схема валідації.
5. Дані з валідації.
6. Підтвердження, що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) (із зазначенням кількості та номерів серій) для принаймні однієї дослідно-промислової або промислової серії із задовільними результатами стабільності протягом трьох місяців або більше. Мають бути надані гарантії того, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами). Для лікарських засобів біологічного/імунологічного походження — підтвердження відсутності необхідності проведення порівняльних досліджень.
|
Б.II.б.5. Зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) звуження допустимих меж |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) доповнення нового методу випробування та допустимих меж |
1, 2, 5, 6 |
1, 2, 3, 4, 5, 7 |
IА |
|
в) вилучення несуттєвого випробування |
1, 2 |
1, 2, 6 |
IА |
|
г) вилучення випробування у процесі виробництва, яке може мати істотний вплив на загальну якість готового лікарського засобу |
ІІ |
||
|
ґ) розширення затверджених допустимих меж для показників, які можуть мати істотний вплив на загальну якість готового лікарського засобу |
ІІ |
||
|
д) доповнення або заміна випробування за результатами досліджень з безпеки або якості |
1, 2, 3, 4, 5, 7 |
ІБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду допустимих меж специфікацій (наприклад, проведеною під час подання заяви на реєстрацію або внесення змін типу II).
2. Зміна не обумовлена непередбаченими обставинами у процесі виробництва, наприклад утворенням нової некваліфікованої домішки, зміною допустимих меж загального вмісту домішок.
3. Будь-яка зміна не повинна виходити за допустимі межі затвердженої специфікації.
4. Метод випробування залишається незмінним або такі зміни є незначними.
5. Будь-який новий метод випробування не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
6. Новий метод випробування не належить до біологічного/імунологічного/імунохімічного методу або методу, у якому використовується біологічний реактив для субстанції біологічного походження (за виключенням стандартних фармакопейних мікробіологічних методів).
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця щодо затвердженого та запропонованого випробування та допустимих меж.
3. Опис будь-якого нового методу випробування та дані з його валідації (за необхідності).
4. Дані аналізів для двох промислових серій (трьох промислових серій для лікарських засобів біологічного походження, якщо не обґрунтовано інше) готового лікарського засобу за всіма показниками специфікацій.
5. Порівняльні дані щодо профілю розчинення для готового лікарського засобу принаймні однієї дослідної серії, виготовленої за затверджених та запропонованих умов (за необхідності). Для рослинних лікарських засобів можуть бути прийнятні дані щодо розпадання.
6. Обґрунтування/оцінка ризику, що підтверджує незначність зміненого параметру.
7. Обґрунтування введення нового випробування у процесі виробництва та допустимих меж.
Б.II.в) Контроль допоміжних речовин
|
Б.II.в.1. Зміна параметрів специфікацій та/або допустимих меж для допоміжної речовини |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) звуження допустимих меж |
1, 2, 3, 4 |
1, 2 |
ІА |
|
б) доповнення специфікації новим показником з відповідним методом випробування |
1, 2, 5, 6, 7 |
1, 2, 3, 4, 6, 8 |
ІА |
|
в) вилучення із специфікації незначного показника (наприклад, вилучення застарілого показника) |
1, 2 |
1, 2, 7 |
ІА |
|
г) зміна знаходиться поза затвердженими допустимими межами специфікацій |
ІІ |
||
|
ґ) вилучення із специфікації показника, який може мати істотний вплив на загальну якість готового лікарського засобу |
ІІ |
||
|
д) доповнення або заміна показника специфікації за результатами досліджень з безпеки або якості (за виключенням лікарських засобів біологічного та імунологічного походження) |
1, 2, 3, 4, 5, 6, 8 |
ІБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду допустимих меж специфікацій (наприклад, проведеною під час подання заяви на реєстрацію або внесення змін типу II).
2. Зміна не обумовлена непередбаченими обставинами у процесі виробництва, наприклад утворення нової некваліфікованої домішки; зміна допустимих меж загального вмісту домішок.
3. Будь-яка зміна не повинна виходити за допустимі межі затвердженої специфікації.
4. Метод випробування залишається незмінним або такі зміни є незначними.
5. Будь-який новий метод випробування не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
6. Новий метод випробування не належить до біологічного/імунологічного/імунохімічного методу або методу, у якому використовується біологічний реактив для субстанції біологічного походження (за виключенням стандартних фармакопейних мікробіологічних методів).
7. Зміни не стосуються домішки, яка має генотоксичну дію.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця щодо затвердженої та запропонованої специфікацій.
3. Опис нового методу випробування та дані з його валідації (за необхідності).
4. Дані аналізів для двох промислових серій (трьох промислових серій для лікарських засобів біологічного походження, якщо не обґрунтовано інше) готового лікарського засобу за всіма показниками специфікацій.
5. Порівняльні дані профілю розчинення для готового лікарського засобу принаймні однієї дослідної серії з допоміжними речовинами, які відповідають затвердженій та запропонованій специфікаціям (за необхідності). Для рослинних лікарських засобів можуть бути прийнятні дані щодо розпадання.
6. Обґрунтування відсутності нових даних з біоеквіваленотності у відповідності до Настанови або Керівництв з дослідження біодоступності (чинне видання)(за необхідності).
7. Обґрунтування/оцінка ризику, що підтверджує незначність зміненого параметру.
8. Обґрунтування введення нового показника специфікації та допустимих меж.
|
Б.II.в.2. Зміна у методах випробування допоміжної речовини |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначні зміни у затверджених методах випробувань |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) вилучення методу випробування, якщо альтернативний метод випробування вже затверджений |
5 |
1 |
ІА |
|
в) заміна біологічного/імунологічного/імунохімічного методу випробування або методу, у якому використовується біологічний реагент |
ІІ |
||
|
г) інші зміни у методах випробування (включаючи заміну або додавання) |
1, 2 |
IБ |
Умови
1. Дослідження з валідації були проведені відповідно до чинних фармакопейних вимог або Керівних принципів з валідації (чинне видання) та результати проведених досліджень підтверджують, що нова методика ідентична затвердженій.
2. Не було жодних змін меж загального вмісту домішок, не виявлено нових некваліфікованих домішок.
3. Методи випробувань залишилися незмінними (наприклад, змінилась довжина колонки або температура проведення аналізу але тип колонки або методика не змінні).
4. Новий метод випробувань не належить до біологічних/імунобіологічних/імунохімічних методів або методу, при якому використовується біологічний реагент для аналізу субстанції біологічного походження (за включенням стандартних фармакопейних мікробіологічних методів).
5. Існує затверджений метод випробування для показника специфікації і цей метод не затверджений при внесенні зміни типу ІА.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи опис методу аналізу, звіт про дані з валідації, оновлені специфікації щодо домішок (за необхідності).
2. Порівняльні дані з валідації або, якщо обґрунтовано, порівняльні результати аналізу, які підтверджують, що затверджений та запропонований методи випробування є ідентичними. Ця вимога не стосується випадку додавання нового методу випробування.
|
Б.II.в.3. Заміна джерела одержання допоміжної речовини або реактиву, що становить ризик передачі збудників ГЕ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) матеріалу, що становить ризик передачі збудників ГЕ, на матеріал рослинного або синтетичного походження |
|||
|
1. для допоміжних речовин або реактивів, які не використовуються у виробництві субстанції біологічного/імунологічного походження, або лікарського засобу біологічного/імунологічного походження |
1 |
1 |
IА |
|
2. для допоміжних речовин або реактивів, які використовуються у виробництві субстанції біологічного/імунологічного походження, або лікарського засобу біологічного/імунологічного походження |
1, 2 |
IБ |
|
|
б) заміна або додавання речовини, що становить ризик передачі збудників ГЕ, або заміна речовини, що становить ризик передачі збудників ГЕ, на іншу речовину, що становить ризик передачі збудників ГЕ, для якої немає ГЕ сертифіката відповідності Європейській фармакопеї |
II |
Умови
Специфікації при випуску та наприкінці терміну придатності на допоміжну речовину та готовий лікарський засіб залишаються незмінними.
Документація
1. Заява від виробника або заявника, яка підтверджує, що допоміжна речовина є речовиною виключно рослинного або синтетичного походження.
2. Результати дослідження еквівалентності матеріалів, їх впливу на виробництво кінцевої речовини та впливу на характеристики (наприклад, параметри розчинення) готового лікарського засобу.
|
Б.II.в.4. Зміни в методі синтезу або регенерації нефармакопейної допоміжної речовини (за наявності в досьє) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначні зміни у методі синтезу або регенерації |
1, 2 |
1, 2, 3, 4 |
IА |
|
б) зміни у специфікації або зміна фізико-хімічних властивостей допоміжної речовини, що може мати вплив на якість готового лікарського засобу |
ІІ |
||
|
в) допоміжна речовина є речовиною біологічного/імунологічного походження |
ІІ |
Умови
1. Метод синтезу та специфікації залишаються незмінними, відсутні зміни у якісних і кількісних показниках профілю домішок (за виключенням залишкових розчинників, за умови, що вони відповідають Керівним принципам ІСН) або фізико-хімічних властивостях.
2. За виключенням ад’ювантів для вакцин.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Дані аналізів (у формі порівняльної таблиці) принаймні двох серій (мінімум дослідно-промислових) з використанням допоміжної речовини, виготовленої за узгодженим та новим методами виробництва.
3. Порівняльні данні щодо профілю розчинення для готового лікарського засобу принаймні двох серій (мінімум дослідно-промислових) з використанням допоміжної речовини, виготовленої за узгодженим та новим методами виробництва (за необхідності). Для рослинних лікарських засобів можуть бути прийнятними дані щодо розпадання.
4. Копії затверджених та нових (за необхідності) специфікацій на допоміжну речовину.
Б.II.г) Контроль готового лікарського засобу
|
Б.II.г.1. Зміна параметрів специфікацій та/або допустимих меж готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) звуження допустимих меж |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) звуження допустимих меж для лікарського засобу, що підлягає офіційному випуску серії |
1, 2, 3, 4 |
1, 2 |
IА |
|
в) доповнення специфікації новим показником з відповідним методом випробування |
1, 2, 5, 6, 7 |
1, 2, 3, 4, 5, 7 |
IА |
|
г) вилучення незначного показника (наприклад, вилучення застарілого показника) |
1, 2 |
1, 2, 6 |
IА |
|
ґ) зміна знаходиться поза затвердженими допустимими межами |
ІІ |
||
|
д) вилучення показника, який може мати істотний вплив на якість готового лікарського засобу |
ІІ |
||
|
е) доповнення або заміна показника специфікації за результатами досліджень з безпеки або якості (за виключенням лікарських засобів біологічного/імунологічного походження) |
1, 2, 3, 4, 5, 7 |
ІБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду допустимих меж специфікацій (наприклад, проведеною під час подання заяви на реєстрацію або внесення змін типу II).
2. Зміна не обумовлена непередбаченими обставинами у процесі виробництва, наприклад, утворенням нової некваліфікованої домішки; зміною допустимих меж загального вмісту домішок.
3. Будь-яка зміна не повинна виходити за допустимі межі затвердженої специфікації.
4. Метод випробування залишається незмінним або такі зміни є незначними.
5. Будь-який новий метод випробування не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
6. Новий метод випробування не належить до біологічного/імунологічного/імунохімічного методу або методу, у якому використовується біологічний реактив для субстанції біологічного походження (за виключенням стандартних фармакопейних мікробіологічних методів).
7. Зміни не стосуються домішки, яка має генотоксичну дію.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця щодо затверджених та запропонованих специфікацій.
3. Опис нового методу випробування та дані з його валідації (за необхідності).
4. Дані аналізів для двох промислових серій (трьох промислових серій для лікарських засобів біологічного походження, якщо не обґрунтовано інше) готового лікарського засобу за всіма показниками специфікацій.
5. Порівняльні дані профілю розчинення для готового лікарського засобу принаймні однієї дослідної серії, які відповідають затвердженій та запропонованій специфікаціям (за необхідності). Для рослинних лікарських засобів можуть бути прийнятні дані щодо розпадання.
6. Обґрунтування/оцінка ризику, що підтверджує незначність зміненого параметру.
7. Обґрунтування введення нового показника та допустимих меж.
|
Б.II.г.2. Зміна у методах випробування готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначна зміна у затверджених методах випробування |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) вилучення методу випробування, якщо вже затверджений альтернативний метод |
4 |
1 |
IА |
|
в) зміна у біологічному/імунологічному/імунохімічному методі випробування або методі, у якому використовується біологічний реагент |
ІІ |
||
|
г) інші зміни у методах випробувань (включаючи заміну або доповнення) |
1, 2 |
IБ |
Умови
1. Дослідження з валідації були проведені відповідно до чинних фармакопейних вимог або Керівних принципів з валідації (чинне видання) та результати проведених досліджень підтверджують, що нова методика ідентична затвердженій.
2. Не було жодних змін меж загального вмісту домішок, не виявлено нових некваліфікованих домішок.
3. Методи випробувань залишилися незмінними (наприклад, змінилась довжина колонки або температура проведення аналізу але тип колонки або методика не змінні).
4. Новий метод випробувань не належить до біологічних/імунобіологічних/імунохімічних методів або методу, при якому використовується біологічний реагент для аналізу субстанції біологічного походження (за включенням стандартних фармакопейних мікробіологічних методів).
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи опис методу аналізу, звіт про дані з валідації, оновлені специфікації щодо домішок (якщо необхідно).
2. Порівняльні дані валідації або, якщо обґрунтовано, порівняльні результати аналізу, які підтверджують, що затверджений та запропонований методи випробування є ідентичними. Ця вимога не стосується випадку додавання нового методу випробування.
|
Б.II.г.3. Зміни, які стосуються виробничого процесу у реальному часі або випуску за параметрами для готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
ІІ |
Б.II.ґ) Система упаковка/укупорка
|
Б.II.ґ.1. Зміна у первинній упаковці готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
а) якісний та кількісний склад |
|||
|
1. тверді лікарські форми |
1, 2, 3 |
1, 2, 3, 4, 6 |
IА |
|
2. м’які та нестерильні рідкі лікарські форми |
1, 2, 3, 5, 6 |
IБ |
|
|
3. стерильні лікарські засоби та лікарські засоби біологічного/імунологічного походження |
ІІ |
||
|
4. зміна стосується зниження ступеню захисту оновленої упаковки, якщо наявні відповідні зміни в умовах зберігання та/або скорочення терміну придатності |
ІІ |
||
|
б) тип контейнера |
|||
|
1. тверді, м’які та нестерильні рідкі лікарські форми |
1, 2, 3, 5, 6, 7 |
ІБ |
|
|
2. стерильні лікарські засоби та лікарські засоби біологічного/імунологічного походження |
ІІ |
Умови
1. Зміна стосується лише одного типу упаковки/контейнеру (наприклад, заміна блістера на блістер).
2. Запропонований пакувальний матеріал повинен бути ідентичним затвердженому за відповідними властивостями.
3. Розпочаті дослідження стабільності відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) для принаймні двох дослідно-промислових або промислових серій із задовільними результатами стабільності протягом трьох місяців або більше. Однак, якщо запропонований пакувальний матеріал більш стійкий, ніж затверджений (наприклад, матеріал блістера має більшу товщину) дані щодо стабільності за три місяці ще не доступні. Мають бути надані гарантії того, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
2. Відповідні дані щодо нової упаковки (порівняльні дані про проникність, наприклад для O2, CO2, вологи).
3. Підтвердження відсутності (за необхідності) будь-якої взаємодії між лікарським засобом та пакувальним матеріалом (наприклад, не було перенесення компонентів запропонованого пакувального матеріалу до лікарського засобу та навпаки), включаючи підтвердження того, що пакувальний матеріал відповідає чинним фармакопейним вимогам щодо пакувальних матеріалів або законодавству ЄС щодо безпеки взаємодії пластикових пакувальних матеріалів та упаковок з харчовими продуктами.
4. Заява, що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) (із зазначенням номерів серій) та (за необхідності), що на момент внесення змін заявником було надано мінімум, який вимагається, даних щодо стабільності, а також наявні дані не вказували на будь-яку проблему, пов’язану зі стабільністю. Мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
5. Результати дослідження стабільності, які були розпочаті згідно з Настановою або Керівними принципами щодо дослідження стабільності лікарських засобів (чинне видання), за відповідними параметрами, принаймні, для двох дослідно-промислових або промислових серій лікарського засобу із задовільними показниками щодо стабільності принаймні за три місяці. При цьому мають бути надані гарантії того, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
6. Порівняльна таблиця вимог затвердженої та запропонованої специфікацій (за необхідності).
7. Зразки нової системи упаковка/укупорка (за необхідності).
Приміткадо пункту Б.II.ґ.1.б. Будь-яка зміна, що призводить до нової лікарської форми, потребує подання заяви на реєстрацію.
|
Б.II.ґ.2. Зміна параметрів специфікацій та/або допустимих меж первинної упаковки готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) звуження допустимих меж, визначених у специфікації |
1, 2, 3, 4 |
1, 2 |
IА |
|
б) доповнення специфікації новим показником з відповідним методом випробування |
1, 2, 5 |
1, 2, 3, 4, 6 |
IА |
|
в) вилучення незначного показника (наприклад, вилучення застарілого показника) |
1, 2 |
1, 2, 5 |
ІА |
|
г) додавання або заміна показника за результатами досліджень з безпеки або якості |
1, 2, 3, 4, 6 |
ІБ |
Умови
1. Зміна не обумовлена попередньою експертизою, що здійснювалась для перегляду параметрів специфікації (наприклад, проведеною під час подання заяви не реєстрацію або внесення змін типу II).
2. Зміна не обумовлена непередбаченими обставинами у процесі виробництва.
3. Будь-яка зміна на повинна виходити за допустимі межі затвердженої специфікації.
4. Методи випробування залишаються незмінними або такі зміни є незначними.
5. Будь-який новий метод випробування не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця вимог затвердженої та запропонованої специфікацій.
3. Опис нового методу випробування та дані з його валідації (за необхідності).
4. Результати аналізу для двох серій первинної упаковки за усіма показниками, зазначеними у специфікації.
5. Обґрунтування того, що показник є незначним.
6. Обґрунтування нового показника якості та допустимих меж.
|
Б.II.ґ.3. Зміна у методах випробування первинної упаковки готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) незначні зміни у затверджених методах випробувань |
1, 2, 3 |
1, 2 |
IА |
|
б) інші зміни у методах випробувань (включаючи заміну або додавання) |
1, 3, 4 |
1, 2 |
IА |
|
в) вилучення методу випробування, якщо вже затверджений альтернативний |
5 |
1 |
ІА |
Умови
1. Дослідження з валідації були проведені відповідно до чинних фармакопейних вимог або Керівних принципів з валідації (чинне видання) та результати проведених досліджень підтверджують, що нова методика ідентична затвердженій.
2. Методи випробувань залишилися незмінними (наприклад, змінилась довжина колонки або температура проведення аналізу але тип колонки або методика не змінні).
3. Будь-який новий метод випробувань не належить до нового нестандартного методу або стандартного методу, що використовується у новий спосіб.
4. Субстанція/готовий лікарський засіб не є речовиною/лікарським засобом біологічного/імунологічного походження.
5. Існує затверджений метод випробування для показника специфікації і цей метод не затверджений при внесенні зміни типу ІА.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи опис методу випробування та звіт з його валідації.
2. Порівняльні дані валідації або, якщо обумовлено, порівняльні результати аналізу, які підтверджують ідентичність результатів, отриманих за затвердженим та новим методами випробувань. Це не стосується випадків додавання нового методу випробування.
|
Б.II.ґ.4. Зміна форми або розміру контейнера чи закупорювального засобу (первинної упаковки) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) нестерильні лікарські засоби |
1, 2, 3 |
1, 2, 4 |
IА |
|
б) зміна форми або розміру основної частини пакувального матеріалу (вторинної упаковки), що може мати значний вплив на доставку, застосування, безпеку та стабільність готового лікарського засобу |
IІ |
||
|
в) стерильні лікарські засоби |
1, 2, 3, 4 |
ІБ |
Умови
1. Відсутні якісні або кількісні зміни складу пакувального матеріалу.
2. Зміна не стосується основної частини пакувального матеріалу, яка впливає на доставку, застосування, безпеку та стабільність готового лікарського засобу.
3. У разі зміни вільного простору над лікарським засобом або зміни у співвідношенні поверхня/об’єм, дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) принаймні для двох дослідно-промислових (трьох для лікарських засобів біологічного/імунологічного походження) або промислових серій лікарського засобу із задовільними показниками щодо стабільності принаймні за три місяці (шість місяців для лікарських засобів біологічного/імунологічного походження). При цьому мають бути надані гарантії того, що дослідження будуть завершені, і одразу по завершені досліджень отримані дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи опис, детальне зображення та склад контейнеру або закупорювального матеріалу та (за необхідності), оновлені: коротку характеристику лікарського засобу та інструкцію для медичного застосування.
2. Зразок нового пакування (за необхідності).
3. Дослідження з ревалідації проводилися для стерильних лікарських засобів, які пройшли кінцеву стерилізацію. Слід зазначити номери серій лікарського засобу, що використовувались в дослідженнях (за необхідності).
4. У разі зміни вільного простору над лікарським засобом або зміни співвідношення поверхня/об’єм має бути надане підтвердження того, що дослідження стабільності розпочаті відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) (із зазначенням номерів серій лікарського засобу) та (за необхідності), що на момент подання заяви про внесення змін типу ІА або ІБ у розпорядженні заявника було мінімум, який вимагається, даних щодо стабільності, а також наявні дані не вказували на будь-яку проблему, пов’язану зі стабільністю. Мають бути надані гарантії, що дослідження будуть завершені, і одразу по завершені досліджень дані будуть представлені в Центр у разі невідповідності специфікаціям або наявної ймовірності відхилень від специфікацій наприкінці терміну придатності (із запропонованими заходами).
|
Б.II.ґ.5. Зміна розміру упаковки готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) зміна кількості одиниць (наприклад, таблеток, ампул та ін.) в упаковці: |
|||
|
1. зміна у діапазоні затверджених розмірів упаковки |
1, 2 |
1, 3 |
IА |
|
2. зміна поза діапазоном затверджених розмірів упаковки |
1, 2, 3 |
IБ |
|
|
б) вилучення упаковки певного розміру |
3 |
1, 2 |
ІА |
|
в) зміна маси/об’єму вмісту контейнера багатодозового стерильного лікарського засобу (або однодозового часткового використання) та багатодозового лікарського засобу біологічного/імунологічного походження для парентерального застосування |
IІ |
||
|
г) зміна маси/об’єму вмісту контейнера багатодозового лікарського засобу для непарентеральних застосування (або однодозового часткового використання) |
1, 2, 3 |
ІБ |
Умови
1. Новий розмір упаковки повинен відповідати дозуванню і тривалості лікування відповідно до затвердженої короткої характеристики лікарського засобу.
2. Первинний пакувальний матеріал не змінився.
3. Незмінені форми випуску лікарського засобу повинні відповідати інструкції з дозування та тривалості лікування, як вказано в короткій характеристиці лікарського засобу.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи оновлені: коротку характеристику лікарського засобу (за необхідності).
2. Обґрунтування нового/незміненого розміру упаковки та підтвердження, що новий/незмінений розмір упаковки відповідає схемі дозування та тривалості лікування, затвердженими у короткій характеристиці лікарського засобу.
3. Заява, що дослідження стабільності будуть проводитись відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання), якщо показники стабільності будуть змінені. Дані мають бути представлені в Центр лише у разі невідповідності специфікаціям (з відповідною пропозицією).
Примітка до пункту Б.II.ґ.5. підпунктів в) та г). Будь-які зміни у силі дії лікарського засобу потребують подання заяви на реєстрацію.
|
Б.II.ґ.6. Зміна будь-якої частини матеріалу первинної упаковки, що не контактує з готовим лікарським засобом (наприклад, колір кришечок з контролем першого відкриття, колір кодових кілець на ампулах, контейнера для голок (різні види пластмаси) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) зміна, яка впливає на коротку характеристику лікарського засобу |
1 |
1 |
IА |
|
б) зміна, яка не впливає на коротку характеристику лікарського засобу |
1 |
1 |
IА |
Умови
Зміна не стосується тієї частини пакувального матеріалу, яка б могла вплинути на доставку, застосування, безпеку та стабільність готового лікарського засобу.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи оновлену коротку характеристику лікарського засобу (за необхідності).
|
Б.II.ґ.7. Зміна постачальника пакувальних матеріалів або комплектуючих (якщо зазначено в досьє) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) вилучення постачальника |
1 |
1 |
IА |
|
б) заміна або додавання постачальника |
1, 2, 3, 4 |
1, 2, 3 |
IА |
|
в) будь-яка зміна постачальника спейсерів для дозованих інгаляторів |
ІІ |
Умови
1. Жодних вилучень у компонентах упаковки або комплектуючих не відбулося.
2. Кількісний та якісний склад пакувального матеріалу/комплектуючих та проектні специфікації не змінилися.
3. Специфікації та методи контролю якості принаймні ідентичні.
4. Метод та умови стерилізації залишаються незмінними (за необхідності).
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Для комплектуючих для лікарських засобів — підтвердження CE-маркування (сертифікат СЕ) або висновок, виданий МОЗ, про безпеку комплектуючих.
3. Порівняльна таблиця затвердженої та запропонованої специфікацій, якщо необхідно.
Примітка. СЕ-маркування (CE-marking) скорочення від Conformit Europeane (Європейська відповідність) — особливий знак, який наноситься на виріб, і засвідчує, що даний виріб відповідає основним вимогам Європейських Директив, а також те, що він пройшов процедуру оцінки відповідності Директивам. Маркування «СЕ» вказує на те, що виріб є безпечним для здоров’я людини, а також для навколишнього середовища.
Б.II.д) Стабільність
|
Б.II.д.1. Зміна у термінах придатності або умовах зберігання готового лікарського засобу: |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) зменшення терміну придатності готового лікарського засобу: |
|||
|
1. для торгової упаковки |
1 |
1, 2, 3 |
IА |
|
2. після першого розкриття |
1 |
1, 2, 3 |
IА |
|
3. після розчинення або відновлення |
1 |
1, 2, 3 |
IА |
|
б) збільшення терміну придатності готового лікарського засобу: |
|||
|
1. для торгової упаковки (підтверджується даними реального часу) |
1, 2, 3 |
IБ |
|
|
2. після першого розкриття (підтверджується даними реального часу) |
1, 2, 3 |
IБ |
|
|
3. після розчинення або відновлення (підтверджується даними реального часу) |
1, 2, 3 |
IБ |
|
|
4. збільшення терміну придатності на основі екстраполяції результатів дослідження стабільності, проведених не у відповідності з вимогами Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (*) |
ІІ |
||
|
5. збільшення терміну придатності лікарського засобу біологічного/імунологічного походження на основі результатів досліджень стабільності, проведеними відповідно до затвердженого протоколу |
1, 2, 3 |
IБ |
|
|
в) зміна в умовах зберігання лікарського засобу біологічного походження, якщо дослідження стабільності були проведені не у відповідності до затвердженого протоколу |
ІІ |
||
|
г) зміна в умовах зберігання готового лікарського засобу або після розчинення/відновлення |
1, 2, 3 |
IБ |
Умови
Зміна не обумовлена непередбаченими обставинами у процесі виробництва або пересторогами щодо стабільності.
Документація
1. Зміни до відповідних розділів реєстраційного досьє повинні містити результати досліджень стабільності у реальному часі (що включають повний термін придатності), проведених відповідно до Настанови або Керівних принципів щодо дослідження стабільності лікарських засобів (чинне видання) принаймні на двох дослідно-промислових серіях1 готового лікарського засобу у затвердженій упаковці та/або після першого розкриття, або відновлення (за необхідності). За потреби мають бути включені результати мікробіологічних досліджень.
2. Оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці.
3. Копія затвердженої специфікації наприкінці терміну придатності готового лікарського засобу та, якщо необхідно, специфікації на лікарський засіб після розчинення/відновлення або першого розкриття.
1дослідно-промислова серія може бути прийнята із зобов’язанням підтвердити термін придатності на промисловій серії.
(*) Екстраполяція не застосовується до лікарських засобів біологічного/імунологічного походження.
Б.II.е) Проектний простір
|
Б.II.е.1. Введення нового проектного простору або розширення затвердженого для готового лікарського засобу (за виключенням лікарських засобів біологічного походження) щодо |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) одного або більше елементів виробничого процесу готового лікарського засобу, включаючи контроль в процесі виробництва та/або методи випробувань |
1, 2, 3 |
II |
|
|
б) метоів випробувань для допоміжних речовин/проміжних продуктів та/або готового лікарського засобу |
1, 2, 3 |
II |
Документація
1. Результати досліджень розробки лікарського засобу або виробничого процесу (включаючи дослідження оцінки ризику та багатомірні дослідження, якщо необхідно), які демонструють, що функціональна взаємодія властивостей матеріалу та параметрів процесу, які можуть впливати на критичні характеристики якості готового лікарського засобу, була досягнута.
2. Опис проектного простору у формі таблиці, включаючи змінні (властивості матеріалу та параметри процесу, якщо необхідно) та їх запропоновані діапазони.
3. Зміни до відповідних розділів реєстраційного досьє.
|
Б.II.е.2. Внесення змін після затвердження протоколу управління для готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
II |
Документація
1. Детальний опис запропонованої зміни.
2. Протокол управління змінами для готового лікарського засобу.
|
Б.II.е.3. Вилучення затвердженого протоколу управління змінами для готового лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
1 |
1 |
IА |
Умови
Вилучення не спричинено непередбаченими обставинами або результатами випробувань, що виходять за межі специфікацій під час внесення зміни, описаної у протоколі.
Документація
Обґрунтування запропонованого вилучення.
Б.ІІІ. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській Фармакопеї
|
Б.ІІІ.1. Подання нового або оновленого сертифіката відповідності Європейській Фармакопеї |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
Для субстанції Для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві субстанції Для допоміжної речовини |
|||
|
а) сертифікат відповідності Європейській Фармакопеї |
|||
|
1. новий сертифікат від вже затвердженого виробника |
1, 2, 3, 4, 5, 8 |
1, 2, 3, 4, 5 |
IА |
|
2. оновлений сертифікат від вже затвердженого виробника |
1, 2, 3, 4, 8 |
1, 2, 3, 4, 5 |
IА |
|
3. новий сертифікат від нового виробника (заміна або доповнення) |
1, 2, 3, 4, 5, 8 |
1, 2, 3, 4, 5 |
IА |
|
б) ГЕ Сертифіката відповідності Європейській Фармакопеї для субстанції/вихідного матеріалу/реагенту/проміжного продукту або допоміжної речовини |
|||
|
1. новий сертифікат для субстанції від нового або вже затвердженого виробника |
3, 6 |
1, 2, 3, 4, 5 |
IА |
|
2. новий сертифікат для вихідного матеріалу/реагенту/проміжного продукту або допоміжної речовини від нового або вже затвердженого виробника |
3, 6 |
1, 2, 3, 4, 5 |
IА |
|
3. оновлений сертифікат від вже затвердженого виробника |
1, 2, 3, 4, 5 |
IА |
Умови
1. Специфікації при випуску та наприкінці терміну придатності готового лікарського засобу залишаються незмінними.
2. Додаткові (до Європейської фармакопеї) специфікації щодо домішок (за виключенням залишкових розчинників, за умови, що вони відповідають Керівним принципам ІСН) та відповідні вимоги до лікарського засобу (наприклад, профілі розміру часток, поліморфна форма) залишаються незмінними, за виключенням звуження (за необхідності).
3. Виробничий процес субстанції,вихідного матеріалу/реагенту/проміжного продукту не включає використання матеріалу людського або тваринного походження, для якого проводиться оцінка даних щодо вірусної безпеки.
4. Тільки для субстанції необхідно проводити дослідження безпосередньо перед використанням, якщо період повторного випробування не включений до сертифікату відповідності Європейській Фармакопеї, або якщо дані щодо періодичності повторного випробування ще не представлені в досьє.
5. Субстанція/вихідний матеріал/реагент/проміжний продукт/допоміжна речовина нестерильні.
6. Для рослинних субстанцій: шлях виробництва, фізична форма, екстрагент та співвідношення лікарський засіб/екстрагент повинні залишатися незмінними.
Документація
1. Копія затвердженого (оновленого) сертифікату відповідності Європейській Фармакопеї.
2. У випадку додавання виробничої дільниці у заяві мають бути чітко визначені «затверджений» та «запропонований» виробники, як зазначено в розділі 2.5 форми заяви для державної реєстрації лікарського засобу.
3. Зміни до відповідних розділів реєстраційного досьє.
4. Якщо необхідно, документ в якому представлена інформація про будь-які матеріали, що підлягають оцінці вірусної безпеки відповідно до Керівництва з мінімізації ризику передачі збудників губчатої енцефалопатії тварин з лікарськими засобами, включаючи ті, що використовуються при виробництві субстанції/допоміжної речовини. Інформація повинна містити таке: назва виробника, види та тканини тварин, з яких було отримано матеріал, країна-постачальник тваринної сировини, її використання та попередній дозвіл.
5. Для субстанції — заява від уповноваженої особи (УО) кожного з власників ліцензії на виробництво, які перелічені у заяві на внесення змін, якщо субстанція використовується як вихідний матеріал, та заява УО кожного з власників ліцензії на виробництво, які перелічені у заяві як відповідальні за випуск серії. Ці заяви повинні підтверджувати, що виробник(-и) субстанції, зазначений(-і) у заяві, діє відповідно до Керівництва з належної виробничої практики щодо вихідних матеріалів. Узагальнена заява може бути прийнятною за певних умов (див. примітку до п. Б.II.б.1.). Виробництво проміжних продуктів також вимагає заяви УО, так як будь-які зміни до сертифікатів на субстанцію та проміжні продукти пов’язані, заява УО надається лише у тому випадку, якщо порівняно з діючим сертифікатом є зміна у затвердженому переліку виробничих дільниць.
|
Б.III.2. Зміни, пов’язані з необхідністю приведення у відповідність до монографії ДФУ або Європейської Фармакопеї |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) зміна у специфікації нефармакопейної субстанції для приведення у відповідність до вимог ДФУ або Європейської Фармакопеї |
|||
|
1. субстанція |
1, 2, 3, 4, 5 |
1, 2, 3, 4, 5 |
IА |
|
2. допоміжна речовина/вихідний матеріал для виробництва субстанції |
1, 2, 4 |
1, 2, 3, 4, 5 |
IА |
|
б) зміна у специфікаціях, пов’язана зі змінами в ДФУ або Європейській Фармакопеї |
1, 2, 4, 5 |
1, 2, 3, 4 |
IА |
|
в) зміна у специфікаціях, пов’язана із заміною вимог монографії ДФУ на вимогам монографії Європейської Фармакопеї |
1, 4, 5 |
1, 2, 3, 4 |
IА |
Умови
1. Зміна вноситься виключно для приведення у відповідність до вимог Фармакопеї.
2. Додаткові специфікації до Фармакопеї залишаються незмінними (наприклад, профіль розміру часток, поліморфна форма або, наприклад, біопроби, агреганти).
3. Жодних значних змін у якісних та кількісних показниках профілю домішок не відбулося, якщо специфікації не звужені.
4. Додаткова валідація нового або незміненого фармакопейного методу не потрібна.
5. Для рослинних субстанцій: метод виробництва, фізична форма, екстрагент та співвідношення лікарський засіб/екстрагент повинні залишатися незмінними.
Документація
1. Зміни до відповідних розділів реєстраційного досьє.
2. Порівняльна таблиця вимог затвердженої та оновленої специфікацій.
3. Дані аналізу двох промислових серій субстанції за всіма показниками оновленої специфікації.
4. Дані, які підтверджують придатність монографії для контролю субстанції, наприклад порівняння потенційних домішок із зазначеними у примітці до монографії.
5. Дані аналізів (у формі таблиць порівняння) двох промислових серій готового лікарського засобу, що містять субстанцію, яка відповідає затвердженій та оновленій специфікаціям, а також порівняльні дані профілю розчинення принаймні однієї дослідно-промислової серії готового лікарського засобу. Для рослинних лікарських засобів можуть бути прийнятні дані щодо розпадання.
Примітка. Немає необхідності вносити зміни, пов’язані зі змінами у ДФУ або Європейській фармакопеї, у випадку, якщо відповідність вимогам оновленої монографії виконується протягом шести місяців з моменту її публікації та зроблено посилання на поточне видання Фармакопеї у досьє на затверджений лікарський засіб.
Б.ІV. Медичні пристрої
|
Б.ІV.1. Зміна пристроїв для вимірювання дози або введення лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) додавання або заміна пристрою, який не є невід’ємною частиною первинної упаковки |
|||
|
1. пристрій, який має СЕ-маркування |
1, 2, 3 |
1, 2, 4 |
IА |
|
2. спейсер для дозованих інгаляторів |
ІІ |
||
|
б) вилучення пристрою |
4, 5 |
1, 5 |
IА |
|
в) додавання або заміна пристрою, який є невід’ємною частиною первинної упаковки |
IІ |
Умови
1. Запропонований пристрій для вимірювання дози повинен точно видавати необхідну дозу препарату згідно з затвердженим дозуванням. Необхідно надати результати відповідних досліджень.
2. Новий пристрій повинен бути сумісним з лікарським засобом.
3. Зміни не повинні призвести до суттєвих виправлень у коткій характеристиці лікарського засобу, інструкції для медичного застосування та маркуванні.
4. Лікарський засіб, як і раніше, демонструє відтворюваність дози.
Документація
1. Зміни до відповідних розділів реєстраційного досьє, включаючи опис, детальне зображення та склад матеріалу пристрою, та постачальника (за необхідності), оновлені: коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці (за необхідності).
2. Підтвердження СЕ-маркування (сертифікат СЕ) або відповідний висновок МОЗ про безпеку пристрою для застосування з лікарським засобом.
3. Дані, які підтверджують безпеку, точність дозування та сумісність матеріалу пристрою та лікарського засобу.
4. Зразки нового пристрою (за потреби).
5. Обґрунтування виключення пристрою.
Примітка до п. Б.IV.1.в. Будь-яка зміна, що призводить до нової лікарської форми, потребує подання заяви на реєстрацію.
Б.V. Зміни до реєстраційного посвідчення внаслідок інших регуляторних процедур
Б.V.а) ПМФ/ВАЗФ (мастер-файл на плазму/загальний файл на вакцинний антиген)
|
Б.V.а.1 Включення нового, оновленого або зміненого мастер-файла на плазму у реєстраційне досьє на лікарський засіб (процедура 2-го етапу для мастер-файла на плазму) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) первинне включення нового мастер-файла на плазму, що впливає на властивості готового лікарського засобу |
II |
||
|
б) первинне включення нового мастер-файла на плазму, що не впливає на властивості готового лікарського засобу |
1, 2, 3, 4 |
IБ |
|
|
в) включення оновленого/зміненого мастер-файла на плазму, якщо зміни впливають на властивості готового лікарського засобу |
1, 2, 3, 4 |
IБ |
|
|
г) включення оновленого/зміненого мастер-файла на плазму, якщо зміни не впливають на властивості готового лікарського засобу |
1 |
1, 2, 3, 4 |
IA |
Умови
Оновлений або змінений ПМФ отримав сертифікат відповідності.
Документація
1. Заява, що сертифікат відповідності на ПМФ та звіт про проведену оцінку цілком придатні для реєстрації лікарського засобу, власник ПМФ надав сертифікат відповідності, звіт про оцінку та мастер-файл на плазму заявнику (коли заявник не являється власником ПМФ), сертифікат відповідності та звіт про оцінку заміщають документацію на попередній ПМФ для даного реєстраційного посвідчення.
2. Сертифікат відповідності та звіт про оцінку.
3. Експертний висновок, що дає стислий опис усіх змін, які внесені до сертифікованого ПМФ, та оцінює їх потенціальний вплив на готовий лікарський засіб, включаючи оцінки специфічного ризику.
4. Форма заяви на внесення змін повинна чітко визначати «затверджений» та «запропонований» сертифікат відповідності на ПМФ (номер коду) у реєстраційному досьє на готовий лікарський засіб. Форма заяви на внесення зміни має чітко перелічувати також всі інші ПМФ, на які посилається заявник, навіть, якщо вони не є предметом заяви (за необхідності).
|
Б.V.а.2. Включення нового, оновленого або зміненого загального файлу на вакцинний антиген у реєстраційне досьє на готовий лікарський засіб (процедура 2-го етапу для ВАЗФ) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) первинне включення нового загального файлу на вакцинний антиген |
II |
||
|
б) включення оновленого або зміненого загального файлу на вакцинний антиген для виготовлення вакцини, якщо зміни впливають на властивості готового лікарського засобу |
1, 2, 3, 4 |
IБ |
|
|
в) включення оновленого або зміненого загального файлу на вакцинний антиген, якщо зміни не впливають на властивості готового лікарського засобу |
1 |
1, 2, 3, 4 |
IA |
Умови
Оновлений або змінений загальний файл на вакцинний антиген для отримав сертифікат відповідності.
Документація
1. Заява, що сертифікат відповідності та звіт про поведену оцінку ВАЗФ цілком придатні для реєстрації препарату, власник ВАЗФ надав сертифікат відповідності, звіт про оцінку та загальний файл на вакцинний антиген заявнику (коли заявник не є власником ВАЗФ), сертифікат та звіт про оцінку заміщають документацію попереднього ВАЗФ для даного реєстраційного посвідчення.
2. Сертифікат відповідності та звіт про оцінку.
3. Експертний висновок, що дає стислий опис усіх змін, внесених до сертифікованого ВАЗФ, та оцінює їх потенціальний вплив на готові лікарські засоби, включаючи оцінку специфічного ризику для препарату.
4. Форма заяви на внесення зміни має чітко визначити «затверджений» та «запропонований» сертифікат відповідності на ВАЗФ (номер коду) у реєстраційному досьє. Форма заяви на внесення зміни має чітко перелічувати також всі інші ВАЗФ, на які посилається заявник, навіть, якщо вони не є предметом заяви (за необхідності).
Б.V.б) Протокол управління змінами
|
Б.V.б.1. Перегляд досьє з якості для внесення змін на вимогу компетентного органу після оцінки протоколу управління змінами |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) внесення зміни не вимагає будь-яких додаткових супровідних даних |
1 |
1, 2, 4 |
IА |
|
б) внесення зміни вимагає додаткових супровідних даних |
1, 2, 3, 4 |
IB |
|
|
в) внесення зміни для лікарського засобу біологічного/імунологічного походження |
1, 2, 3, 4, 5 |
IB |
Умови
Запропонована зміна введена цілком відповідно до затвердженого протоколу управління змінами, який вимагає негайного повідомлення після затвердження.
Документація
1. Посилання на затверджений протокол управління змінами.
2. Заява про те, що зміна відповідає затвердженому протоколу управління змінами, результати дослідження відповідають критеріям прийнятності, зазначеним в протоколі. Додатково заява про те, що оцінка порівнянності не вимагається для лікарських засобів біологічного/імунологічного походження.
3. Результати досліджень, що проводилися згідно із затвердженим протоколом управління змінами.
4. Зміни до відповідних розділів реєстраційного досьє.
5. Копія затверджених специфікацій на субстанцію або готовий лікарський засіб.
В. ЗМІНИ ЩОДО БЕЗПЕКИ, ЕФЕКТИВНОСТІ, ФАРМАКОНАГЛЯДУ
В.I ЛІКАРСЬКІ ЗАСОБИ ДЛЯ ЛЮДИНИ
|
В.I.1 Зміна у короткій характеристиці лікарського засобу, інструкції для медичного застосування або маркуванні |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
а) потребує негайного внесення, але не пізніше 30 днів |
1, 2, 3 |
ІА |
|
|
б) потребує внесення відповідно до інформації референтного/оригінального лікарського засобу без надання жодних нових додаткових даних заявником |
1, 2, 3 |
ІБ |
|
|
в) потребує внесення відповідно до посилань та нові додаткові дані, надані заявником |
1, 3 |
ІІ |
Документація
1. До супровідного листа заяви на внесення зміни додати обґрунтування внесення змін, включаючи оновлені: коротку характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці.
2. Заява про те, що запропоновані коротка характеристика лікарського засобу, інструкція для медичного застосування та пропозиції до маркування на упаковці. Ідентичні такій інформації на референтний/оригінальний лікарських засіб.
3. Оновлена інформація про лікарський засіб.
|
В.I.2. Зміна у короткій характеристиці лікарського засобу, інструкції для медичного застосування, маркуванні генеричних/комбінованих/біоподібних лікарських засобів після оцінки тієї ж зміни щодо референтного/оригінального лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
а) впровадження змін(-и) щодо яких заявник не надає жодних нових додаткових даних |
1, 2 |
IБ |
|
|
б) впровадження змін(-и), яку необхідно в подальшому обґрунтувати новими додатковими даними, що має надати заявник (наприклад, порівнянність) |
II |
Документація
1. До супровідного листа заяви на внесення зміни додати рішення МОЗ (за необхідності).
2. Оновлена інформація про лікарський засіб.
|
В.I.3 Внесення змін(-и) на вимогу МОЗ, згідно рекомендацій національних компетентних органів, міжнародних організацій, регуляторних агенцій інших країн після оцінки негайного обмеження щодо безпеки, маркування, характерного для певної фармакологічної та/або фармакотерапевтичної групи, регулярно оновлюваного звіту з безпеки, плану управління ризиками, контрольних заходів/спеціальних зобов’язань, змін для відображення короткої характеристики лікарського засобу та інструкції для медичного застосування |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
a) впровадження узгоджених змін у формулюванні, щодо яких заявник не надає жодних нових додаткових даних |
1, 2 |
IБ |
|
|
б) впровадження змін, які вимагають подальшого обґрунтування новими додатковими даними, що надаються заявником |
ІІ |
Документація
1. До супровідного листа заяви на внесення зміни додати рішення МОЗ з доданням відповідного звіту з оцінки (за необхідності).
2. Оновлена інформація про лікарський засіб.
Примітка. Заявникам слід нагадати, що як тільки вони отримають нову інформацію, яка може внести зміну до реєстраційного посвідчення, її слід надати до компетентних органів у якості зміни, і не чекати оцінки цих даних за допомогою однією з процедур, що вказані вище.
|
В.I.4. Зміни, що пов’язані із значними змінами у короткій характеристиці лікарського засобу, інструкції для медичного застосування згідно нових даних з якості, доклінічних, клінічних даних та даних фармаконагляду |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
ІІ |
|||
|
В.I.5. Зміна у правовому статусі лікарського засобу |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
а) для генеричних/комбінованих/біоподібних лікарських засобів після зміни затвердженого правового статусу референтного/оригінального лікарського засобу |
1, 2 |
ІБ |
|
|
б) усі інші зміни правового статусу |
ІІ |
Документація
1. До супровідного листа заяви на внесення зміни додати: обґрунтування внесення змін з наданням документації, яка підтверджує зміну правового статусу лікарського засобу
2. Оновлена інформація про лікарський засіб.
|
В.I.6. Зміна(-и) до терапевтичних показань |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип змін |
|
а) додавання нового терапевтичного показання або зміни затвердженого показання |
ІІ |
||
|
б) вилучення терапевтичного показання |
ІБ |
Примітка. Якщо додавання або зміна терапевтичного показання має місце в контексті застосування результату процедури посилання або змін до інформації на генеричний/комбінований/біоподібий лікарський засіб після оцінки тієї ж зміни для референтного/оригінального лікарського засобу, зміни В.1.1 та В.1.2 застосовуються відповідно.
|
В.I.7. Вилучення |
Умови, які необхідно виконати |
Документи, які мають бути представлені |
Тип змін |
|
а) лікарська форма |
1, 2 |
ІБ |
|
|
б) сила дії |
1, 2 |
ІБ |
Документація
1. Заява, що незмінені форми випуску лікарського засобу відповідають інструкцій з дозування та тривалості лікування, як вказано в короткій характеристиці лікарського засобу.
2. Переглянута інформація про лікарський засіб
Примітка. У випадках, якщо на дану лікарську форму або силу дії отримано реєстраційне посвідчення, яке відрізняється від реєстраційного посвідчення на інші лікарські форми або сили дії, видалення попередньої не буде зміною, а буде відкликанням реєстраційного посвідчення.
|
В.I.8. Введення нової системи фармаконагляду |
Умови, які необхідно виконати |
Документи, які мають бути представлені |
Тип змін |
|
а) яка не пройшла оцінку відповідного національного компетентного органу/ЕМЕА для іншого продукту того ж заявника |
ІІ |
||
|
б) яка пройшла оцінку відповідного національного компетентного органу/інших регуляторних агенцій для іншого лікарського препарату того ж заявника(*) |
1 |
IБ |
Документація
Новий детальний опис системи фармаконагляду.
(*) Ця зміна стосується випадків, коли прийнятність вже оціненої системи фармаконагляду буде оцінюватися для нового реєстраційного посвідчення (наприклад, під час перенесення реєстраційного посвідчення).
|
В.I.9. Зміни до існуючої системи фармаконагляду, як зазначено у описі системи фармаконагляду |
Умови, які необхідно виконати |
Документи, які мають бути представлені |
Тип змін |
|
а) зміна уповноваженої особи, відповідальної за фармаконагляд |
1 |
1 |
IА |
|
б) зміна в контактних даних уповноваженої особи, відповідальної за фармаконагляд |
1 |
2 |
ІА |
|
в) зміна до процедури підтримки уповноваженої особи, відповідальної за фармаконагляд |
1 |
2 |
ІА |
|
г) зміна до бази даних з безпеки (наприклад, введення нової бази даних з безпеки, включаючи перенесення зібраних даних з безпеки та/або аналіз та повідомлення до нової системи) |
1, 2, 3 |
2 |
ІА |
|
ґ) зміни в контрактних домовленостях з іншими особами або організаціями, що залучені до виконання вимог з фармаконагляду та описаними в системі фармаконагляду а саме, якщо складається договір субпідряду про подання електронних повідомлень про індивідуальний випадок, пов’язаний з безпекою лікарського засобу, про ведення головних баз даних, про відстеження сигналу або про підготовку регулярно оновлюваного звіту з безпеки |
1 |
2 |
ІА |
|
д) виключення тем, що увійшли у письмову процедуру(и), яка описує діяльність з фармаконагляду |
1 |
2 |
ІА |
|
е) зміна дільниці, що проводить діяльність з фармаконагляду |
1 |
2 |
ІА |
|
є) інші зміни до системи фармаконагляду, які не впливають на функціонування системи фармаконагляду (наприклад, зміни розташування основного сховища/архіву, адміністративні зміни, оновлення скорочень, зміни щодо назви функцій/процедур). |
1 |
2 |
ІА |
Умови
1. Система фармаконагляду залишається незмінною.
2. Система бази даних була валідована.
3. Перенесення даних з інших систем баз даних було валідовано.
4. Такі ж зміни до системи фармаконагляду введені для всіх лікарських засобів того ж заявника (така ж кінцева версія опису системи фармаконагляду).
Документація
1. Остання версія опису системи фармаконагляду, включаючи а) резюме нової уповноваженої особи, відповідальної за фармаконагляд б) доказ реєстрації уповноваженої особи, відповідальної за фармаконагляд в базі ЕМЕА Eudravigilance, в разі наявності та в) нове положення про заявника та уповноваженої особи, відповідальної за фармаконагляд, відносно їх наявності та засоби повідомлення про побічні реакції, які підписані новою уповноваженою особою, відповідальною за фармаконагляд, та заявником, та відображення будь-які наступних змін, наприклад, до організаційної схеми.
2. Остання версія опису системи фармаконагляду та/або остання версія додатку стосовно лікарського засобу, якщо необхідно. Для б) якщо контактні дані уповноваженої особи, відповідальної за фармаконагляд, спочатку не включені до опису системи фармаконагляду, подання переглянутої версії опису системи фармаконагляду не вимагається/повинна подаватися лише форма заяви/повідомлення.
3. Посилання на заяву/процедуру та лікарський засіб, до яких було внесено зміни.
Примітка до п. В.І.9.є. Оцінка поданого опису системи фармаконагляду як частини нової заяви на отримання реєстраційного посвідчення/розширення/зміну може викликати зміни на вимогу національного компетентного органу у цьому описі системи фармаконагляду. Якщо це відбудеться, такі ж зміни можуть бути внесені до опису системи фармаконагляду в інших реєстраційних посвідченнях того ж заявника шляхом подання (згрупованої) зміни типу ІА.
Г. ПМФ/ВАЗФ (мастер-файл на плазму/загальний файл на вакцинний антиген)
|
Г.1. Зміна назви та/або адреси власника ВАЗФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1 |
IА |
Умови
Власником ВАЗФ повинна залишатися одна й та сама юридична особа.
Документація
1. Офіційний документ відповідного компетентного уповноваженого органу, в якому зазначено нову назву та/або нову адресу власника ВАЗФ.
|
Г.2. Зміна назви та/або адреси власника ПМФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1 |
IА |
Умови
Власником ПМФ повинна залишатися одна й та сама юридична особа.
Документація
1. Офіційний документ відповідного компетентного уповноваженого органу, в якому зазначено нову назву та/або нову адресу власника ПМФ.
|
Г.3. Зміна або передача власності на ПМФ від затвердженого власника новому власнику ПМФ (а саме іншій юридичній особі) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2, 3, 4, 5, 6 |
IА |
Документація
1. Документ, який містить персональні дані (назву та адресу) затвердженого власника ПМФ, а також персональні дані особи, якій повинна бути передана власність на ПМФ, разом з запропонованою датою підписання передачі права власності обома компаніями/сторонами.
2. Копія останньої сторінки сертифіката на ПМФ (ЕМЕА сертифікат відповідності).
3. Обґрунтування утворення нового власника (витяг з торгового (комерційного) реєстру, його переклад на англійську мову та українську мови), підписане обома компаніями/сторонами.
4. Підтвердження передачі повного комплекту документації на ПМФ з моменту його первинної оцінки правонаступнику, підписане обома компаніями/сторонами.
5. Доручення, у якому зазначені контактні дані особи, відповідальної за взаємозв’язок між компетентними органами та власником ПМФ, підписане правонаступником (новим власником).
6. Лист-підтвердження про виконання всіх зобов’язань, які залишились не виконаними від попереднього власника (якщо такі є), підписаний правонаступником (новим власником).
|
Г.4. Зміна назви та/або адреси установи крові, включаючи центр відбору крові/плазми |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
1, 2, 3 |
IА |
Умови
1. Така установа крові повинна залишатися тією ж самою юридичною особою.
2. Така зміна повинна бути адміністративною (наприклад об’єднання, передача повноважень); зміна назви установи крові/центру відбору крові, за умови, що установи залишатись тими ж самими.
Документація
1. Підписана заява про те, що така зміна не спричиняє зміну системи якості в межах установ крові.
2. Підписана заява про те, що перелік установ крові залишається незмінним.
3. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.5. Заміна або додавання нового центру відбору крові/плазми, внесених у ПМФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2, 3 |
IБ |
Документація
1. Епідеміологічні дані щодо вірусних маркерів, пов’язані з центрами відбору крові/плазми, за останні 3 роки. Для нових установ корові або у випадку, коли такі дані ще не доступні, надається заява про те, що епідеміологічні дані будуть представлені під час наступного щорічного їх оновлення.
2. Підтвердження, що центр крові на даний момент працює в тих самих умовах, що зазначені у стандартному контракті, укладеному між установою крові та власником ПМФ.
3. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.6. Вилучення або зміна статусу (робочий/ неробочий) установи/центру, яка займається відбором крові/плазми або аналізом зразків донорської крові та пулів плазми |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
1 |
IА |
Умови
1. Підстави для вилучення або зміни статусу установи не повинні бути пов’язані з питаннями GMP.
2. Такі установи/центри повинні дотримуватись вимог законодавства щодо перевірок у разі зміни статусу з неробочого на робочий.
Документація
1. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.7. Додавання нової установою забору крові, яка не внесена у ПМФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
IІ |
|||
|
Г.8. Заміна або додавання установи, яка здійснює аналіз зразків донорської крові та/або пулів плазми, у складі установи крові, внесеної у ПМФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
IБ |
Документація
1. Заява про те, що аналіз здійснюється за тією ж СОП та/або методами, які вже були затверджені.
2. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.9. Додавання нової установи, яка здійснює аналіз зразків донорської крові та/або пулів плазми, не внесеної у ПМФ. |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
IІ |
|||
|
Г.10. Заміна або додавання нової установи або центру крові, в якій здійснюється зберігання плазми |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1, 2 |
IБ |
Документація
1. Заява про те, що центр зберігання плазми здійснюється за тією ж СОП, яка вже була затверджена.
2. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.11. Вилучення установи або центру крові, в якій здійснюється зберігання плазми. |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1 |
IА |
Умови
Підстави для вилучення не повинні бути пов’язані з питаннями GMP.
Документація
1. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.12. Заміна або додавання організації, яка здійснює транспортування плазми |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
IБ |
Документація
1. Оновлені відповідні розділи ПМФ та додатки до нього, що містять перелік всіх установ крові, які користуються послугами цієї транспортної організації, резюме щодо системи на місцях для забезпечення належних умовам транспортування (час, температура, дотримання вимогGMP), а також підтвердження того, що умови транспортування будуть валідовані.
|
Г.13. Вилучення організації, яка здійснює транспортування плазми. |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1 |
IА |
Умови
Підстави для вилучення не повинні бути пов’язані з питаннями GMP.
Документація
1. Оновлені відповідні розділи ПМФ та додатки до нього.
|
Г.14. Додавання тестового набору, який має СЕ-маркування, для тестування окремих зразків донорської крові в якості нового тестового набору або заміни зазначеного у ПМФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1, 2 |
IА |
Умови
Новий тестовий набір має СЕ-маркування.
Документація
1. Перелік організацій, де проводиться тестування з використанням тестового набору.
2. Оновлені відповідні розділи ПМФ та додатки до нього, включаючи оновлену інформацію щодо тестування відповідно до Керівництва з вимог до ПМФ.
|
Г.15. Додавання тестового набору, який не має СЕ-маркування, для тестування окремих зразків донорської крові в якості нового тестового набору або заміни зазначеного у ПМФ |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) новий тестовий набір, який не був затверджений у ПМФ для тестування окремих зразків донорської крові у будь-якій установі крові |
ІІ |
||
|
б) новий тестовий набір, який був затверджений у ПМФ для тестування окремих зразків донорської крові у іншій установі крові |
1, 2 |
IА |
Документація
1. Перелік організацій, де проводиться тестування з використанням тестового набору, а також перелік організацій, де даний набір буде використовуватися.
2. Оновлені відповідні розділи ПМФ та додатки до нього, включаючи оновлену інформацію щодо тестування відповідно до Керівництва з вимог до ПМФ.
|
Г.16. Зміна набору/методу, які використовуються для тестування пулів плазми (антитіла або антигени, або NAT-тестування (технологія ампліфікації нуклеїнових кислот). |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
ІІ |
|||
|
Г.17. Введення або подовження терміну інвентаризаційної процедури для зразків донорської крові |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
1 |
IА |
Умови
Інвентаризаційна процедура проводиться за більш суворими вимогами (наприклад, видача дозволу тільки після повторного тестування донорів).
Документація
1. Оновлені відповідні розділи ПМФ, включаючи обґрунтування щодо введення або подовження терміну інвентаризаційної процедури, установи, де застосовується процедура, а також зміни у процедурі прийняття рішень, у тому числі нові умови.
|
Г.18. Вилучення або скорочення терміну інвентаризаційної процедури для зразків донорської крові |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
IБ |
Документація
1. Оновлені відповідні розділи ПМФ.
|
Г.19. Заміна або додавання контейнерів для крові (наприклад пляшки, пакети) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) нові контейнери для крові мають СЕ-маркування |
1, 2 |
1 |
IА |
|
б) нові контейнери для крові не мають СЕ-маркування |
ІІ |
Умови
1. Контейнер має СЕ-маркування.
2. Критерії щодо якості крові залишаються незмінними для контейнера.
Документація
1. Оновлені відповідні розділи ПМФ та додатки до нього, включаючи назву контейнера, виробника, специфікацію розчину антикоагулянта, підтвердження СЕ-маркування, а також назву установи крові, де використовується даний контейнер.
|
Г.20. Зміни у зберіганні/транспортуванні |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
а) умови зберігання та/або транспортування |
1 |
1 |
IА |
|
б) максимальний термін зберігання для плазми |
1, 2 |
1 |
ІА |
Умови
1. Зміни повинні посилити умови зберігання та відповідати положенням монографії Європейської Фармакопеї «Людська плазма для фракціонування».
2. Максимальний термін зберігання коротший за попередній.
Документація
1. Оновлені відповідні розділи ПМФ та додатки до нього, включаючи детальний опис нових умов зберігання, дані з валідації умов зберігання/транспортування та назву установи крові, де впроваджується зміна (за необхідності).
|
Г.21. Впровадження тестування на вірусні маркери за умови, що таке впровадження буде мати суттєвий вплив на оцінку вірусної безпеки |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
ІІ |
|||
|
Г.22. Зміни у приготуванні пулів плазми (наприклад, метод приготування, розмір пулу, зберігання зразків пулів плазми) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
1 |
IБ |
Документація
Оновлені відповідні розділи ПМФ.
|
Г.23. Зміни у заходах, які будуть вжиті, якщо ретроспективно буде встановлено, що зразки донорської крові необхідно виключити з процесу (ретроспективні дослідження) |
Умови, які мають бути виконані |
Документи, які мають бути представлені |
Тип зміни |
|
IІ |
Додаток 15
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Умови
яким повинні відповідати традиційні лікарські засоби рослинного походження та лікарські засоби, що виробляються згідно із затвердженими прописами, і особливості реєстраційних матеріалів на них
І. Умови
1. Традиційні лікарські засоби рослинного походження повинні відповідати таким умовам:
а) показання для їх застосування мають відповідати традиційним лікарським засобам рослинного походження, які завдяки своєму складу призначені для використання без контролю з боку лікаря;
б) вони повинні застосовуватися в певній концентрації та певному дозуванні;
в) мають бути лікарськими засобами для перорального, зовнішнього або інгаляційного застосування;
г) період традиційного застосування має становити понад 30 років у світі і понад 15 років в Україні;
ґ) є достатня кількість даних про традиційне використання лікарського засобу, зокрема його використання у звичайних умовах не завдає шкоди, фармакологічна ефективність лікарського засобу доведена тривалим використанням і досвідом.
Наявність у складі лікарського засобу рослинного походження вітамінів та мінералів, безпека яких представлена задокументованими доказами, не повинна бути перешкодою для реєстрації таких лікарських засобів, як традиційних лікарських засобів рослинного походження за умови, що дія вітамінів або мінералів є допоміжною або здатна підсилювати дію активних інгредієнтів рослинного походження щодо заявлених показань.
2. Лікарські засоби, що виробляються за прописами повинні відповідати таким умовам:
а) склад лікарського засобу, технологія виробництва, специфікація та інструкція для медичного застосування повинні відповідати таким, що наведені у затверджених прописах.
ІІ. Особливості реєстраційних матеріалів
1. Комплект реєстраційних документів на традиційні лікарські засоби, що подаються на державну реєстрацію, повинен містити докладні відомості, викладені у частинах І та ІІ додатка 7 до Порядку або модулях І, ІІ та ІІІ додатка 9 до Порядку.
Крім того, необхідно надати:
а) копію реєстраційного посвідчення або іншого документу (сертифікат на фармацевтичний продукт, сертифікат на вільний продаж тощо), виданого уповноваженим органом країни виробника/заявника, або країни зі строгою регуляторної системою. Зазначити перелік країн, де даний лікарський засіб зареєстрований/перереєстрований;
б) бібліографічні або експертні висновки відносно дії лікарського засобу, а також відомості щодо того, чи використовувався даний лікарський засіб протягом понад 30 років в країні заявника або понад 15 років в Україні. Надання документа про медичне використання протягом 30 років є достатнім навіть за відсутності реєстрації або навіть якщо кількість інгредієнтів лікарського засобу була знижена протягом цього періоду;
в) копію ліцензії на виробництво (якщо згідно з законодавством країни-виробника, ліцензія на виробництво існує лише у електронному вигляді (наприклад, США), має бути надана роздруківка із посиланням на відповідний офіційний сайт, засвідчена підписом/печаткою заявника) або іншого дозвільного документа на виробництво заявленої лікарської форми у країні виробника, а також засвідчену копію документа, що підтверджує відповідність умов виробництва лікарського засобу вимогам до виробництва лікарських засобів в Україні (належної виробничої практики) або гарантійного листа заявника щодо надання такого документа протягом терміну проведення спеціалізованої експертизи.
2. Комплект реєстраційних документів на лікарські засоби, що виробляються згідно із затвердженими прописами, які подаються на державну реєстрацію, повинен містити докладні відомості, викладені у частині І додатка 7 до Порядку або модулях І та ІІ додатка 9 до Порядку.
Крім того, необхідно надати
а) типові методи контролю та типову інструкцію для медичного застосування;
б) дані щодо діючої речовини, які включають назву та адресу виробника, інформацію щодо виробництва, стабільності, маркування, пакування, умов зберігання;
в) дані щодо готового лікарського засобу, які включають інформацію щодо об’єму серій, стабільності, маркування, пакування, умов та терміну зберігання;
г) копію реєстраційного посвідчення або іншого документу (сертифікат на фармацевтичний продукт, сертифікат на вільний продаж тощо), виданого уповноваженим органом країни виробника/заявника, або країни зі строгою регуляторної системою. Зазначити перелік країн, де даний лікарський засіб зареєстрований/перереєстрований;
ґ) копію ліцензії на виробництво (якщо згідно з законодавством країни-виробника, ліцензія на виробництво існує лише у електронному вигляді (наприклад, США), має бути надана роздруківка із посиланням на відповідний офіційний сайт, засвідчена підписом/печаткою заявника)або іншого дозвільного документа на виробництво заявленої лікарської форми у країні виробника, а також засвідчену копію документа, що підтверджує відповідність умов виробництва лікарського засобу, поданого на реєстрацію, вимогам до виробництва лікарських засобів в Україні, виданого центральним органом виконавчої влади з лікарських засобів;
д) лист-підтвердження щодо того, що склад, виробництво та контроль лікарського засобу відповідають пропису, наведеному у Переліку, затвердженому наказом МОЗ.
Додаток 16
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Умови,
яким повинні відповідати гомеопатичні лікарські засоби, реєстраційні матеріали для яких можуть не містити наукові клінічні дані, та обсяг даних, необхідних для демонстрації їхньої якості
1. Гомеопатичні лікарські засоби, реєстраційні матеріали для яких можуть не містити доказів їх терапевтичної ефективності, повинні відповідати таким умовам:
лікарські засоби призначені для перорального або зовнішнього застосування;
на етикетці лікарського засобу або в будь-якій інформації, що його стосується, не повинні наводитися конкретні показання для застосування;
ступінь розведення лікарського засобу є достатнім для того, аби гарантувати його безпеку; зокрема, лікарський засіб не може містити більше однієї частини на 10000 маткового розчину або 1/100 від мінімальної дози, яка використовується в алопатії щодо субстанцій, наявність яких в алопатичному лікарському засобі потребує обов’язкового пред’явлення рецепта лікаря.
2. Заява може охоплювати одну серію лікарського засобу, одержаного з однієї й тієї самої гомеопатичної сировини або видів сировини. Для того, аби продемонструвати, зокрема, фармацевтичну якість лікарських засобів та їх однорідність від серії до серії, реєстраційні матеріали повинні включати:
наведену у фармакопеї наукову назву гомеопатичної сировини або видів сировини та дані про різні шляхи введення, лікарські форми та ступені розведення, які підлягають реєстрації;
досьє з описом способу одержання та контролю гомеопатичної сировини або видів сировини та обґрунтування його/їх гомеопатичної природи на основі відповідної бібліографії;
опис виробництва та контролю для кожної лікарської форми та опис способу розведення і підсилення дії лікарського засобу;
копію ліцензії на виробництво (якщо згідно з законодавством країни-виробника, ліцензія на виробництво існує лише у електронному вигляді (наприклад, США), має бути надана роздруківка із посиланням на відповідний офіційний сайт, засвідчена підписом/печаткою заявника) або іншого дозвільного документа на виробництво заявленої лікарської форми у країні виробника, а також засвідчену копію документа, що підтверджує відповідність умов виробництва лікарського засобу вимогам до виробництва лікарських засобів в Україні (належної виробничої практики) або гарантійного листа заявника щодо надання такого документа протягом терміну проведення спеціалізованої експертизи;
копія реєстраційного посвідчення або іншого документу (сертифікат на фармацевтичний продукт, сертифікат на вільний продаж тощо), виданого уповноваженим органом країни виробника або заявника, або країни зі строгою регуляторної системою. Зазначити перелік країн, де даний лікарський засіб зареєстрований/перереєстрований;
пропозиції до маркування на упаковці;
інструкцію для медичного застосування у разі, якщо на зовнішній упаковці наведена неповна інформація, передбачена пунктом 2 додатка 21 до Порядку;
дані про стабільність лікарського засобу.
Додаток 17
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Вимоги
до короткої характеристики лікарського засобу
1. Коротка характеристика лікарського засобу (Summary of Product Characteristics — SPC) — інформація для спеціалістів щодо безпеки та ефективності застосування лікарського засобу, яка затверджується за бажанням заявника.
2. Текст короткої характеристики лікарського засобу повинен бути викладений чітко, українською або українською та іншою мовою міжнаціонального спілкування, яка визначена законодавством України.
3. Коротка характеристика лікарського засобу повинна містити таку інформацію:
3.1. Назва лікарського засобу, до складу якої у разі необхідності може входити дозування та лікарська форма.
3.2. Якісний і кількісний склад із зазначенням діючих та тих допоміжних речовин, інформація про які важлива для належного застосування лікарського засобу. Необхідно використовувати загальноприйняті або хімічні назви.
3.3. Лікарська форма.
3.4. Клінічна інформація:
3.4.1. Терапевтичні показання.
3.4.2. Нозологія і спосіб застосування для дорослих і, якщо необхідно, для дітей.
3.4.3. Протипоказання.
3.4.4. Особливі застереження та запобіжні заходи при застосуванні, а у випадку імунологічного лікарського засобу — обов’язкові запобіжні заходи, що повинні бути вжиті лікарями, які працюють з цими засобами та вводять їх пацієнтам, а також усі запобіжні заходи, яких повинен дотримуватися пацієнт.
3.4.5. Взаємодія з іншими лікарськими засобами та інші види взаємодій.
3.4.6. Застосування під час вагітності та годування груддю.
3.4.7. Вплив на здатність керувати транспортними засобами або працювати з іншими автоматизованими системами.
3.4.8. Побічні реакції.
3.4.9. Передозування (симптоми, невідкладні заходи лікування, антидоти).
3.5. Фармакологічні властивості:
3.5.1. Фармакотерапевтична група. Код АТХ.
3.5.2. Фармакодинамічні властивості.
3.5.3. Фармакокінетичні властивості.
3.5.4. Доклінічні дані з безпеки.
3.6. Фармацевтична інформація:
3.6.1. Перелік допоміжних речовин.
3.6.2. Основні випадки несумісності.
3.6.3. Термін придатності, у разі необхідності вказується термін придатності після розчинення лікарського засобу або після першого відкриття первинної упаковки.
3.6.4. Особливі запобіжні заходи при зберіганні.
3.6.5. Тип та вміст первинної упаковки.
3.6.6. Спеціальні заходи безпеки при поводженні з невикористаним лікарським засобом або відходами лікарського засобу (у разі необхідності).
3.7. Власник реєстраційного посвідчення.
3.8. Номер(-и) реєстраційного(-их) посвідчення(-нь).
3.9. Дата першої реєстрації або перереєстрації лікарського засобу.
3.10. Дата перегляду тексту короткої характеристики.
3.11. Для радіофармацевтичних лікарських засобів — повний докладний опис внутрішньої радіаційної дозиметрії.
3.12. Для радіофармацевтичних лікарських засобів — додаткові інструкції для приготування лікарських засобів для негайного застосування та контролю якості такого лікарського засобу, а у разі необхідності — максимальний термін зберігання, протягом якого будь-який проміжний лікарський засіб, наприклад елюат, або готовий до застосування лікарський засіб буде відповідати власним специфікаціям.
Додаток 18
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Структура
короткої характеристики лікарського засобу
(Назва лікарського засобу, дозування, лікарська форма).
Якісний і кількісний склад.
Лікарська форма.
Клінічна інформація.
Терапевтичні показання.
Дози та спосіб застосування.
Діти.
Протипоказання.
Особливі застереження та запобіжні заходи при застосуванні.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Застосування під час вагітності та годування груддю.
Вплив на здатність керувати транспортними засобами або працювати з іншими автоматизованими системами.
Побічні реакції.
Передозування.
Фармакологічні властивості.
Фармакотерапевтична група. Код АТХ.
Фармакодинамічні властивості.
Фармакокінетичні властивості.
Доклінічні дані з безпеки.
Фармацевтична інформація.
Допоміжні речовини.
Основні випадки несумісності.
Термін придатності.
Особливі запобіжні заходи при зберіганні.
Тип та вміст первинної упаковки.
Спеціальні заходи безпеки при поводженні з невикористаним лікарським засобом або відходами лікарського засобу (у разі необхідності).
Власник реєстраційного посвідчення.
Номер реєстраційного посвідчення.
Дата першої реєстрації лікарського засобу.
Дата останнього перегляду.
Додаток 19
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Вимоги
до інструкції для медичного застосування,
що супроводжує лікарський засіб
Інструкція для медичного застосування, що супроводжує лікарський засіб, повинна бути складена відповідно до короткої характеристики лікарського засобу або затверджена відповідно до нормативних вимог країни заявника/виробника або іншої країни зі строгою регуляторною системою та/або результатів клінічних випробувань.
1. Упаковку лікарського засобу повинна супроводжувати інструкція для медичного застосування, якщо викладена в ній інформація не наведена безпосередньо на вторинній або первинній упаковці.
2. Текст Інструкції для медичного застосування лікарського засобу повинен бути викладений чітко, українською або українською та іншою мовою міжнаціонального спілкування, яка визначена законодавством України. Це не виключає можливості надання відомостей кількома мовами, одна з яких — мова виробника, за умови, що в текстах різними мовами буде наведена ідентична інформація.
3. Стосовно певних лікарських засобів може бути відмінена вимога щодо необхідності вказувати в Інструкції для медичного застосування деякі дані українською або іншою мовою міжнаціонального спілкування в Україні за умови, якщо лікарський засіб не призначений для самостійного застосування пацієнтом.
4. Розмір шрифту повинен бути великим, наскільки це можливо для зручності, та читабельним. Мінімальні вимоги включають: шрифт розміром 8 пунктів Дідо з міжрядковим інтервалом не менше 1 мм.
5. Інструкція для медичного застосування повинна містити таку інформацію:
5.1. Назва лікарського засобу.
5.2. Якісний та кількісний склад із зазначенням активних субстанцій і тих допоміжних речовин, інформація про які важлива для правильного застосування лікарського засобу (використовуються загальноприйняті або хімічні назви).
Однак, якщо лікарський засіб призначений для парентерального введення або є лікарським засобом для місцевого застосування або для застосування в офтальмології, повинні бути вказані всі допоміжні речовини.
5.3. Лікарська форма.
Основні фізико-хімічні властивості
5.4. Фармакотерапевтична група. Код АТХ.
*5.5. Фармакологічні властивості та, якщо така інформація корисна для лікування, фармакокінетичні характеристики.
5.6. Клінічні характеристики:
5.6.1. Терапевтичні показання.
5.7. Протипоказання.
5.8. Особливі заходи безпеки (у разі необхідності), яких потрібно дотримуватися особам, які працюють з лікарськими засобами та вводять їх пацієнтам, а також усі заходи безпеки, яких необхідно дотримуватися пацієнту.
5.9. Взаємодія з іншими лікарськими засобами та інші види взаємодій.
5.10. Особливості застосування:
5.10.1. Застосування у період вагітності або годування груддю.
5.10.2. Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
5.11. Дози і спосіб введення для дорослих.
5.11.1. Діти.
5.12. Передозування (симптоми, невідкладні заходи лікування та антидоти).
5.13. Побічні реакції (частота та вираженість за умови наявності).
5.14. Термін придатності (у разі необхідності вказується термін зберігання після підготовки лікарського засобу для безпосереднього застосування, наприклад після розчинення або після першого відкриття первинної упаковки).
5.15. Несумісність (основні види) за наявності інформації.
5.16. Тип і місткість первинної упаковки.
5.17. Особливі заходи безпеки при поводженні з невикористаними лікарськими засобами та відходами лікарських засобів у разі необхідності.
5.18. Категорія відпуску лікарського засобу, встановлена Центром відповідно до критеріїв, затверджених МОЗ України.
5.19. Назва (найменування) та місцезнаходження виробника, а за бажанням заявника й назва (найменування) і місцезнаходження заявника.
5.20. Дата реєстрації/перереєстрації.
5.21. Дата останнього перегляду інструкції для медичного застосування (у разі внесення змін до інструкції для медичного застосування лікарського засобу).
5.22. Для радіофармацевтичних лікарських засобів — повний докладний опис внутрішньої радіаційної дозиметрії, а також додаткові докладні інструкції щодо приготування для негайного застосування та контролю якості таких лікарських засобів, а у разі необхідності — максимальний термін зберігання, протягом якого будь-який проміжний лікарський засіб, такий як елюат, або готовий для застосування фармацевтичний лікарський засіб буде відповідати власним специфікаціям.
Крім того, інструкція для медичного застосування радіофармацевтичного лікарського засобу повинна містити опис усіх заходів безпеки, яких необхідно дотримуватися медичним працівникам та пацієнтам під час приготування та застосування лікарського засобу, а також спеціальні заходи безпеки з утилізації упаковки та її невикористаного вмісту.
6. В інструкції для медичного застосування можуть бути розміщені символи або піктограми, які пояснюють інформацію, надану в ній, а також інша інформація, яка відповідає короткій характеристиці лікарського засобу і є корисною для санітарної просвіти, за винятком інформації рекламного характеру, яка сприяє просуванню лікарського засобу на ринку.
7. Інструкція для медичного застосування традиційного лікарського засобу рослинного походження повинна містити вказівки на те, що:
лікарський засіб є звичайним лікарським засобом рослинного походження для застосування відповідно до показань, підтверджених тривалим застосуванням;
користувач повинен проконсультуватися з лікарем, якщо симптоми захворювання не зникли під час застосування лікарського засобу або спостерігаються побічні реакції, не вказані в інструкції для медичного застосування лікарського засобу.
8. Інструкція для медичного застосування гомеопатичних лікарських засобів, які відповідають умовам, викладеним у додатку 16 до Порядку, повинна містити:
формулювання «гомеопатичний лікарський засіб без затверджених терапевтичних показань для застосування»;
застереження для споживача про необхідність консультації з лікарем, якщо симптоми зберігаються при застосуванні лікарського засобу.
9. Власник реєстраційного посвідчення повинен гарантувати, що у разі необхідності зможе надати організаціям пацієнтів з обмеженим зором текст інструкції для медичного застосування у доступному для них форматі.
*На безрецептурні лікарські засоби цей розділ повинен бути викладений зрозумілою мовою для пацієнта та за бажанням заявника інформація може бути скорочена.
Додаток 20
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Структура
інструкції для медичного застосування лікарського засобу
Назва лікарського засобу (укр.)
Склад:
Діюча(-і) речовина(-и): (МНН або в разі її відсутності скорочена хімічна назва)
склад на 1 одиницю лікарської форми
допоміжні речовини:
Лікарська форма.
Основні фізико-хімічні властивості:
Фармакотерапевтична група. Код АТХ.
*Фармакологічні властивості.
Фармакодинаміка.
Фармакокінетика.
Клінічні характеристики.
Показання.
Протипоказання.
Особливі заходи безпеки (при наявності).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Особливості застосування.
Застосування у період вагітності або годування груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Діти.
Передозування.
Побічні реакції.
Термін придатності.
Умови зберігання.
Несумісність (за наявності).
Упаковка.
Категорія відпуску.
Виробник/заявник.
Місцезнаходження виробника/місцезнаходження заявника.
Дата реєстрації/перереєстрації.
Дата останнього перегляду.
*На безрецептурні лікарські засоби цей розділ повинен бути викладений зрозумілою мовою для пацієнта та за бажанням заявника інформація може бути скорочена.
Додаток 21
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), або внесення змін до цих матеріалів
протягом дії реєстраційного посвідчення
Вимоги
до маркування на упаковці
1. Інформація, що наноситься на упаковку (етикетку).
1.1. На вторинній упаковці лікарського засобу, а за її відсутності — на первинній упаковці вказуються такі відомості:
а) штрих-код лікарського засобу;
б) назва лікарського засобу, яка супроводжується зазначенням міжнародної непатентованої або у разі її відсутності загальноприйнятої назви (коли лікарський засіб містить лише одну діючу речовину); якщо назва лікарського засобу може застосовуватися у декількох лікарських формах та/або мати різну силу дії, то необхідно вказати лікарську форму та/або силу дії із зазначенням того, чи призначений цей лікарський засіб для дітей віком до 1 року, старше 1 року або дорослих;
в) зазначення діючих речовин у якісному та кількісному вираженні, з указанням їхнього вмісту в одиниці дози або, залежно від способу застосування, в одиниці об’єму чи маси, з використанням їх міжнародних непатентованих або загальноприйнятих назв;
г) лікарська форма із зазначенням маси, об’єму або кількості одиниць дозування, що містяться в упаковці;
ґ) перелік допоміжних речовин (пункт 6.1 цього додатка), стосовно яких відомо, що вони спричиняють певну дію або ефект і їх назви вказуються разом з формулюванням: «для докладної інформації див. інструкцію для медичного застосування». Однак на упаковці повинні бути вказані всі допоміжні речовини, якщо лікарський засіб використовується парентерально, або в офтальмологічній практиці, або для місцевого застосування (нашкірні та трансдермальні лікарські засоби, лікарські засоби для інгаляцій, для ротової порожнини, назальні, ректальні та вагінальні лікарські засоби, тобто такі, що мають місцеву або трансдермальну дію);
д) спосіб, а за необхідності і шлях введення лікарського засобу;
е) особливі застереження відносно того, чи слід зберігати лікарський засіб у недоступному для дітей місці і, за необхідності — поза полем зору дітей;
є) дата закінчення терміну придатності (місяць/рік);
ж) за необхідності особливі вказівки відносно того, що робити з невикористаним лікарським засобом або відходами, які залишаються після використання такого лікарського засобу, а також, за бажанням заявника, посилання на будь-яку придатну систему збирання відходів на місці;
з) назва та місцезнаходження виробника і за необхідності назва представництва, призначеного цим заявником;
и) реєстраційний номер;
і) номер серії лікарського засобу, присвоєний виробником;
ї) якщо лікарський засіб призначений для самостійного лікування, інформація для його застосування;
й) за необхідності особливі застереження стосовно лікарського засобу;
к) за необхідності особливі умови зберігання.
У разі відсутності відповідної площі на упаковці для нанесення повної інформації обов’язково наносяться дані, перелічені в підпунктах «а», «б», «в», «г», «є», «з», «і», за умови наявності інструкції для медичного застосування.
1.2. На вторинній упаковці можуть бути також вміщені символи або піктограми, які дають змогу пояснити інформацію, вказану в пункті 1 цього додатка, а також інша інформація, яка відповідає короткій характеристиці лікарського засобу та є корисною для пацієнта, за винятком будь-яких елементів, які сприяють просуванню даного лікарського засобу на ринку.
1.3. Зазначена у пунктах 1.1 та 1.2 цього додатка інформація вказується на всіх первинних упаковках, за винятком випадків, описаних у пункті 1.4 цього додатка.
1.4. На первинній упаковці у формі блістера, стрипа тощо та на первинній упаковці невеликого розміру (ампулі, тюбику-крапельниці, шприці-тюбику тощо), що вкладається у вторинну упаковку, яка відповідає вимогам, викладеним у пунктах 1.1 та 1.2 цього додатка, вказується, як мінімум, така інформація:
- назва лікарського засобу (українською та/або російською, та/або англійською мовою, та/або латиною);
- маса, об’єм, концентрація або кількість одиниць дії лікарського засобу;
- номер серії лікарського засобу;
- дата закінчення терміну придатності;
- назва виробника та/або заявника.
У разі відсутності відповідної площі на первинній упаковці для нанесення зазначеної інформації обов’язково вказуються дані, перелічені в перших трьох пунктах.
2. Вторинна упаковка та первинна упаковка лікарських засобів, що містять радіонукліди, повинні бути марковані відповідно до Правил безпечного транспортування радіоактивних матеріалів, установлених Міжнародною агенцією з атомної енергії, та відповідати таким вимогам:
2.1. Етикетка на захисному контейнері повинна містити докладні відомості, вказані в пункті 1.1 цього додатка. Додатково маркування на захисному контейнері повинно повністю пояснювати кодування на флаконі та за необхідності містити зазначення кількості одиниць радіоактивності лікарського засобу у дозі або цілому флаконі з указанням дати, а у разі необхідності часу, а також кількості капсул або для рідини — об’єм у мілілітрах вмісту флакона.
2.2. Маркування флакона повинно містити таку інформацію:
- назву або код лікарського засобу, включаючи назву або хімічний символ радіонукліда;
- номер серії та дату закінчення терміну придатності;
- міжнародний символ радіоактивності;
- назву виробника;
- кількість одиниць радіоактивності, як указано в пункті 2.1 цього додатка.
3. Для гомеопатичних лікарських засобів, які відповідають умовам, викладеним у додатку 16 до Порядку, на етикетці повинна бути наведена така інформація (і жодної іншої):
- штрих-код лікарського засобу;
- наукова назва сировини або видів сировини з наступним зазначенням ступеня розведення із застосуванням символів Державної фармакопеї України (далі — ДФУ) або іншої визнаної в Україні фармакопеї;
- назва та місцезнаходження виробника та/або заявника і за необхідності назва представництва, призначеного цим заявником;
- спосіб застосування та, за необхідності, шлях введення;
- дата закінчення терміну придатності (місяць/рік);
- лікарська форма;
- вміст упаковки для продажу;
- за необхідності особливі умови зберігання;
- за необхідності особливі застереження щодо лікарського засобу;
- номер серії лікарського засобу, присвоєний виробником;
- реєстраційний номер;
- формулювання «гомеопатичний лікарський засіб без затверджених терапевтичних показань для застосування»;
- застереження для споживача про необхідність консультації з лікарем, якщо симптоми захворювання не зникли під час застосування лікарського засобу.
4. Для традиційних лікарських засобів рослинного походження етикетка повинна містити докладні відомості, вказані в пунктах 1.1 та 1.2 цього додатка. Додатково повинні бути наведені вказівки про те, що:
- лікарський засіб є традиційним лікарським засобом рослинного походження для використання відповідно до показань, підтверджених тривалим застосуванням;
- користувач повинен проконсультуватися з лікарем, якщо симптоми захворювання не зникли під час застосування лікарського засобу або спостерігаються побічні реакції, не вказані в інструкції для медичного застосування.
5. На упаковці лікарських засобів, що містять один чи декілька наркотичних засобів та/або психотропних речовин, повинні міститись докладні відомості, вказані в пунктах 1.1 та 1.2 цього додатка. Додатково первинна упаковка повинна бути позначена подвійною червоною смугою.
6. Основні вимоги до нанесення текстів.
Дані на упаковці мають бути нанесені шрифтом не менше 7 пунктів Дідо.
Допускається викладення інформації декількома мовами, одна з яких визначена законодавством України як мова міжнаціонального спілкування, за умови ідентичності інформації.
На первинних упаковках невеликого розміру (пункт 1.4 цього додатка) дані мають бути наведені українською та/або російською, та/або англійською мовою, та/або латиною.
Допускається за необхідності нанесення на упаковку інформації за допомогою стикера, текст якого затверджено Центром.
Стикери затверджуються для оригінальних (інноваційних) лікарських засобів (терміном на один рік з дати їх державної реєстрації), препаратів обмеженого застосування (препаратів-сиріт) або, за необхідності, в інших випадках, які не суперечать законодавству про лікарські засоби.
На вторинній упаковці лікарських засобів також шрифтом Брайля зазначаються назва лікарського засобу, доза діючої речовини та лікарська форма у порядку, визначеному МОЗ.
7. Вимоги щодо допоміжних речовин, які мають бути нанесені на упаковку.
7.1. Перелік допоміжних речовин, які мають бути обов’язково вказані на упаковці:
- Апротинін
- Олія арахісова
- Аспартам (E 951)
- Азобарвники:
- тартразин (E 102)
- жовтий захід FCF (E 110)
- азорубін, кармоїзин (E 122)
- амарант (E 123)
- понсо 4R (пунцовий 4R), кошеніль червона А (E 124)
- діамантовий чорний BN, чорний PN (E 151)
- Перуанський бальзам
- Бензалконію хлорид
- Кислота бензойна та бензоати:
- кислота бензойна (E 210)
- натрію бензоат (E 211)
- калію бензоат (E 212)
- Спирт бензиловий
- Олія бергамота
- Бронопол
- Бергаптен
- Бутилгідроксіанізол (E 320)
- Бутилгідрокситолуол (E 321)
- Олія рицинова поліетоксильована
- Олія рицинова поліетоксильована, гідрогенізована
- Спирт цетостеариловий
- Спирт цетиловий
- Хлоркрезол
- Диметилсульфоксид
- Етанол
- Формальдегід
- Фруктоза
- Галактоза
- Глюкоза
- Гліцерин
- Гепарин
- Цукор інвертний
- Лактит (E 966)
- Лактоза
- Ланолін
- Латекс
- Мальтит (E 965)
- Ізомальтитол (E 953)
- Мальтит рідкий
- Маніт (E 421)
- Органічні сполуки ртуті:
- тіомерсал
- фенілртуті нітрат
- фенілртуті ацетат
- фенілртуті борат
- Парагідроксибензоати та їх ефіри:
- етилпарагідроксибензоат (E 214)
- пропілпарагідроксибензоат (E 216)
- натрію пропілпарагідроксибензоат (E 217)
- метилпарагідроксибензоат (E 218)
- натрію метилпарагідроксибензоат (E 219)
- Фенілаланін
- Калій
- Пропіленгліколь та ефіри
- Олія кунжутна
- Натрій
- Кислота сорбінова та її солі
- Сорбіт (E 420)
- Олія соєва, олія соєва гідрогенізована
- Спирт стеариловий
- Цукроза (сахароза)
- Сульфіти, включаючи метабісульфіти:
- сірки діоксид (E 220)
- натрію сульфіт (E 221)
- натрію гідросульфіт (E 222)
- натрію метабісульфіт (E 223)
- калію метабісульфіт (E 224)
- калію гідросульфіт (E 228)
- Крохмаль пшеничний
- Ксиліт.
7.2. Назви допоміжних речовин на упаковці повинні вказуватись у такий спосіб:
- допоміжні речовини мають бути представлені за їхніми міжнародними непатентованими назвами (далі — МНН) відповідно до Європейської Фармакопеї, або за відсутності таких — загальноприйнятими назвами.
- назву допоміжної речовини має супроводжувати номер «Е», якщо такий є. На упаковці може бути зазначений тільки номер «Е» за умови, що повна назва (МНН, а за її відсутності — загальноприйнята назва) та номер «Е» буде наведено в інструкції для медичного застосування у розділі, де зазначено повний якісний склад.
- патентовані коригенти або ароматизатори мають бути надані у загальноприйнятих термінах (наприклад, «апельсиновий смак», «лимонний аромат»); мають бути зазначені будь-які відомі основні компоненти або такі, що мають певну визнану дію або реакцію.
- хімічно модифіковані допоміжні речовини мають бути вказані у такий спосіб, аби уникнути плутанини з немодифікованими допоміжними речовинами (наприклад, крохмаль прежелатинізований).
- усі компоненти складних допоміжних речовин або сумішей мають бути заявлені, перелічені в описі загального складу із зазначенням основних складових речовин (наприклад, фарба для друку, що містить x, y, z). Загальна назва складної допоміжної речовини або суміші може бути використана на упаковці у випадку, якщо більш повна інформація надається в інструкції для медичного застосування. Будь-який компонент, здатний спричинити певну дію або реакцію, має бути вказаний на упаковці.
Ці вимоги не стосуються маркування на упаковках діючих речовин і встановлюються в матеріалах реєстраційного досьє.
Примітка. Після затвердження тексту маркування, що наноситься на упаковку, заявник має надати до центрального органу виконавчої влади з лікарських засобів зразки вторинної та/або первинної упаковки/етикетки.
Додаток 22
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), а також експертизи матеріалів
про внесення змін до реєстраційних матеріалів
протягом дії реєстраційного посвідчення
Проведення досліджень
еквівалентності (взаємозамінності) генеричних лікарських засобів
1. Загальні положення
1.1. Мета встановлення біоеквівалентності полягає в доведені еквівалентності біофармацевтичної якості між генеричним та референтним лікарськими засобами.
1.2. Для доведення взаємозамінності застосовуються такі методи:
- порівняльні фармакокінетичні дослідження за участю людини, у яких діюча речовина та/або її метаболіти вимірюються як функція часу у доступній біологічній рідині, а саме: крові, плазмі, сироватці або сечі для отримання фармакокінетичних показників типу АUC і Смакс, що відображають системну дію;
- порівняльні фармакодинамічні дослідження за участю людини;
- порівняльні клінічні дослідження;
- дослідження еквівалентності in vitro (процедура біовейвер).
1.3. Прийнятність кожного з зазначених методів для доведення взаємозамінності визначається на підставі комплексної експертизи факторів, які включають характеристики діючої речовини, форми лікарського засобу та часу дії активної(-их) речовини(-н) на перебіг хвороби.
1.4. При виборі методів доведення еквівалентності застосовують такі підходи:
- якщо можливо отримати вимірювані концентрації діючої речовини в наявній біологічній рідині, такій як плазма, проводяться порівняльні фармакокінетичні дослідження in vivo за участю людини, за можливості та бажанням заявника; для лікарських засобів для орального застосування з негайним вивільненням може застосовуватися дослідження еквівалентності in vitro за процедурою біовейвер відповідно до БСК;
- якщо неможливо отримати вимірювані концентрації діючої речовини у відповідній біологічній рідині, проводяться порівняльні фармакодинамічні дослідження за участю людини;
- якщо неможливо визначити фармакокінетичний профіль, знайти прийнятні фармакодинамічні кінцеві точки, за бажанням заявника, можуть застосовуватися порівняльні клінічні дослідження.
2. Відсутність необхідності проведення дослідження еквівалентності in vivo
2.1. Генеричні лікарські засоби, наведені у цьому розділі, які є фармацевтично еквівалентними до референтного, і містять, в основному, такі ж допоміжні речовини в порівнюваних концентраціях, вважаються терапевтично еквівалентними (взаємозамінними) при виконанні зазначених умов і не потребують подальшого підтвердження еквівалентності шляхом проведення порівняльних досліджень за умов дотримання вимог до виробництва та стандартів якості, встановлених чинним законодавством України та міжнародними нормами. У разі відмінності складу допоміжних речовин генеричного лікарського засобу (зокрема, буферні розчини, консерванти, антиоксиданти, тощо) відносно референтного, повинно бути доведено у будь-який спосіб, що допоміжні речовини у пропонованих концентраціях не впливають на безпечність та/або ефективність лікарського засобу:
а) лікарські засоби, які застосовуються парентерально (наприклад, внутрішньовенно, підшкірно або внутрішньом’язово) у вигляді водних розчинів, котрі містять таку саму діючу речовину і в тій самій молярній концентрації, що і референтний препарат, і з такими ж самими або подібними допоміжними речовинами у порівнюваних з референтним препаратом концентраціях.
б) лікарські засоби, які є розчинами для орального застосування (наприклад, сиропи, еліксири і настойки), які містять діючу речовину в тій же молярній концентрації, що й референтний препарат, і містять, в основному, такі ж допоміжні речовини в порівнюваних концентраціях.
в) лікарські засоби, які знаходяться у формі порошків для приготування розчинів, якщо розчин відповідає вимогам а) або б);
г) лікарські засоби, які є газами;
ґ) лікарські засоби, які є вушними або очними лікарськими засобами, виготовленими у вигляді водних розчинів, які містять таку ж саму діючу речовину(-и) в такій самій молярній концентрації(-ях) і, по суті, такі ж допоміжні речовини у порівнюваних концентраціях, що й референтний препарат;
д) лікарські засоби, які є препаратами місцевої дії, виготовленими у вигляді водних розчинів, котрі містять таку ж діючу речовину(-и) в такій самій молярній концентрації(-ях) і, по суті, такі ж самі допоміжні речовини у порівнюваних концентраціях, що і референтний препарат;
е) лікарські засоби, які є водними розчинами у формі інгаляційно-розпилююваних небулайзером препаратів або, назальні спреї, які застосовуються за допомогою практично однакових пристроїв, і котрі містять таку ж саму діючу речовину(-и) в такій самій молярній концентрації(-ях) і, по суті, такі ж допоміжні речовини у порівнюваних концентраціях, що і референтний препарат.
є) лікарські засоби, які є водними розчинами системної дії для ректального або вагінального застосування, котрі містять діючу речовину в тій же молярній концентрації, що і референтний препарат, і містять, в основному, такі ж допоміжні речовини в порівнюваних концентраціях.
2.2. Для випадків б), в), г), ґ) д), е) та є) у разі відмінностей у складі діючих речовин заявник повинен довести, що при їх використанні не передбачається вплив на безпеку та/або ефективність лікарського засобу. У випадку, коли заявник не може надати таку інформацію і не має доступу до відповідних даних, він повинен провести відповідні дослідження для доказу відсутності впливу різних допоміжних речовин або допоміжних пристроїв на безпеку та/або ефективність лікарського засобу.
При проведенні досліджень та підготовці реєстраційного досьє заявник має враховувати концентрації та властивості тих допоміжних речовин, про які відомо, що вони впливають на проходження лікарського засобу шлунково-кишковим трактом (ШКТ), проникність у ШКТ і таким чином, абсорбцію або стабільність діючої речовини у ШКТ, та надати відповідні дані.
3. Необхідність проведення дослідження еквівалентності
Доведення еквівалентності in vivo потрібне у випадку, коли існує ризик того, що можливі відмінності у біодоступності можуть призвести до терапевтичної нееквівалентності лікарського засобу, наприклад, для:
а) лікарських засобів системної дії для орального застосування з негайним вивільненням, якщо до них застосовані один або декілька таких критеріїв:
- застосування лікарського засобу для невідкладної допомоги;
- вузький спектр терапевтичної дії (межі ефективність/безпека), крутий нахил кривої доза-відклик;
- документально підтверджені проблеми щодо біодоступності або біонееквівалентності, які пов’язані з діючою речовиною або її формами (що не мають відношення до розчинення);
- дані стосовно того, що на біоеквівалентність може впливати поліморфізм діючої речовини, допоміжні речовини та/або технологічні процеси.
б) лікарських засобів системної дії, що не призначені для орального або парентерального застосування (таких, як трансдермальні пластирі, супозиторії, нікотинові жувальні гумки, гелі тестостерону та трансдермальні контрацептиви).
в) лікарських засобів системної дії з модифікованим вивільненням.
г) препаратів системної дії із фіксованою комбінацією діючих речовин, у яких, як мінімум, для однієї діючої речовини потрібне проведення дослідження in vivo.
ґ) препаратів несистемної дії, зокрема, для орального, назального, офтальмологічного, дерматологічного, ректального або вагінального застосування, без системної абсорбції, що не є розчинами. У такому разі еквівалентність доводять шляхом проведення, наприклад, порівняльних клінічних або фармакодинамічних, дерматофармакокінетичних досліджень та/або досліджень in vitro.
д) генеричний лікарський засіб на відміну від референтного містить інший ефір, складний ефір, ізомер, рацемат, комплекси або продукти дериватизації діючої речовини, оскільки ці відмінності можуть спричинити різну біодоступність.
4. Умови проведення процедури біовейвер
4.1. Вступ
Використання процедури біовейвер обмежене швидко розчинними діючими речовинами, з відомою абсорбцією у людини, які не мають вузького терапевтичного індексу та критичного застосування.
Концепція застосовується до твердих лікарських засобів системної дії з негайним вивільненням для орального шляху введення, що мають одну і ту ж лікарську форму. Процедура біовейвер не застосовується для сублінгвальних, букальних лікарських засобів і препаратів з модифікованим вивільненням. Для лікарських засобів, диспергованих в ротовій порожнині, підхід біовейвера на підставі БСК може застосовуватися лише тоді, коли абсорбція в ротовій порожнині може бути виключена (див. п. 6.1).
4.2. Загальні вимоги
Біовейвер на підставі БСК застосовується для лікарського засобу з негайним вивільненням, якщо:
- було доведено, що діюча речовина, проявляє високу розчинність і повну абсорбцію/високий ступінь проникнення (I клас за БСК)
- лікарський засіб належить до дуже швидко розчинних (>85% в межах 15 хвилин) або швидко розчинних (85% в межах 30 хвилин)
- допоміжні речовини, які можуть вплинути на біодоступність, є якісно і кількісно подібними. В основному використання подібних допоміжних речовин в схожих кількостях є переважним.
Біовейвер на підставі БСК також застосовується для лікарського засобу з негайним вивільненням, якщо:
- було доведено, що діюча речовина, проявляє високу розчинність і обмежену абсорбцію/низький ступінь проникнення (III клас за БСК)
- лікарський засіб належіть до дуже швидко розчинних (>85% в межах 15 хвилин)
- допоміжні речовини, які можуть вплинути на біодоступність є якісно і кількісно подібними і інші допоміжні речовини є якісно подібними і кількісно дуже схожими.
Біовейвер на підставі БСК також застосовується для лікарського засобу з негайним вивільненням, якщо:
- було доведено, що діюча речовина, проявляє високу розчинність при рН 6,8 та повну абсорбцію/високий ступінь проникнення (II клас за БСК)
- високу (>85% в межах 30 хвилин) характеристики розчинення in vitro генеричного і референтного препаратів були продемонстровані при рН 6,8.
- профілі розчинення генеричного і референтного препаратів при рН 1,2 та 4,5 показали подібність
- допоміжні речовини, які можуть вплинути на біодоступність є якісно і кількісно подібними і інші допоміжні речовини є якісно подібними і кількісно дуже схожими.
В основному ризики невідповідного рішення щодо можливості проведення процедури біовейвер мають бути критичніше розглянуті для лікарських засобів, діюча речовина яких відноситься до ІІ та ІІІ класу за БСК (наприклад, абсорбція специфічна для певної ділянки, ризик взаємодії транспортних білків в ділянці абсорбції, склад допоміжних речовин і терапевтичні ризики).
4.3. Діюча речовина
Процедура біовейвер застосовується, якщо діюча речовина у досліджуваному та референтному лікарських засобах є ідентичною. У випадку використання діючої речовини у вигляді різних солей процедура біовейвер можлива, якщо до діюча речовина відноситься до І класу за БСК.
Біовейвер не застосовується, якщо досліджуваний і референтний лікарські засоби містять різни солі, ефіри, складні ефіри, ізомери, рацемати, комплекси або продукти дериватизації діючої речовини, оскільки означені невідповідності можуть призвести до різної біодоступності, яка не може бути встановлена з використанням досліджень основі БСК та результатів порівняльних досліджень in vitro з використанням тесту «Розчинення».
4.4. Розчинність
Необхідно визначити та розглянути профіль рН-залежної розчинності діючої речовини. Діюча речовина вважається високорозчинною, якщо найвища одноразова доза повністю розчиняється в 250 мл або в меншому об’ємі кожного з трьох буферних розчинів із значенням рН в межах 1-6,8. Встановлення рівноважної розчинності необхідно проводити у трьох буферних розчинах при рекомендованих значеннях рН 1,2; 4,5 та 6,8, температурі (37±1)ºС, та додатково враховуючи рКa, якщо її величина знаходиться у вищезазначеному діапазоні рН, де рКa — константа іонізації діючої речовини. Повторні дослідження при кожному значенні рН можуть бути необхідними для досягнення чіткої класифікації розчинності діючої речовини (наприклад, методом струшування колби або іншим обґрунтованим методом). Рекомендується вивчення розчинності діючої речовини проводити в трьох повторах при кожному із вибраних значень рН для кожного заявленого виробника діючої речовини. Значення рН кожного буферного розчину необхідно перевіряти перед та після експерименту.
4.5. Абсорбція
Демонстрація повної абсорбції у людини є переважною для проведення процедури біовейвер. З цією метою вважається, що повна абсорбція має бути встановлена, якщо вимірюваний рівень абсорбції складає більше 85%. Повна абсорбція в основному пов’язана з високою проникністю. Повна абсорбція препарату має бути обґрунтовано на підставі надійних досліджень у людини.
Для вивчення ступеню абсорбції можуть використовуватися дані досліджень абсолютної біодоступності або визначення масобалансу.
Якщо дані з встановлення масобалансу використовуються для підтвердження повної абсорбції, повинно гарантуватися, що метаболіти, які враховуються при визначенні абсорбованої фракції, формуються після абсорбції.
Дослідження проникності in vitro (in vivo або in situ кишкова перфузія з використанням моделей тварин; in vitro проникнення крізь ізольовані тканини тварин або моношар культури епітеліальних клітин), можуть також вважатися підтверджуючими для даних in vivo.
4.6. Готовий лікарський засіб
Вивчення кінетики вивільнення діючої речовини генеричного та референтного лікарських засобів проводять у порівнянні з референтним препаратом за таких умов:
прилади — прилад із кошиком (100 об/хв), або прилад із лопаттю (75/50 об/хв);
Примітка. Прилад з лопаттю (75 об/хв) рекомендується використовувати при проведені процедури «Біовейвер» тільки для лікарських засобів зазначених в керівництві ВООЗ WHO Technical Report Series 937 «Regulatory guidance on interchangeability for multisource (generic) pharmaceutical products», Annex 8.
— об’єм середовища розчинення — 900 мл або менше, але не менше 500 мл;
— температура середовища розчинення — (37±0,5) °С;
— кількість досліджуваних зразків — 12 для досліджуваного лікарського засобу і 12 для референтного препарату;
— точки контролю — не менше 3 точок (не враховуючи нульову), а саме: через 10 хв, 15хв, 20 хв, 30 хв та 45 хв, причому точка «15 хв» є визначальною;
— відносне стандартне відхилення середнього результату або коефіцієнт варіації будь-якого лікарського засобу повинен бути менше 20% для першої точки і менше 10% від другої до останньої точки контролю.
— середовища розчинення (буферні розчини): рН 1,0-1,2 (зазвичай 0,1N HCl або штучний шлунковий сік без ферментів), рН 4,5 і рН 6,8 (або штучна кишкова рідина без ферментів); (рН повинен гарантуватися впродовж всього дослідження; рекомендуються буферні розчини, описані у ДФУ або Європейській фармакопеї); інші умови: відсутність поверхнево-активних речовин; у випадку желатинових капсул або таблеток з желатиновим покриттям може допускатися використання ферментів.
Необхідно надати результати порівняльних досліджень in vitro, що включають протокол випробовування та умови їх проведення, індивідуальні і середні результати та відповідну підсумкову статистику.
4.7. Оцінка результатів розчинення in vitro
Лікарські засоби вважаються дуже швидкорозчинними, якщо не менше 85% від зазначеної у маркуванні кількості діючої речовини переходить у розчин за 15 хвилин або менше. У тому випадку, якщо це доведено для генеричного і референтного лікарських засобів, їх подібність може бути прийнята без будь-якого математичного обчислення.
Лікарські засоби вважаються швидкорозчинними, якщо не менше 85% від зазначеної у маркуванні кількості діючої речовини переходить у розчин за 30 хвилин.
Відсутність відповідних відмінностей (схожість) має бути продемонстрована у випадках, якщо потрібно більше 15 хвилин, але не більше 30 хвилин для досягнення майже повного розчинення (принаймні, 85% від зазначеної у маркуванні кількості діючої речовини). Фактор подібності або інші відповідні тести повинні використовуватися для демонстрації профілю подібності досліджуваного та референтного лікарських засобів.
4.8 Допоміжні речовини
Для лікарських засобів І класу за БСК рекомендується використовувати схожу кількість тих же допоміжних речовин у складі генеричного лікарського засобу, що і у складі референтного лікарського засобу.
Якщо біовейвер застосовується до діючих речовин ІІ та III класу за БСК, допоміжні речовини досліджуваного та референтного лікарських засобів мають бути якісно однаковими і кількісно дуже схожим, щоб виключити різні ефекти на мембранні білки-транспортери.
Допоміжні речовини, які можуть впливати на біодоступність (наприклад, сорбітол, манітол, натрію додецилсульфат або інші поверхнево-активні речовини) мають бути якісно і кількісно однаковими у досліджуваному та референтному лікарських засобах.
5. Загальні аспекти проведення тесту «Розчинення».
Повинно бути достатньо точок відбору зразків для отримання значущих профілів розчинення, принаймні, через кожні 15 хвилин. Рекомендується проводити більш частий відбір зразків під час періоду найбільшої зміни в профілі розчинення. Для швидкорозчинних лікарських засобів, якщо повне розчинення відбувається протягом 30 хвилин, може бути необхідний відповідний профіль шляхом відбору зразків через кожні 5-10 хвилин.
Якщо більш ніж 85% лікарського засобу розчиняється протягом 15 хвилин, профілі розчинення можуть прийматися як подібні без подальшої математичної оцінки.
У разі якщо не менше 85% діючої речовини не переходить у розчин за 15 хвилин, а переходить у розчин за 30 хвилин, то потрібні, принаймні, три точки відбору зразків: перша точка відбору до 15 хвилин, друга — 15 хвилин і третя, якщо вивільнення досягає 85%.
Для лікарських засобів з модифікованим вивільненням, необхідно дотримуватися таких рекомендацій:
профілі розчинення лікарських форм з відтермінованим вивільненням мають бути подібними в точках контролю, що відповідають механізму їх розчинення, тобто і при рН 1,2 (протягом 2 год), і при рН 6,8;
профілі розчинення форм з пролонгованим вивільненням мають бути подібними у трьох середовищах розчинення у точках контролю, які відповідають швидкості їх розчинення, наприклад, через 1 год, 2 год, 4 год, 6 год, 8 год і 16 год.
Фактор подібності f2 обчислюють за формулою:
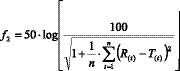
де
f2 — фактор подібності,
n— кількість точок контролю,
R(t) — середнє значення кількості діючої речовини, що перейшла у розчин при кожній зазначений точці контролю референтного препарату (у в відсотках до значення, вказаного на етикетці);
T(t).— середнє значення кількості діючої речовини, що перейшла у розчин при кожній зазначений точці контролю досліджуваного препарату (у в відсотках до значення, вказаного на етикетці);
Для референтного та генеричного лікарських засобів має визначатися кількість діючої речовини, у відсотках, від вказаного на етикетці.
Оцінка фактора подібності ґрунтується на наступних умовах:
— не менше трьох точок контролю (не враховуючі нульову);
— точки контролю для досліджуваного і референтного лікарських засобів повинні співпадати;
— кількість досліджуваних зразків — 12 повторностей для досліджуваного лікарського засобу і 12 для референтного;
— після розчинення 85% діючої речовини з референтного лікарського засобу до уваги беруться значення тільки в одній точці контролю;
— відносне стандартне відхилення середнього значення або коефіцієнт варіації для кожного лікарського засобу повинен бути менше 20% у першій точці контролю і не більше 10%, починаючи з другої і до останньої точки контролю.
Профілі розчинення вважаються подібними, якщо фактор подібності f2³.50
Необхідно надати задокументовані результати порівняльних досліджень in vitro, включаючи протокол випробовування, інформацію про досліджувану і референтну серії лікарських засобів, докладні дані щодо умов проведених випробувань, індивідуальні і середні результати та відповідну підсумкову статистику.
6. Вимоги досліджень біоеквівалентності для різних лікарських форм:
6.1. Таблетки, дисперговані у ротовій порожнині.
6.1.1. Таблетки, дисперговані в ротовій порожнині — таблетки, які помішають у ротову порожнину, де вони швидко диспергуються до їх проковтуння. Розміщення в ротовій порожнині і час контакту може бути критичним у випадках, якщо діюча речовина також розчиняється в роті і може всмоктуватися безпосередньо в слизовій оболонці щік. Якщо доведено, що діюча речовина не абсорбується в ротовій порожнині, а проковтується та всмоктується в шлунково-кишковому тракті, то є можливість використання процедури біовейвер, в разі виконання всіх вимог до цієї процедури (див. п.4).
6.1.2. Якщо таблетки, дисперговані у ротовій порожнині, є додатковою лікарською формою до іншого перорального складу, рекомендується проведення 3-х періодне дослідження з або без супутнього прийняття рідини. Проте, якщо біоеквівалентність між лікарським засобом, що приймається без води і референтним складом, що приймається з водою демонструється в 2-х періодному дослідженні, можна передбачити еквівалентність лікарського засобу, що приймається з водою.
6.1.3. Якщо таблетки, дисперговані в ротовій порожнині, є генериком до вже затвердженого референтного лікарського засобу, застосовуються такі рекомендації щодо дизайну дослідження:
якщо референтний лікарський засіб може застосовуватися з або без супутнього прийому рідини, еквівалентність повинна демонструватися без рідини, оскільки ця умова має найбільшу схожість з передбачуваним застосуванням складу лікарського засобу. Це особливо важливо, якщо діюча речовина (субстанція) може розчинятися і частково абсорбуватися у ротовій порожнині. Якщо еквівалентність доводиться у випадку, коли лікарський засіб приймається без рідини, він може порівнюватись з еквівалентність, коли лікарський засіб приймається з водою.
якщо референтний лікарський засіб приймається лише одним способом (наприклад, лише з рідиною), еквівалентність має бути доведена в цьому випадку у перехресному дизайні, що включає два періоди та дві послідовності прийому досліджуваних препаратів;
якщо референтний лікарський засіб застосовується лише одним способом (наприклад, лише з рідиною), а досліджуваний лікарський засіб має додаткові умови введення (наприклад, без води), усі способи застосування досліджуваного лікарського засобу необхідно порівняти з референтним лікарським засобом при звичайному способі застосування (дизайн з 3 видами прийому, 3 періодами, 6 послідовностями).
6.1.4. У дослідженнях таблеток, диспергованих у ротовій порожнині без води, рекомендується зволожувати ротову порожнину шляхом ковтання 20 мл води безпосередньо перед вживанням лікарського засобу, та надалі не приймати рідину протягом 1 години.
Вимоги до інших лікарських засобів, таких як плівки, дисперговані у ротовій порожнині, букальні таблетки або плівки для повільного защічного розчинення, сублінгвальні та жувальні таблетки мають відповідати вимогам (пп. 6.1.1 — 6.1.4) як для таблеток, диспергованих у ротовий порожнині. Дослідження біоеквівалентності повинні проводитися згідно з рекомендованим застосуванням лікарського засобу.
6.2. Розчини для орального застосування
6.2.1. Якщо допоміжні речовини можуть вплинути на проходження лікарського засобу шлунково-кишковим трактом (наприклад, сорбітол, манітол, тощо), абсорбцію (наприклад, поверхнево-активні речовини) або допоміжні речовини, які можуть вплинути на транспортну функцію білка, або на розчинність in vivo (наприклад, співрозчинники) або стабільність діючої речовини in vivo, необхідно проводити дослідження еквівалентності, якщо не обґрунтовано відсутність впливу цих допоміжних речовин на ці процеси.
6.2.2. У тих випадках, коли генеричний лікарський засіб є оральним розчином (наприклад, сироп), який має бути еквівалентним до іншої лікарської форми з негайним вивільненням для орального застосування, необхідне проведення дослідження еквівалентності in vivo.
6.3. Лікарські форми з фіксованими комбінаціями.
Залежить від типу фіксованих комбінацій:
6.3.1. Лікарський засіб є генериком до референтного препарату. У цьому випадку потрібні дослідження еквівалентності in vivo. Процедура біовейвер може бути застосована до твердих лікарських форм з негайним вивільненням для орального застосування, коли для всіх діючих речовин з комбінації можливо проведення процедури біовейвер та генеричний лікарський засіб відповідає вимогам цієї процедури за найгіршим випадком.
6.3.2. Комбінація містить відомі діючі речовини, які використовувались раніше одночасно у тих же дозах, але у вигляді окремих лікарських засобів. У цьому випадку слід продемонструвати у будь-який спосіб еквівалентність між окремими референтними і комбінованим досліджуваним лікарськими засобами та навести дані щодо відсутності взаємодії діючих речовин у зазначеній комбінації та терміни зберігання комбінованого лікарського засобу.
6.4. Розчини для парентерального застосування.
6.4.1. У випадку взаємодії будь-яких допоміжних речовини з діючою речовиною (наприклад, утворення комплексу) або наявності впливу на її розподіл, необхідно проводити дослідження еквівалентності in vivo, якщо не доведено, що генеричний і референтний лікарські засоби містять допоміжні речовини у подібній кількості, що може впливати на фармакокінетичний профіль діючої речовини.
6.4.2. Для інших шляхів введення парентеральних лікарських засобів, наприклад, внутрішньом’язово або підшкірно, та якщо досліджуваний лікарський засіб має однакову лікарську форму з референтним (водний або олійний розчин) та містить таку ж саму діючу речовину у тій самій кількості та такі ж самі допоміжні речовини у подібних кількостях, то дослідження з біоеквівалентності не потрібне. Крім того дослідження з біоеквівалентності не потрібне для водного парентерального розчину з подібними допоміжними речовинами у подібних кількостях, якщо може бути продемонстровано, що допоміжні речовини не впливають на в’язкість розчину.
6.4.3. Ліпосомні, міцелярні та емульсійні лікарські форми для внутрішньовенного введення.
6.4.3.1. Емульсії: емульсії звичайно потребують проведення дослідження еквівалентності in vivo.
Проте, існують випадки, коли можливо не проводити дослідження еквівалентності in vivo:
а) лікарський засіб не призначений для контролю вивільнення чи розподілу;
б) метод і швидкість введення являються такими же, як і у затвердженого на даний час референтного лікарського засобу.
В цих випадках якісний та кількісний склад досліджуваного лікарського засобу повинен бути якісно та кількісно однаковим із затвердженою в даний час емульсією, і необхідно представляти задовільні дані для демонстрації фізико-хімічних характеристик лікарської форми, включаючи розмір розподілу дисперсної рідкої фази, дзета-потенціал та реологічні властивості.
6.4.3.2. Ліпіди для внутрішньовенного введення можуть не потребувати дослідження еквівалентності in vivo, якщо представлені задовільні дані порівняльних фізико-хімічних характеристик. Відмінність в складі повинна бути обґрунтована з урахуванням основних властивостей і терапевтичних цілей таких лікарських форм.
6.4.3.3. Міцеллеформуючі склади: розчини міцел для внутрішньовенного введення вважаються комплексними розчинами і тому зазвичай потребують дослідження еквівалентності in vivo.
Дослідження еквівалентності in vivo може не проводитися, якщо:
а) відбувається швидкий розподіл міцел при розведенні лікарського засобу та їх вивільнення чи розподіл не є контрольованим;
б) метод і швидкість введення являються такими же, як і у затвердженого на даний час референтного лікарського засобу.
в) допоміжні речовини не впливають на розподіл лікарського засобу.
У цих випадках якісний та кількісний склад міцел безпосередньо перед вживанням повинен бути однаковим із затвердженим на даний час референтним препаратом, і необхідно представляти задовільні дані для демонстрації подібності фізико-хімічних характеристик. Повинні також враховуватися критичні концентрації міцел, здатність складу до розчинення, наявність вільної та зв’язаної діючої речовини та розмір міцел. Не повинно бути змін в кількості або типі поверхнево-активних речовин.
Це також застосовується у випадку незначних змін в кількісному чи якісному складі, при умові, що не включаються будь-які зміни в кількості чи типі поверхнево-активних речовин
6.4.4. Лікарські форми системної дії з модифікованим вивільненням
6.4.4.1. Лікарські форми з модифікованим вивільненням системної дії і трансдермальні лікарські форми.
Модифікований генеричний лікарський засіб може бути рекомендований до державної реєстрації не за повною заявою за умови надання відповідних матеріалів, які характеризують вказані відмінності, підтверджують заявлені терапевтичні властивості, та доведення безпеки та ефективності заявленого лікарського засобу.
7. Вимоги до доведення біоеквівалентності додаткових доз лікарського препарату
Якщо нова заява подається на декілька дозувань досліджуваного лікарського засобу, може бути достатнім проведення дослідження біоеквівалентності лікарського засобу тільки з однією або двома силами дії у залежності від пропорційності складу різних дозувань та інших питань, пов’язаних з лікарським засобом і описаних нижче. Дозування, що використовується для доведення біоеквівалентності, залежить від лінійності фармакокінетики діючої речовини.
7.1. У випадку нелінійної фармакокінетики (тобто не пропорційного збільшення AUC при збільшенні дози) може бути відмінність між різними дозами в чутливості для виявлення потенційних відмінностей між складами/формами.
Фармакокінетика вважається лінійною, якщо різниця в середніх AUC, відкоригованих по відношенню до дози, становить не більше 25% при порівнянні досліджуваного дозування (або дозування в планованому дослідженні біоеквівалентності) і дозування (дозувань), щодо яких розглядається відмова від досліджень in vivo.
Для оцінки лінійності заявник повинен розглянути всі опубліковані дані, що стосуються пропорційності доз, та критично їх розглянути. Вважається, що заявлені сили дії лікарського засобу знаходяться у лінійному діапазоні, якщо відмінності AUC, відкоригованих по відношенню до дози, відповідають критерію ± 25%.
Якщо біоеквівалентність була продемонстрована для дозування(-ях), які найбільш чутливі до виявлення потенційної відмінності між лікарськими засобами, для іншого(-их) дозування(-нь) може застосовуватися доведення фармацевтичної еквівалентності, у разі доведення пропорційності доз.
7.2. Загальні критерії на проведення досліджень in vivo для додаткових (пропорційних) доз лікарського засобу.
У разі розгляду можливості не проведення досліджень in vivo для додаткового (пропорційного) дозування необхідно виконати наступні загальні вимоги:
а) лікарські засоби вироблені одним і тим же самим виробником і за допомогою одного й того ж технологічного процесу,
б) якісний склад різних дозувань однаковий,
в) склад дозувань кількісно пропорційний, тобто співвідношення між кількістю діючої речовини і допоміжних речовин однакове для всіх доз (що стосується засобів з негайним вивільненням, компоненти покриття, оболонка капсули, барвники та ароматизатори/смакові добавки не повинні виконувати це правило).
Якщо є деякі відхилення від кількісно пропорційного складу, умова в) як і раніше вважається виконаною, якщо виконуються умови 1) та 2) або 1) та 3), наведені нижче. Ці умови застосовані для дозування, що використовувалось в дослідженні еквівалентності, і дозування, для якого розглядається можливість не проведення досліджень in vivo.
1) кількість діючої речовини становить менше 5% від маси ядра таблетки або маси вмісту капсули;
2) кількості різних допоміжних речовин ядра або вмісту капсули однакові для розглянутих дозувань, змінюється тільки кількість діючої речовини;
3) кількість наповнювача змінюється, щоб врахувати зміну кількості діючої речовини. Кількість інших допоміжних речовин ядра таблетки або вмісту капсули повинні бути однаковими для розглянутих дозувань.
г) відповідні дані порівняльних профілів розчинення in vitro повинні підтвердити адекватність відмови від досліджень in vivo на додаткове дозування.
Для лікарських засобів з лінійною фармакокінетикою, для яких виконуються вищезазначені умови а) — г), достатньо встановити біоеквівалентність тільки для одного дозування.
Як правило, дослідження біоеквівалентності слід проводити для найвищого дозування. Для лікарських засобів з лінійною фармакокінетикою, коли діюча речовина має високу розчинність, може бути прийнятний вибір меншого за максимальне дозування. Вибір меншого дозування можливо також обґрунтувати, якщо максимальне дозування не можна вводити здоровим добровольцям з причин безпеки/переносимості. Крім того, якщо проблеми чутливості аналітичного методу перешкоджають досить точним вимірам концентрації у плазмі після одноразового введення максимального дозування, можна вибрати більш високу дозу (переважно з використанням таблеток для багаторазового введення з максимальним дозуванням). Обрана доза може бути вище максимальної терапевтичної дози, за умови, що ця одноразова доза добре переноситься у здорових добровольців, і що немає жодних обмежень з абсорбції або розчинності для цієї дози.
Для лікарських засобів з нелінійною фармакокінетикою, яка характеризується більш, ніж пропорційним збільшенням AUC зі зростанням дози в діапазоні терапевтичної дози, дослідження біоеквівалентності, як правило, слід проводити при максимальному дозуванні.
Для лікарських засобів з менш, ніж пропорційним збільшенням AUC зі зростанням дози у діапазоні терапевтичної дози біоеквівалентність, в більшості випадків, слід встановлювати як при максимальному дозуванні, так і при мінімальному дозуванні (або дозуванні у лінійному діапазоні), тобто в цій ситуації потрібно два дослідження біоеквівалентності. Якщо нелінійна фармакокінетика не спричинена обмеженою розчинністю, а, наприклад, насиченням транспортерами захоплення за умови виконання вищезазначених умов а) — г), а генеричний і референтний лікарські засоби не містять будь-яких допоміжних речовин, які можуть вплинути на моторику шлунково-кишкового тракту або транспортні білки, досить продемонструвати біоеквівалентність при мінімальному дозуванні (або дозуванні в лінійному діапазоні).
Вибір інших дозувань можливо обґрунтувати, якщо існують проблеми аналітичної чутливості, що перешкоджають дослідженню при мінімальному дозуванні або, якщо максимальне дозування не можна вводити здоровим добровольцям з причин безпеки/переносимості.
8. Звіт про проведення досліджень з біоеквівалентності
Оскільки звіт про проведення досліджень біоеквівалентності є частиною реєстраційного досьє, то його слід укладати з урахуванням положень чинного законодавства України, а також відповідно до вимог Керівництв ЄС та FDA з дослідження біодоступності та біоеквівалентності.
Звіт має надаватися у складі реєстраційних матеріалів на лікарський засіб, що підлягає експертизі (додаток 8 або додаток 10 до Порядку, залежно від обраного заявником формату реєстраційного досьє).
Додаток 23
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), а також експертизи матеріалів
про внесення змін до реєстраційних матеріалів
протягом дії реєстраційного посвідчення
Критерії та порядок
проведення додаткових випробувань лікарських засобів
І. Критерії щодо проведення додаткових досліджень.
1. Додаткові випробування щодо фармацевтичної розробки при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення проводяться у випадках, коли за результатами експертизи реєстраційних матеріалів було встановлено, що:
- відсутні або недостатні дані, що мають бути представлені у відповідності до вимог, передбачених частиною ІІ додатка 8 або Модулем 3 додатка 10 до Порядку, для підтвердження того, що розроблена лікарська форма та запропонований склад задовольняють мету, вказану в заяві на проведення експертизи матеріалів щодо державної реєстрації лікарського засобу;
- відсутні або недостатні дані, що мають бути представлені відповідно до вимог, передбачених частиною ІІ додатка 8 або Модулем 3 додатка 10 до Порядку, щодо фізико-хімічних характеристик діючої речовини, які впливають на біодоступність;
- відсутні або недостатні дані щодо досліджень для підтвердження еквівалентності генеричного лікарського засобу до референтного препарату на етапі фармацевтичної розробки, передбачені вимогами, викладеними у додатку 22 до Порядку.
2. Додаткові випробування щодо підтвердження якості лікарських засобів при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться у випадку, коли за результатами експертизи реєстраційних матеріалів було встановлено, що:
- в матеріалах реєстраційного досьє відсутні або недостатньо даних, які мають бути представлені у відповідності до вимог частини ІІ додатка 8 або Модуля 3 додатка 10 до Порядку, для складання вмотивованих висновків щодо якості препарату;
- за результатами інспекційної перевірки встановлено, що не були дотримані умови зберігання досліджуваного лікарського засобу при проведенні клінічних випробувань або невідповідність номерів серій зразків досліджуваного лікарського засобу при проведенні клінічних випробувань.
3. Додаткові випробування щодо підтвердження відтворюваності методів контролю при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться у випадках, коли:
- за результатами експертизи реєстраційних матеріалів було встановлено, що методика випробування відсутня або не відповідає методикам, наведеним у Державній фармакопеї України (далі — ДФУ), Європейській Фармакопеї або інших національних фармакопеях провідних країн.
4. Додаткові випробування щодо доклінічних досліджень при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться у випадку, коли за результатами експертизи реєстраційних матеріалів було встановлено, що:
- необґрунтовано відсутні дані, представлені у відповідності до вимог, передбачених частиною ІІІ додатка 8 або Модулем 4 додатка 10 до Порядку, щодо фармакологічних, фармакокінетичних та токсикологічних досліджень;
- недостатньо даних, представлених у відповідності до вимог, передбачених частиною ІІІ додатка 8 або Модулем 3 додатка 10 до Порядку, стосовно фармакологічних, фармакокінетичних та токсикологічних досліджень лікарського засобу.
5. Додаткові випробування щодо ефективності та/або безпеки лікарського засобу при проведенні експертизи реєстраційних матеріалів на лікарські засоби, які подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться у випадку, коли за результатами експертизи звітів проведеного клінічного дослідження, наданих заявником, встановлено, що:
- клінічні дані, надання яких передбачено частиною ІV додатка 8 або Модулем 5 додатка 10 до Порядку, представлені не в повному обсязі або/та недостатньо обґрунтовують окремі показання для застосування або протипоказання, схеми призначення;
- наявні негативні дані стосовно ефективності або безпеки лікарського засобу, представлені у відповідності до вимог, передбачених частиною ІV додатка 8 або Модулем 5 додатка 10 до Порядку, і ці дані потребують додаткових досліджень;
- проведені клінічні випробування неадекватні для підтвердження ефективності та безпеки лікарського засобу;
- дані спричиняють сумнів щодо достовірності результатів проведених клінічних досліджень.
6. Додаткові випробування для комбінованих лікарських засобів, що містять у своєму складі відомі діючі речовини, які раніше не застосовувались у даному сполученні з терапевтичною метою, проводяться у випадку, коли не у повному обсязі представлені токсикологічні, фармакологічні або клінічні дослідження, які повинні надаватись у відповідності до вимог, передбачених частиною ІІІ додатка 8 або Модулем 4 додатка 10 до Порядку.
Це не стосується випадків, коли комбіновані лікарські засоби містять відомі діючі речовини, які раніше використовувались у медичній практиці як окремі препарати у тій же лікарській формі, дозах та відповідному співвідношенні для досягнення тієї ж терапевтичної мети. При цьому заявник повинен надати результати досліджень, що засвідчать як на стадії виробництва, так і протягом терміну зберігання комбінованого лікарського засобу відсутність між інгредієнтами будь-якої взаємодії, яка може вплинути на ефективність та безпеку препарату.
7. Додаткові випробування щодо біодоступності та біоеквівалентності генеричних лікарських засобів при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться у випадку, коли:
- дані представлені не в повному обсязі для підтвердження біоеквівалентності препарату згідно з вимогами, викладеними у додатку 22 до Порядку;
- дані неадекватні для підтвердження біоеквівалентності генеричного лікарського засобу згідно з вимогами, викладеними у додатку 22 до Порядку;
- існує ризик того, що можливі відмінності в біодоступності можуть призвести до терапевтичної нееквівалентності.
8. Додаткові клінічні випробування МІБП (клініко-епідеміологічних випробувань для вакцин та анатоксинів) проводяться у випадку коли за результатами експертизи звітів про проведення клінічних випробувань (клініко-епідеміологічних випробувань для вакцин та анатоксинів), наданих заявником, встановлено хоча б один із таких фактів:
- у матеріалах реєстраційного досьє недостатньо даних для підтвердження показників ефективності МІБП;
- дані клінічних випробувань (клініко-епідеміологічних випробувань для вакцин та анатоксинів) представлені не в повному обсязі або/та недостатньо обґрунтовують окремі показання для застосування або протипоказання, схеми призначення;
- наявні дані стосовно ефективності або безпеки МІБП потребують додаткових перевірок;
- дані викликають сумнів щодо достовірності результатів проведених клінічних досліджень.
Рішення щодо необхідності проведення додаткових клінічних випробувань МІБП (клініко-епідеміологічних випробувань для вакцин та анатоксинів) приймає МОЗ.
ІІ. Порядок проведення додаткових випробувань лікарських засобів
1. Додаткові випробування щодо фармацевтичної розробки, підтвердження якості та відтворюваності методів контролю при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться в уповноважених лабораторіях відповідно до галузі акредитації за направленням Центру на підставі укладеного з ним договору.
2. Додаткові випробування щодо доклінічних досліджень лікарських засобів при проведені експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться в установах, визначених МОЗ в установленому порядку як такі, що можуть проводити доклінічні випробування лікарського засобу.
3. Додаткові випробування щодо ефективності та/або безпеки лікарських засобів при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться у спеціалізованих лікувально-профілактичних закладах, визначених МОЗ в установленому порядку як такі, що можуть проводити клінічні випробування лікарського засобу.
4. Додаткові випробування щодо біодоступності та біоеквівалентності генеричних лікарських засобів при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію, а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, проводяться в спеціалізованих лікувально-профілактичних закладах, визначених МОЗ в установленому порядку як такі, що можуть проводити клінічні випробування, та лабораторіях фармакокінетики Центру, а у разі неможливості проведення певних досліджень — в інших уповноважених лабораторіях за направленням Центру.
5. Додаткові випробування здійснюються на договірних засадах між заявником та установою (лабораторією, лікувально-профілактичним закладом тощо), що виконує відповідні додаткові випробування.
6. Додаткові випробування щодо фармацевтичної розробки лікарського засобу проводяться відповідно до вимог, зазначених у частині ІІ додатка 8 або Модуля 3 додатка 10 до Порядку.
7. Додаткові випробування щодо підтвердження якості лікарського засобу та відтворюваності методів контролю проводяться відповідно до специфікації та методів контролю, наданих у реєстраційних матеріалах.
7.1. Лікарський засіб не направляють на додаткові випробування з якості у таких випадках:
- лікарський засіб зареєстровано в країнах ЄС за централізованою процедурою;
- лікарський засіб є в списку препаратів, який пройшов прекваліфікацію ВООЗ;
- після проведення клінічних випробувань (дослідження біоеквівалентності) за умови, що контроль якості вже проводився на досліджуваному лікарському засобі, і специфікація та технологія виробництва лікарського засобу не зазнали змін;
- реєстрація додаткових доз лікарського засобу до вже зареєстрованого дозування за умови, що склад дозувань пропорційно-подібний, виробництво лікарського засобу відбувається на одному й тому ж обладнанні в умовах, передбачені ліцензією на виробництво цього лікарського засобу, проведено дослідження з валідації методів контролю та технологічного процесу;
- при одночасній реєстрації декількох дозувань лікарського засобу випробуванню з якості підлягає лише одне дозування за умови що склад дозувань пропорційно-подібний, виробництво лікарського засобу відбувається на одному й тому ж обладнанні в умовах передбачені ліцензією на виробництво цього лікарського засобу;
- лікарський засіб має високу вартість (еквівалентної 500 і більше євро)
- для проведення випробування за окремими показниками якості (наприклад, «Стерильність», «Мікробіологічна чистота» тощо) необхідна велика кількість зразків, а вартість одного зразка еквівалентно 100 і більше євро;
- для проведення випробування за окремими показниками якості в уповноважених лабораторіях відсутнє необхідне обладнання;
- лікарський засіб є препаратом обмеженого застосування (сирота);
- реєстрація лікарського засобу під іншою назвою (зміна назви препарату);
- готовий лікарський засіб подається на перереєстрацію в Україні;
- субстанція (діюча речовина) подається на реєстрацію (перереєстрацію) в Україні;
- технологія виробництва полягає в процедурі фасування (пакування) з лікарського засобу in bulk, а лікарський засіб in bulk зареєстровано в установленому порядку з проведенням контролю якості.
- вносяться зміни до інструкції для медичного застосування (зміна терапевтичних показань, дозуючого пристрою тощо).
- реєстрація лікарського засобу проводиться згідно реєстраційної процедури «заява інформованої згоди» за умови наявності реєстраційного посвідчення того ж або іншого власника на ринку України.
- в реєстраційному досьє представлено дослідження з валідації методів контролю;
- подана заява про перереєстрацію та протягом дії реєстраційного посвідчення специфікація та методи контролю якості не змінювались, або заявником вносились або вносяться зміни до матеріалів реєстраційного досьє у частині, що стосується специфікації та методів контролю якості, у повній відповідності до вимог чинного законодавства.
7.2. Лікарський засіб не направляється на додаткові дослідження з контролю активності антибіотиків у таких випадках:
- діюча речовина отримана суто хімічним способом, а в матеріалах досьє наведений доказ структури молекули;
- в матеріалах досьє наведені власні дослідження in vitro з контролю активності антибіотиків.
- в матеріалах досьє представлено доказ терапевтичної еквівалентності лікарського засобу шляхом проведення клінічних випробувань.
8. Додаткові випробування щодо доклінічних досліджень проводяться відповідно до вимог чинних Порядку проведення доклінічного вивчення лікарських засобів та Порядку визначення установ, які проводять доклінічне вивчення лікарських засобів.
9. Додаткові випробування щодо ефективності та/або безпеки лікарських засобів, та/або підтвердження даних щодо біодоступності та біоеквівалентності генеричних лікарських засобів проводяться відповідно до чинних Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення про комісію з питань етики, у порядку, передбаченому для поточних випробувань.
10. Звіти щодо проведених додаткових випробувань заявник надає до Центру для проведення спеціалізованої експертизи.
Додаток 24
до Порядку проведення експертизи матеріалів
на лікарські засоби, що подаються на державну реєстрацію
(перереєстрацію), а також експертизи матеріалів
про внесення змін до реєстраційних матеріалів
протягом дії реєстраційного посвідчення
Умови,
яким повинні відповідати лікарські засоби обмеженого застосування (препарати-сироти), та особливості їх
реєстраційних матеріалів
1. Лікарські засоби обмеженого застосування повинні відповідати таким умовам:
а) призначені для діагностики, профілактики або лікування захворювання, що загрожує життю або серйозно ослаблює імунітет не більше ніж 5 осіб на 10000 жителів на момент подання заяви або
призначені для діагностики, профілактики або лікування захворювання, що загрожує життю або серйозно ослаблює імунітет або хронічних захворювань, та його продаж без надання компенсації від держави або співтовариства не принесе значного прибутку, який компенсує витрати на лікарський засіб, понесені виробником
та
б) не існує будь-якого іншого затвердженого задовільного методу діагностики, профілактики чи лікування даного захворювання, або при наявності такого методу — заявлений лікарський засіб принесе значну користь хворим.
2. Заява на реєстрацію лікарського засобу обмеженого застосування подається відповідно до додатку 1 до Порядку. До заяви додаються:
підтвердження внесення заявленого лікарського засобу до реєстру Європейського Співтовариства по препаратам-сиротам, або
підтвердження статусу препарату-сироти, надане компетентними органами країни заявника/виробника або країн, у яких лікарський засіб отримав цей статус, та відомості про реєстрацію як препарату-сироти в інших країнах;
письмове зобов’язання про надання щорічного підтвердження статусу препарату-сироти, отримане від Комітету по препаратам-сиротам Європейського Співтовариства або компетентних органів країни заявника/виробника або країн, у яких лікарський засіб отримав цей статус.
3. Реєстраційні матеріали оформлюються відповідно вимог додатку 10 до Порядку.
При поданні реєстраційного досьє на препарати-сироти можуть бути застосовані положення розділу 6 частини ІІ додатку 10. У такому випадку заявник у резюме доклінічних та клінічних даних повинен надати обґрунтування причин, за яких неможливо надати повну інформацію, та обґрунтування співвідношення користь/ризик для заявлених препаратів-сиріт.
4. Заява повинна охоплювати тільки ті терапевтичні показання, які відповідають умовам, викладеним у п.1 цього додатку. Це не може бути перешкодою для подання окремої заяви на нову реєстрацію такого лікарського засобу за іншими показаннями для застосування, що не відповідають вищезазначеним умовам (за іншим реєстраційним досьє).
5. При реєстрації лікарських засобів обмеженого застосування не проводиться передреєстраційний контроль якості.
АНАЛІЗ РЕГУЛЯТОРНОГО ВПЛИВУ
до проекту наказу Міністерства охорони здоров’я України «Про внесення змін до наказу МОЗ України від 26.08.2005 № 426»
(далі — проект наказу)
1. Визначення та аналіз проблеми, яку передбачається розв’язати шляхом державного регулювання
Державна політика у сфері обігу лікарських засобів визначає необхідність забезпечення населення України ефективними, безпечними та якісними лікарськими засобами. Експертиза матеріалів реєстраційного досьє є важливою процедурою, яка дає можливість підтвердити (або спростувати) ефективність, безпечність та якість лікарських засобів.
Предметом правового регулювання запропонованого проекту акта є удосконалення процедури державної реєстрації лікарських засобів.
Проект наказу «Про затвердження змін до наказу МОЗ від 26.08.2005 № 426» розроблений Міністерством охорони здоров’я.
Проектом передбачено внесення змін до чинного Порядку проведення експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію (перереєстрацію), а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення у відповідності із директивами та іншими документами ЄС, рекомендаціями Всесвітньої організації охорони здоров’я тощо.
При постачанні лікарських засобів в Україну від зарубіжних виробників проблемою стала відповідність виробництва цих засобів вимогам належної виробничої практики (GMP), оскільки в даний час національними нормативно-правовими актами не передбачена їх обов’язковість.
У минулому році, при проведенні сертифікації зарубіжних підприємств, продукція яких реалізується в Україну, в 30% випадків перевірок виявлено критичні невідповідності виробництв, тобто існує потенційна можливість випуску препаратів, що загрожують життю пацієнта. Таким чином, для захисту українського фармацевтичного ринку і населення країни від неякісних лікарських засобів назріла необхідність в інспектуванні іноземних виробників згідно вимог GMP на етапі реєстрації лікарських засобів.
2. Цілі і завдання прийняття наказу
Відповідно до статті 51 Угоди про партнерство і співробітництво між Європейським Співтовариством і Україною важливою умовою для зміцнення економічних зв’язків між Україною та Співтовариством є зближення існуючого і майбутнього законодавства України з законодавством Співтовариства. Тобто, Україна має вжити заходів для забезпечення того, щоб її законодавство поступово було приведене у відповідність до законодавства Співтовариства,
Україна стала першою країною серед колишніх республік Радянського Союзу, в якій стандарти GMP були визнані обов’язковими, а регуляторна система визнана міжнародним співтовариством. З 2011 року регуляторний орган Україні у сфері забезпечення якості лікарських засобів — Державна служба України з лікарських засобів стала членом міжнародної Системи співробітництва фармацевтичних інспекцій — Pharmaceutical Inspection Cooperation Scheme (PIC/S). Членство в PIC/S — це своєрідна конвенція з питань фармацевтичного інспектування, основні завдання якої — міжнародний розвиток, впровадження і дотримання стандартів GMP. Для досягнення вищезазначених цілей PIC/S розробляє стандарти GMP, гармонізовані з нормативними документами ЄС, та інші настанови, сприяє їх впровадженню на фармацевтичних виробництвах. Також PIC/S сприяє оптимізації співробітництва між національними регуляторними органами і міжнародними організаціями. Переваги для країни від її членства в PIC/S полягають у забезпеченні захищеності споживачів від неякісної фармацевтичної продукції. Безперечною перевагою для фармацевтичних підприємств є зменшення кількості дублюючих перевірок, з чого випливає раціональне використання фінансових ресурсів; спрощення процедур експорту-імпорту продукції на міжнародних ринках. Управління якістю — одна з основних функцій управління на виробництві. Система управління якістю дає регуляторним органам більше впевненості в тому, що виробництво є послідовним і надійним з точки зору виробничих стандартів. Основний елемент механізму управління якістю на виробництві — правильна інфраструктура системи якості, яка включає необхідні процедури, процеси і ресурси. Система забезпечення якості передбачає дотримання вимог GMP, а також розробку і дотримання при виробництві належного дизайну продукції та упаковки. На підставі вищевикладеного, Міністерством охорони здоров’я України розроблений проект наказу, приписами якого передбачено наявність в реєстраційних матеріалах документів, які підтверджують відповідність умов виробництва чинним в Україні вимогам належної виробничої практики (GMP).
Вступ України до Світової організації торгівлі (СОТ) обумовив визначення нових правових норм у сфері обігу лікарських засобів. Базовими засадами документів СОТ визначено, що торговельна система має бути відкритою для чесної конкуренції. Отже виникла потреба в імплементації в чинне законодавство положень Угоди про торгові аспекти прав інтелектуальної власності ТРИПС (TRIPS — Agreement on Trade Related Aspects of Intellectual Property Rights), яка встановлює необхідні стандарти в сфері інтелектуальної власності і зобов’язує країни учасниці СОТ забезпечити повну патентну охорону (як виробничих процесів, так і самих продуктів, у тому числі до фармацевтичної продукції.
Прийняття цього наказу сприятиме:
- удосконаленню процедури державної реєстрації (перереєстрації) лікарських засобів та внесення змін до реєстраційних матеріалів у відповідності із директивами та іншими документами ЄС, рекомендаціями Всесвітньої організації охорони здоров’я;
- запровадженню рівних умов для вітчизняних та іноземних виробників лікарських засобів;
- підсиленню контролю за тривалістю, прозорістю та дотриманням процедури державної реєстрації (перереєстрації) та внесення змін до реєстраційних матеріалів лікарських засобів;
- оптимізація системи реєстрації лікарських засобів, реалізація якої гарантуватиме забезпечення населення України якісними, безпечними та ефективними лікарськими засобами.
3. Альтернативні способи досягнення мети
Як альтернативний спосіб досягнення цілей була розглянута ситуація, коли діючі умови залишаться без змін, тобто залишаться наявні розбіжності положень різних нормативно-правових актів.
Слід зазначити, що результатом такого підходу можуть стати:
- неналежне виконання положень Законів України «Про лікарські засоби» та «Про загальнодержавну адаптацію законодавства України до законодавства Європейського Союзу»;
- відсутність можливості координування та контролю впровадження міжнародних стандартів у фармацевтичній галузі;
- гальмування розвитку вітчизняного виробництва лікарських засобів, зокрема, генериків;
- подальшому застосуванню нерівних умов для вітчизняних та іноземних виробників лікарських засобів;
- неможливість здійснення належної оцінки якості, безпечності та ефективності високотехнологічних лікарських засобів та надходження таких препаратів на фармацевтичний ринок України.
Оскільки основним нормативним документом, що регулює процедуру державної реєстрації лікарських засобів в Україні та вимоги до реєстраційних документів є наказ № 426, то з метою забезпечення гармонізації вищезазначеного документу з директивами ЄС та вимогами СОТ, він потребує змін.
Адаптація законодавства України до законодавства ЄС є пріоритетною складовою процесу інтеграції України до ЄС та пріоритетним напрямом її зовнішньої політики.
Запропонований проект акта відповідає правилам та нормам ЄС, та законодавству, яке прийнято в Україні на вимоги СОТ.
З огляду на вищевикладене, альтернативи запропонованому регуляторному акта немає.
4. Механізм і заходи, які забезпечують розв’язання проблеми
Прийняття наказу удосконалить систему реєстрації лікарських засобів, посилить контроль за обігом лікарських засобів в частині державної реєстрації, реалізація якої гарантуватиме забезпечення населення України якісними, безпечними та ефективними лікарськими засобами. Окрім того, будуть усунені розбіжності з нормативними актами, що мають вищу юридичну силу, а саме: Законом України «Про лікарські засоби» та постановою Кабінету Міністрів України від 26 травня 2005 р. № 376 «Про затвердження Порядку державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за їх державну реєстрацію (перереєстрацію)» (із змінами).
Проектом акту передбачено викладення деяких термінів відповідно до європейських та міжнародних стандартів, зокрема, термінів «побічна реакція», «післяреєстраційне дослідження з безпеки», «реєстраційні матеріали», «інструкція для медичного застосування лікарського засобу», «ризик, пов’язаний із застосуванням лікарського засобу», «експертиза матеріалів на лікарський засіб», «реєстраційне посвідчення на лікарський засіб», «ефективність лікарського засобу», «якість лікарського засобу», «повна і незалежна заява (автономна заява)», «діючі речовини (субстанції)», «комбінований препарат-генерик», «заява на лікарський засіб, який має добре вивчене медичне застосування», «неінтервенційне дослідження», «фармацевтична еквівалентність», «фармацевтично альтернативні лікарські засоби», «біовейвер», «біофармацевтична система класифікації (БСК)», «дослідження еквівалентності in vitro», «дослідження еквівалентності, «заява на продукцію із in bulk».
Проектом наказу МОЗ України «Про затвердження змін до наказу МОЗ від 26.08.2005 № 426» пропонується викласти у новій редакції деякі терміни, внести зміни до Порядку проведення експертизи лікарського засобу, що подається на державну реєстрацію (перереєстрацію) та Порядку експертизи матеріалів про внесення змін до реєстраційних матеріалів на лікарський засіб, а також доповнити Порядок проведення експертизи розділом 5 «Порядок проведення контролю якості лікарського засобу, який подається на державну реєстрацію (перереєстрацію)» тощо.
Відповідно до норм постанови Кабінету Міністрів України від 26 травня 2005 р. № 376 «Про затвердження Порядку державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за їх державну реєстрацію (перереєстрацію)» (із змінами) передбачено подання копі] документу, що підтверджує відповідність умов виробництва чинним в Україні вимогам належної виробничої практики (GMP), виданого Держлікслужбою (для вітчизняних виробників — копія чинної ліцензії на виробництво лікарських засобів, зазначена у підпункті и) цього пункту) або копія офіційного документу, виданого уповноваженим органом, який входить до міжнародної системи співробітництва фармацевтичних інспекцій (PIC(S), про відповідність виробництва вимогам GMP.
З метою забезпечення виконання вимог Угоди про торгові аспекти прав інтелектуальної власності ТРИПС щодо захисту прав інтелектуальної власності в Україні, пропонується внести наступну зміну: «якщо після проведення розгляду заяви про порушення прав суд установив, що внаслідок такої реєстрації можуть бути порушені захищені патентом України майнові права інтелектуальної власності, у тому числі в процесі виробництва, використання, продажу лікарських засобів».
5. Обґрунтування можливостей досягнення визначених цілей у разі прийняття регуляторного акту
Прийняття наказу сприятиме удосконаленню нормативно-правового поля для реалізації державної політики у сфері обігу лікарських засобів шляхом удосконалення порядку експертизи, що сприятиме введенню на фармацевтичний ринок України якісних, ефективних та безпечних лікарських засобів шляхом подальшої розбудови системи реєстрації лікарських засобів у відповідності до європейських норм, посилить контроль за обігом лікарських засобів в частині державної реєстрації, запобігатиме появі неякісних та неефективних препаратів на ринку України. Прийняттям наказу будуть усунені розбіжності з нормативними актами, що мають вищу юридичну силу, а саме: Законом України «Про лікарські засоби» та постановою Кабінету Міністрів України від 26 травня 2005 р. № 376 «Про затвердження Порядку державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за їх державну реєстрацію (перереєстрацію)» (із змінами).
Соціально-економічні та інші результати впровадження запропонованого акта, у разі його прийняття, пов’язані із запобіганням застосування неякісних, неефективних та небезпечних лікарських засобів, з метою охорони здоров’я громадян і захисту їх життя.
6. Очікувані результати
|
Вигоди |
Витрати |
|
Сфера інтересів держави |
|
|
1. Реалізація державної політики у сфері обігу лікарських засобів. |
Додаткові витрати державного та місцевих бюджетів відсутні |
|
Сфера інтересів суб’єктів господарювання |
|
|
1. Створення прозорої системи експертизи реєстраційних матеріалів. |
Додаткові витрати суб’єктів господарювання не виникнуть |
|
Сфера інтересів громадян |
|
|
1. Створення сприятливих умов для поліпшення забезпечення населення і закладів охорони здоров’я якісними, високоефективними, безпечними та доступними лікарськими засобами. |
Додаткові витрати громадян відсутні |
7. Обґрунтування строку дії регуляторного акта.
Термін дії проекту акту необмежений (безтерміновий).
8. Прогнозні значення показників результативності
Прогнозовані показники результативності регуляторного акта:
а) Розмір надходження до державного та місцевих бюджетів цільових фондів — реалізація акта не передбачає додаткових надходжень та втрат до державного та місцевих бюджетів.
б) Кількість суб’єктів господарювання, та/або фізичних осіб, на які поширюватиметься дія акта — дія акта поширюється на усіх суб’єктів господарювання (резидентів та нерезидентів), які є заявниками та/або виробниками лікарських засобів, і відповідають за їх ефективність, безпечність та якість.
в) Розмір коштів, що витрачатиметься суб’єктами господарювання та/або фізичними особами, пов’язаний з виконанням вимог акта — запропонований акт не вимагає від суб’єктів господарювання додаткових витрат.
г) Час, що витрачатиметься суб’єктами господарювання та/або фізичними особами, пов’язаний з виконанням вимог акта — прийняття запропонованого акту не збільшить витрати часу суб’єктами господарювання при проведенні державної реєстрації (перереєстрації) лікарських засобів, та внесення змін до матеріалів реєстраційного досьє протягом дії реєстраційного посвідчення.
д) Рівень поінформованості суб’єктів господарювання та/або фізичних осіб оцінюється як середній за рахунок публікації на офіційному сайті Міністерства охорони здоров’я України. (www.moz.gov.ua).
9. Заходи, з допомогою яких буде здійснюватися відстеження результативності регуляторного акта
Відстеження результативності зазначеного регуляторного акта буде здійснюватися шляхом обробки статистичної інформації щодо кількості лікарських засобів, що зареєстровані в Україні.
Базове відстеження результативності регуляторного акта буде здійснюватися після набуття чинності цим регуляторним актом.
Повторне відстеження буде здійснюватися через рік після набрання чинності цим регуляторним актом за результатами якого можливо здійснити порівняння показників базового та повторного відстеження.
Відстеження результативності акта буде проводитись шляхом аналізу даних щодо ефективності, безпечності та якості лікарських засобів, опитування суб’єктів господарювання, зайнятих у сфері обігу лікарських засобів.
Аналіз регуляторного впливу підготовлено Міністерством охорони здоров’я України.
| Заступник Міністра — керівник апарату |
Р.М. Богачев |

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим