|
|
Відкриваючи перший семінар, заступник міністра охорони здоров’я України, голова Державної служби лікарських засобів і виробів медичного призначення Михайло Пасічник зазначив, що в останні роки на фармацевтичному ринку України ведеться активна робота щодо забезпечення якості, безпеки й ефективності ЛЗ. Постановою Кабінету Міністрів України № 1075 від 17 липня 2003 р. затверджено Програму боротьби з виробництвом та розповсюдженням фальсифікованих лікарських засобів на 2003–2008 рр. для недопущення на внутрішній ринок неякісних та фальсифікованих ЛЗ та з метою захисту здоров’я громадян та економіки держави від збитків. З 23 жовтня 2003 р. працює Державна служба лікарських засобів, що була сформована на основі Державного департаменту в складі МОЗ України як урядовий орган державного управління (Указ Президента України № 91/2003 від 7 лютого 2003 р. «Про заходи щодо поліпшення забезпечення населення лікарськими засобами і виробами медичного призначення, а також підвищення ефективності державного управління у цій сфері»). Створено Ліцензійну комісію Державної служби, до складу якої, крім представників Державної служби, входять члени Комітету з контролю за наркотиками, Фармацевтичної асоціації України, Всеукраїнської аптечної асоціації, Асоціації фармацевтичних дистриб’юторів, працівники СБУ, МВС України та ін. Голова Державної служби повідомив, що зараз готується положення про правила перевірки суб’єктів господарської діяльності. Найближчим часом планується затвердити графік таких перевірок по Україні і по кожній області окремо.
Перший заступник Головного державного інспектора України з контролю якості лікарських засобів Віталій Варченко, виступаючи з доповіддю «Контроль за якістю лікарських засобів в Україні як складова частина забезпечення безпеки їх застосування», зазначив, що проблема фальсифікованих та контрабандних ЛЗ досить актуальна для фармацевтичного ринку України. В багатьох випадках і з різних причин вони є безумовно небезпечними для здоров’я пацієнтів. В результаті співпраці фахівців ДІКЯ МОЗ України та її територіальних підрозділів у 2000 р. виявлено і вилучено з обігу 18, у 2001 р. — 40, у 2002 р. — 62, за 9 міс 2003 р. — 26 серій фальсифікованих ЛЗ (рисунок).
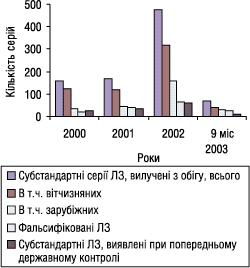 |
Рисунок. Кількість серій субстандартних ЛЗ, виявлених і вилучених з обігу в Україні в 2000–2003 рр.
Збільшення кількості випадків виявлення фальсифікованої та субстандартної продукції в 2002 р., на думку В. Варченка, пов’язане з введенням посади уповноваженої особи в аптечних установах та дистриб’юторських компаніях. Це дало змогу більш ретельно перевіряти якість ЛЗ, що надходять в оптову та роздрібну торгівлю. Зростання обсягів виробництва та збільшення кількості ЛЗ, що постачаються на ринок, також може бути причиною збільшення кількості випадків виявлення субстандартної продукції.
За 9 міс 2003 р. всього по Україні лабораторіями територіальних державних інспекцій проаналізовано 84 999 зразків ЛЗ: 50 019 (58,9%) вітчизняного та 34 980 (41,1%) зарубіжного виробництва.
Частка виявлених за 9 міс 2003 р. зразків, які не відповідали вимогам аналітичної нормативної документації (АНД), в середньому по Україні становить 2,8% (найвищі показники в Миколаївській та Рівненській областях: 13,6 та 10,0% відповідно). Частка ЛЗ вітчизняного виробництва, що не відповідали вимогам АНД, в середньому по Україні становить 3,3% (в Донецькій області — 11,4%; в Миколаївській — 12,3%), зарубіжних лікарських засобів — 2,2% (в Миколаївській області — 34,2%, в м. Севастополі — 40,0%).
З початку цього року до 20 жовтня було видано 76 приписів стосовно 38 найменувань лікарських засобів 27 вітчизняних виробників (в тому числі 9 фармацевтичних фабрик), якими було заборонено обіг усіх серій 4 ЛЗ та окремих серій ЛЗ — 81 (в т. ч. 28 окремих серій ЛЗ, вироблених фармацевтичними фабриками). Також ДІКЯ МОЗ України за 10 міс 2003 р. було надано 36 інформаційних листів щодо 133 найменувань ЛЗ 66 вітчизняних виробників (в тому числі 15 фармацевтичних фабрик) на перевірку та вилучення з обігу субстандартних зразків 505 окремих серій ЛЗ (в тому числі 119 — вироблених фармацевтичними фабриками).
Протягом 2000–2003 р. в Україні було виявлено і вилучено 446 найменувань незареєстрованих ЛЗ: в 2000 р. — 14, в 2001 р. — 132, в 2002 р. — 205, за 9 міс 2003 р. — 95.
В. Варченко зазначив, що наведені дані підтверджують: проблема фальсифікації ЛЗ потребує комплексних підходів на законодавчому рівні, взаємодії із силовими структурами, об’єднання зусиль всіх легальних суб’єктів фармацевтичного ринку.
Начальник відділу ДІКЯ МОЗ України Ірина Пилипенко ознайомила присутніх з переліками фальсифікованих ЛЗ, виявлених в Україні протягом 2000–2003 рр. (всього за 4 роки було зафіксовано 145 фальсифікованих серій ЛЗ), та звернула увагу на зростання кількості як найменувань, так і фальсифікованих серій ЛЗ. Порівняно з 2000 р., коли було виявлено 17 фальсифікованих серій ЛЗ 4 найменувань, в 2003 р. їх кількість збільшилася до 26 серій ЛЗ 14 найменувань.
Фальсифіковані ЛЗ, виявлені в Україні в I–II кварталі 2003 р.: Бісептол (Паб’яницький завод «Польфарма», Польща) — 1 серія; Валокордин, краплі (флакони-крапельниці) 20 мл («Кромвель Мойзельбах ГмбХ», Німеччина) — 2 серії; Декарис, таблетки по 150 мг № 1 ( Угорщина) — 2 серії; Ессенціале-Н, розчин для ін’єкцій по 5 мл № 5 («Рон-Пуленк Рорер», Німеччина) — 1 серія; Кокарбоксилази гідрохлорид (ВАТ «Дніпрофарма», Україна) — 5 серій; Левоміцетин, таблетки по 0,5 г № 10 (ВАТ «Монфарм», Україна) — 1 серія; Неогемодез, розчин для інфузій по 200 мл у пляшках (АТ «Конотопм’ясо», Україна) — 1 серія; Ретарпен, порошок 2,4 млн МО («Біохемі ГмбХ», Австрія) — 1 серія; Смекта, порошок («Бофур Іпсен», Франція) — 1 серія; Супрастин, таблетки по 25 мг № 20 («Егіс», Угорщина) — 1 серія; Трихопол, таблетки по 250 мг (ВАТ «Польфарма») — 7 серій; Фталазол (ВАТ «Лубнифарм», Україна) — 1 серія; Хлоргексидину біглюконат, 0,05% розчин (ОФХВП «Біостимулятор», Україна) — 1 серія.
За даними ДІКЯ, серед усіх виявлених за 2000–2002 рр. фальсифікованих ЛЗ 15,8% склали препарати без активних компонентів, 16,8% — з недекларованими компонентами; 44,2% — з правильними компонентами; у 23,2% вміст активних компонентів не відповідав нормі.
І. Пилипенко підкреслила, що при загальному зменшенні (порівняно з минулим роком) кількості виявлених на фармринку серій фальсифікатів кількість упаковок цих ЛЗ, що вилучаються з обігу у 2003 р., зросла більш ніж у 4,5 разу.
Це стало можливим в результаті співробітництва виробників та уповноважених осіб з ДІКЯ МОЗ України та підвищення оперативності її роботи.
Співробітництво ДІКЯ з уповноваженими особами має особливо велике значення для виявлення фальсифікованих ЛЗ. Обов’язки уповноваженої особи полягають у перевірці ліцензії постачальника, сертифікатів якості, відповідності номерів серій ЛЗ вказаним у накладній, порівнянні серії з забороненими до обігу ДІКЯ; візуальному обстеженні упаковки. При виявленні фальсифікованих або субстандартних ЛЗ — їх слід повернути постачальнику або знищити, а про факт їх надходження повідомити територіальну ДІКЯ. При цьому слід зберегти документи, щоб можна було відстежити проведення вказаних дій. І. Пилипенко відзначила, що кількість уповноважених осіб менша, ніж кількість зареєстрованих в Україні аптек та аптечних складів, що вказує на прогалини в системі забезпечення якості ЛЗ.
Заступник Головного державного інспектора України з контролю якості лікарських засобів Сергій Сур зупинився на положеннях Програми боротьби з виробництвом і розповсюдженням фальсифікованих лікарських засобів, метою та основними завданнями якої є:
• захист здоров’я і життя громадян України від шкоди, яку несе застосування фальсифікованих ЛЗ;
• захист економіки держави й легальних виробників від збитків, яких завдає незаконне виробництво та розповсюдження фальсифікованих ЛЗ;
• посилення контролю за якістю ЛЗ;
• створення нормативно-правової бази з питань профілактики злочинності у сфері виробництва та розповсюдження фальсифікованих ЛЗ, яка б передбачала кримінальну та адміністративну відповідальність за ці правопорушення;
• гарантоване забезпечення населення України якісними ЛЗ;
• налагодження співробітництва з міжнародними організаціями, які займаються питаннями запобігання розповсюдження фальсифікованих ЛЗ.
Виконання Програми сприятиме:
• гарантуванню забезпечення населення якісними ЛЗ;
• зниженню ризику для здоров’я та життя громадян, запобіганню нанесенню збитків економіці України;
• впровадженню механізму взаємодії між відповідними органами виконавчої влади для недопущення виробництва та розповсюдження фальсифікованих ЛЗ;
• зменшенню нелегального виробництва і реалізації ЛЗ, що не оподатковуються.
Начальник відділу забезпечення якості робіт ДІКЯ МОЗ України Наталія Гудзь наголосила, що діяльність окремих юридичних осіб — суб’єктів господарської діяльності, які здійснюють оптову або роздрібну торгівлю, та органу державного контролю, яким є ДІКЯ МОЗ України, регулюється нормативними документами. В той же час нормативна база потребує вдосконалення. У зв’язку з цим ДІКЯ МОЗ України підготувала основні положення для проектів документів, що мають бути затверджені Кабінетом Міністрів, МОЗ та іншими держструктурами, зокрема:
• постанови Кабінету Міністрів України «Про забезпечення державного контролю за ввезенням лікарських засобів в Україну, їх подальшим транспортуванням, зберіганням та застосуванням»;
• наказів МОЗ:
• «Про затвердження Порядку визначення вартості здійснення контролю якості лікарських засобів у територіальних ДІКЯ»;
• «Про затвердження Порядку одержання, обліку, зберігання та утримання тест-штамів мікроорганізмів для проведення контролю якості лікарських засобів за мікробіологічними показниками»;
• «Про затвердження Інструкції про правила зберігання та проведення контролю якості лікарських засобів у лікувально-профілактичних закладах»;
• спільного наказу МОЗ/МВС/СБУ/Держкомкордону України про створення робочої групи та міжвідомчої бази даних;
• спільного наказу МОЗ та МВС «Про Порядок вилучення з обігу, конфіскації та знищення фальсифікованих лікарських засобів»,
• а також зміни та доповнення до чинних наказів № 436 та 497.
Як зазначила Н. Гудзь, серед змін і доповнень до наказу МОЗ від 30.10.2001 р. № 436 «Про затвердження Інструкції про порядок контролю якості лікарських засобів під час оптової та роздрібної торгівлі» є уточнення терміна «уповноважена особа». У проекті «уповноважена особа» визначається як посадова особа суб’єкта господарювання, на яку відповідним наказом керівника закладу покладаються обов’язки щодо здійснення вхідного контролю якості ЛЗ, які підлягають оптовій і роздрібній реалізації, а вимоги щодо кваліфікації й освіти уповноваженої особи визначає МОЗ. Крім того, згідно зі змінами до наказу, за результатами вхідного контролю якості уповноважена особа надаватиме письмовий дозвіл на реалізацію певної серії ЛЗ.
ДІКЯ пропонує внести доповнення до визначення терміна «обмежений обіг» (наказ МОЗ України від 12.12.2001 р. № 497 «Про затвердження Порядку заборони (зупинення) та вилучення з обігу лікарських засобів на території України». Обмежений обіг — як обіг ЛЗ, який дозволяється ДІКЯ МОЗ України за певних умов (обмежена кількість, термін). Визначаються також підстави для прийняття ДІКЯ МОЗ України рішення про повернення в обмежений обіг ЛЗ за відповідних висновків державного контролю і вказується, що контроль якості ЛЗ, оцінка ефективності системи контролю якості ЛЗ замовника, консультативні послуги здійснюються на договірних засадах.
Проект Інструкції «Про правила зберігання та проведення контролю якості лікарських засобів у лікувально-профілактичних закладах» передбачає введення посади уповноваженої особи у закладах охорони здоров’я, запровадження єдиних вимог до приміщення, де зберігаються ЛЗ, загальних вимог до організації зберігання і вихідного контролю ЛЗ.
Серед інших доповідей увагу присутніх привернули: «Питання інформаційного забезпечення роботи територіальних державних інспекцій та роботи уповноважених осіб» (Сергій Д’яченко, директор Всеукраїнського інформаційно-фармацевтичного центру); «Проблеми державного контролю крові, її компонентів та препаратів» (Василь Михальчук, начальник Управління первинної медико-санітарної допомоги МОЗ України); «Аспекти та проблемні питання зберігання і відпуску лікарських засобів в аптечних закладах» (Віктор Чумак, заступник директора Державного фармакологічного центру МОЗ України), «Система підвищення кваліфікації і вимоги до рівня знань та умінь уповноважених осіб» (Наталія Ветютнєва, професор, декан медико-профілактичного і фармацевтичного факультету Київської медичної академії післядипломної освіти ім. П.Л. Шупика).
Практично кожна доповідь викликала жваву дискусію. Виступаючі намагалися відповісти на всі запитання учасників семінару, а організатори пообіцяли опублікувати найбільш актуальні доповіді на сторінках спеціалізованих видань. Як повідомив директор ДП «Український науково-дослідний центр фармації» Володимир Соболевський, тема наступного семінару, який відбудеться в грудні 2003 р., «Система ліцензування окремих видів фармацевтичної діяльності. Вимоги до відомостей, що подаються для одержання ліцензій».
Олена Кучерук
Фото Євгена Чорного


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим