В прошедшем году некоторые фармацевтические компании вывели на рынок США потенциальных кандидатов в блокбастеры. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) в 2013 г. одобрило 32 новых лекарственных средства, среди которых преобладают препараты для терапии заболеваний, которые трудно поддаются лечению: вирусный гепатит С, рассеянный склероз, обструктивные заболевания легких, ВИЧ-инфекция, онкологические и другие заболевания. По данным аналитической компании «Evaluate Pharma», объем продаж одобренных FDA в 2013 г. продуктов составит около 18 млрд дол. США, в свою очередь, объем продаж топ-5 одобренных в 2013 г. препаратов через 5 лет после лонча оценивается в 10,1 млрд дол. (таблица).
| Таблица | Топ-5 одобренных в 2013 г. препаратов, а также прогнозируемый объем их продаж в США через 5 лет после лонча |
| № | Препарат | Действующее вещество | Основное показание к применению | Компания | Дата одобрения | Прогнозируемый объем продаж в США в 2018 г., млрд дол. | |
|---|---|---|---|---|---|---|---|
| FDA | EMA | ||||||
| 1 | Sovaldi | Софосбувир | Вирусный гепатит С | Gilead Sciences | 6 декабря | – | 3 |
| 2 | Tecfidera | Диметил фумарат | Рассеянный склероз | Biogen Idec | 27 марта | – | 2,86 |
| 3 | Tivicay | Долутегравир | ВИЧ-инфекция | ViiV Healthcare | 12 августа | – | 1,93 |
| 4 | Breo Ellipta | Флутиказона фуроат + вилантерол | Хроническая обструктивная болезнь легких | GlaxoSmithKline и Theravance | 10 мая | 13 ноября | 1,23 |
| 5 | Anoro Ellipta | Умеклидиниума бромид + вилантерол | Хроническая обструктивная болезнь легких | GlaxoSmithKline и Theravance | 18 декабря | – | 1,08 |
Таким образом, можно проследить устойчивое увеличение объема продаж препаратов через 5 лет после лонча в течение последних 7 лет (рисунок), что может означать повышение продуктивности R&D-разработок для некоторых фармацевтических компаний.
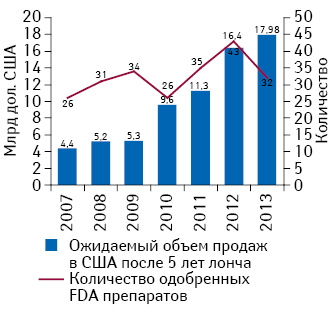
В данной публикации будут представлены характеристика топ-5 препаратов, одобренных FDA в 2013 г., по объему продаж в США, результаты клинических исследований данных продуктов, перспективы на будущее, а также информация о других перспективных препаратах, которые вышли на рынок США в 2013 г.
Sovaldi
Sovaldi отводится особое место среди одобренных в США в 2013 г. продуктов, поскольку действующее вещество данного препарата имеет все шансы стать самой продаваемой новой молекулой 2013 г. Заявки на одобрение этого препарата также поданы в регуляторные органы других стран, а именно стран Евросоюза, Австралии, Новой Зеландии, Швейцарии и Турции. Объем продаж Sovaldi на фармацевтическом рынке США через 5 лет после лонча оценивается почти в 3 млрд дол. Компания «Gilead Sciences Inc.» получила права на данный препарат посредством приобретения компании «Pharmasset».
Sovaldi предназначен для лечения вирусного гепатита С. 22 ноября 2013 г. для терапии данного заболевания был одобрен препарат Olysio (симепревир), разработанный «Janssen Pharmaceuticals» — подразделением компаний «Medivir» и «Johnson & Johnson». По словам представителей FDA, Sovaldi является первым препаратом, который эффективен для лечения некоторых видов вирусного гепатита С без необходимости сочетанного применения интерферона.
Эффективность этого препарата оценивали в 6 клинических исследованиях. В них принимали участие почти 2 тыс. пациентов, которые либо прежде не получали лечения от вирусного гепатита С, либо ранее применяемая у них схема лечения оказалась неэффективной. В клинических исследованиях в том числе принимали участие пациенты с вирусным гепатитом С, ассоциированным с ВИЧ-инфекцией. После применения Sovaldi у больных в течение 12 нед отмечали устойчивый вирусологический ответ.
Кроме того, данный препарат продемонстрировал эффективность у пациентов, не получавших интерферонотерапию, а также у больных раком печени, находящихся в ожидании трансплантации органа.
На Sovaldi возлагают большие надежды как пациенты с вирусным гепатитом С, так и врачи. Поскольку лечение этой патологии довольно сложное и включает комплексную терапию, а также ассоциировано с наличием побочных эффектов, появление препарата Sovaldi связывают с новой вехой в ее лечении.
Tecfidera
27 марта 2013 г. FDA одобрило препарат для лечения рецидивирующих форм рассеянного склероза Tecfidera. Патентное ведомство США предоставило дополнительную патентную защиту на данный препарат сроком на 8 лет. Это уже четвертый патент на Tecfidera. Он покрывает более низкую суточную дозу препарата.
Рассеянный склероз представляет собой хроническое воспалительное аутоиммунное заболевание центральной нервной системы, которое нарушает взаимодействие между мозгом и другими частями тела. Он является одной из причин инвалидизации и чаще выявляется у женщин, чем мужчин. Для большинства больных рассеянным склерозом характерны эпизоды рецидивов и ремиссии заболевания. Со временем периоды ремиссии могут быть неполными, что приводит к прогрессирующему снижению функции головного мозга и нетрудоспособности больного. Пациенты с рассеянным склерозом часто испытывают мышечную слабость, трудности с балансом и координацией движений. У большинства больных отмечают первые симптомы в возрасте 20–40 лет.
Препарат Tecfidera в ходе клинических исследований с участием более 2,5 тыс. пациентов доказал высокую эффективность в снижении важных показателей активности заболевания. Так, результаты исследований свидетельствуют, что применение данного препарата способствует снижению частоты рецидивов рассеянного склероза и препятствует прогрессированию нетрудоспособности. Лекарственное средство продемонстрировало благоприятный профиль безопасности и хорошую переносимость.
Представители аналитической компании «Decision Resources» прогнозируют рост на рынке препаратов для лечения рассеянного склероза до 2018 г. Стабильному росту этого сегмента рынка будет способствовать появление 6 новых препаратов средней ценовой категории, среди которых наиболее популярным, как ожидается, станет Tecfidera. Предполагается, что объем продаж этого препарата в 2018 г. составит 2,86 млрд дол.
Ожидается, что начиная с 2018 г., на рынок лекарственных средств для лечения рассеянного склероза будут выходить генерики, и до 2022 г. объем данного рынка будет уменьшаться ежегодно примерно на 3% в денежном выражении.
Tivicay
Tivicay относится к ингибиторам интегразы ВИЧ, эффективным при развитии у пациента резистентности к другим препаратам. Данный препарат разработан компанией «GlaxoSmithKline», однако маркетируется в США компанией «ViiV Healthcare». Он рекомендуется для применения (1 таблетка в сутки) в составе комплексной терапии с другими антиретровирусными препаратами. Предполагается, что Tivicay будет использоваться как для начального лечения больных, так и для продолжающих его, включая тех, кто уже принимал другие ингибиторы интегразы. Tivicay одобрен для лечения детей в возрасте старше 12 лет, масса тела которых превышает 40 кг, не принимавших ранее другие ингибиторы интегразы.
Эффективность и профиль безопасности препарата изучали в ходе 4 фаз клинических исследований, в которых приняли участие 2,54 тыс. пациентов. В ходе исследований сравнивали эффект приема Tivicay с другим ингибитором интегразы — Issentress (ралтегравир) компании «Merck & Co», а также комбинированным препаратом — Atripla (эфавиренц + тенофовир + эмтрицитабин) компании «Gilead Sciences». Tivicay продемонстрировал эффективность в снижении вирусной нагрузки. Также в ходе клинических исследований установлены особенности фармакокинетики Tivicay, его профиль безопасности и эффективность в отношении лечения детей в возрасте старше 12 лет.
До одобрения Tivicay последним допущенным на рынок США антиретровирусным препаратом был Stribild (элвитегравир + кобицистат + эмтрицитабин + тенофовир) компании «Gilead Sciences», получивший одобрение FDA в августе 2012 г. Ранее FDA одобрило другое детище компании — Truvada (тенофовир + эмтрицитабин), первый препарат, предназначенный для профилактики ВИЧ-инфекции.
Согласно данным аналитической компании «EvaluatePharma» объем продаж препарата Tivicay в США в 2018 г. оценивается в 1,93 млрд дол.
Breo Ellipta
10 мая 2013 г. FDA одобрило ингалятор Breo Ellipta (применение 1 раз в сутки) для долгосрочного лечения и поддерживающей терапии бронхиальной обструкции при хронической обструктивной болезни легких (ХОБЛ), а также у больных хроническими бронхитами и/или эмфиземой. Препарат также одобрен для снижения частоты обострений ХОБЛ у больных с таковыми в анамнезе, однако регуляторные органы США, в отличие от таковых в ЕС, не одобрили применение данного препарата у пациентов с астмой.
Профиль безопасности и эффективность данного средства оценивали в исследовании с участием 7,7 тыс. пациентов с диагнозом ХОБЛ. Доказано, что Breo Ellipta уменьшает выраженность воспалительных изменений в легких и способствует расслаблению мышц дыхательных путей, а также увеличивает легочную вентиляцию и снижает частоту обострений у пациентов с ХОБЛ. Наличие новой долгосрочной поддерживающей терапии дает дополнительные возможности для лечения миллионов лиц с ХОБЛ.
По данным компании «EvaluatePharma», ожидается, что в 2018 г. объем продаж Breo Ellipta в США достигнет 1,23 млрд дол.
Компании «GlaxoSmithKline» и «Theravance», разработавшиеBreo Ellipta, подали заявку на одобрение комбинированной терапии в регуляторные органы ЕС в 2012 г. для маркетирования данного препарата под торговым наименованием Relvar Ellipta. В итоге, 19 сентября 2013 г. Комитет по лекарственным препаратам (Committee for Medicinal Products for Human Use — CHMP) Европейского агентства по лекарственным средствам (European Medicines Agency — EMA) принял положительное решение относительно применения данного препарата и рекомендовал его для предоставления лицензии на маркетирование.
Так, в ноябре 2013 г. EMA одобрило маркетирование Relvar Ellipta на территории ЕС для терапии взрослых и детей в возрасте старше 12 лет с ХОБЛ, а также больных, у которых астма плохо поддается лечению ингалируемыми кортикостероидами и агонистами бета-адренорецепторов быстрого действия.
Одобрение базировалось на результатах 11 клинических исследований с участием 7,85 тыс. пациентов с ХОБЛ и 16 исследований с участием 9,33 тыс. больных астмой. Компания предлагает использовать 2 дозировки препарата для лечения астмы и 1 — для лечения ХОБЛ. Представители компании «GlaxoSmithKline» отметили, что они рады тому, что эксперты регуляторных органов ЕС находят препарат эффективным в лечении астмы.
Anoro Ellipta
18 декабря 2013 г. FDA одобрило ингалятор Anoro Ellipta в качестве поддерживающей терапии с применением 1 раз в сутки для лечения больных с ХОБЛ, а также с хроническим бронхитом и/или эмфиземой. Компании «GlaxoSmithKline» и «Theravance»подали заявку на одобрение данного препарата в регуляторные органы ЕС.
Около 6 тыс. пациентов с ХОБЛ приняли участие в III фазе разработки препарата, которая включала 7 клинических исследований. В свою очередь, профиль безопасности и эффективность нового лекарственного средства изучали в исследовании с участием более 2,4 тыс. пациентов с ХОБЛ. В результате лечения отмечено улучшение функции легких у больных после применения Anoro Ellipta по сравнению с плацебо. Вместе с тем, не доказаны профиль безопасности и эффективность Anoro Ellipta в лечении пациентов с астмой, данное лекарственное средство не одобрено для терапии астмы, а также острого бронхоспазма.
По данным компании «EvaluatePharma», ожидается, что объем продаж данного препарата в США в 2018 г. достигнет отметки 1,08 млрд дол.
Другие препараты
Среди одобренных FDA в 2013 г. препаратов также можно выделить Kadcyla (адо-трастузумаба эмтанзин) компании «Roche», Gazyva (обинутузумаб) компаний «Roche» и «Biogen Idec», Xofigo (радий Ra-223 дихлорид) компаний «Bayer» и «Algeta», Adempas (риоцигуат) компании «Bayer» и Pomalyst (помалидомид) компании «Celgene».
Kadcyla предназначен для лечения рака молочной железы. Препарат одобрен FDA в ноябре 2013 г. По данным компании «EvaluatePharma», объем продаж данного препарата в США в 2018 г. достигнет 925 млн дол.
В ноябре 2013 г. одобрен препарат Gazyva для лечения хронического лейкоцитарного лейкоза. По прогнозам, объем продаж данного препарата в 2018 г. составит 809 млн дол.
В мае 2013 г. FDA одобрило препарат для лечения рака предстательной железы Xofigo. Ожидается, что объем продаж данного препарата в 2018 г. составит 723 млн дол.
Препарат Adempas для лечения легочной артериальной гипертензии и хронической тромбоэмболической легочной гипертензии одобрен FDA в октябре 2013 г. По данным компании «EvaluatePharma», объем его продаж в 2018 г. составит 681 млн дол.
Препарат Pomalyst одобрен FDA в феврале 2013 г. Ожидается, что объем продаж данного лекарственного средства в 2018 г. достигнет 678 млн дол. Pomalyst предназначен для лечения миеломы.
В свою очередь, CHMP в 2013 г. рекомендовал одобрить 81 кандидат в препараты.
P.S.
Ежегодно регуляторными органами различных стран одобряется широкий спектр новых лекарственных средств. Стоит отметить, что одобрение регуляторных органов часто получают препараты для лечения редких и трудно поддающихся лечению заболеваний.
Производители оригинальных препаратов вкладывают значительные средства в поиск новых молекул, их исследования, выведения на рынок и тщательного мониторинга возможных неблагоприятных эффектов и взаимодействия этих препаратов.
Также необходимо учитывать, что от начала тестирования новой молекулы до появления лекарственного средства на рынке может пройти 10–15 лет. При этом производитель оригинального препарата имеет в своем распоряжении в среднем до 5 лет на компенсацию издержек и получение прибыли от оригинального препарата. К концу этого срока, как правило, производители предпринимают попытки продлить срок патентной защиты.
Таким образом, в то время как мировая фармацевтическая отрасль приходит в себя после патентного обвала 2012 г., увеличение количества лончей одобренных препаратов для многих фармацевтических компаний может стать возможностью получить в свой продуктовый портфель блокбастеры с целью компенсации средств, вложенных в R&D-разработки, и получения дохода от продаж данных продуктов.
www.biogenidec.com,
www.gsk.com,
www.viivhealthcare.com,
www.decisionresources.com,
www.evaluategroup.com,
www.fda.gov,
www.ema.europa.eu

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим