Загальновизнано, що неправильне застосування ЛЗ може призвести до тяжких, а інколи фатальних наслідків. З огляду на це, у сфері обігу ЛЗ введено національні закони, спрямовані на зниження ризику, зумовленого неправильним застосуванням і зловживаннями під час реалізації ЛЗ. Контроль за дотриманням вимог законодавства щодо якості ЛЗ під час їх виробництва, зберігання, торгівлі, транспортування і медичного застосування входить до компетенції Державної інспекції з контролю якості лікарських засобів МОЗ України та підпорядкованих їй державних інспекцій в АР Крим, областях, містах Києві та Севастополі. Забезпечення контролю здійснюється через систему інспекційних перевірок. У цій публікації пропонуються деякі дані, взяті з доповіді начальника відділу з контролю за виробництвом, оптовою і роздрібною реалізацією лікарських засобів (ДІКЯ ЛЗ) Владислава Онищенка, станом на I квартал 2002 р., що стосуються основних порушень, виявлених під час перевірок.
Вимоги стосовно забезпечення якості ЛЗ у процесі виробництва наведені у відповідних документах з безпеки та якості фармацевтичної продукції (вимоги GMP). Якість ЛЗ не може бути контрольованою тільки під час випробувань готової продукції в лабораторіях з контролю якості. Необхідної якості ЛЗ потрібно дотримуватися в усій системі постачання фармацевтичної продукції чи дистриб’юторській мережі, що визначається правилами фармацевтичної науки, національними нормами та правилами. Основні положення, які регламентують порядок проведення вхідного контролю якості ЛЗ суб’єктами господарської діяльності, які мають ліцензії на право здійснення оптової та роздрібної торгівлі ЛЗ, та державного контролю якості ЛЗ під час цієї діяльності, викладено в наказі МОЗ України від 30.10.2001 р. № 436 «Про затвердження Інструкції про порядок контролю якості лікарських засобів під час оптової та роздрібної торгівлі» («Щотижневик АПТЕКА», № 6 (327) від 11 лютого 2002 р.). Під час оптової та роздрібної торгівлі ЛЗ державний контроль якості здійснюють Державна інспекцієя з контролю якості (ДІКЯ) ЛЗ МОЗ України, державні інспекції з контролю якості ЛЗ в АР Крим, областях, містах Києві та Севастополі, підпорядковані їм лабораторії, а також лабораторії, акредитовані ДІКЯ.
Згідно з рекомендаціямим ВООЗ, всеосяжна система забезпечення безпеки, ефективності та якості фармацевтичної продукції на національному рівні включає такі елементи:
Правові
• законодавство у сфері ЛЗ.
Адміністративні
• регуляторний орган у сфері ЛЗ з функціями реєстрації продукції, ліцензування виробників, імпортерів і дистриб’юторів (оптових і роздрібних), контроль та незалежне тестування зразків;
•? примусове здійснення контролю.
Технічні
•? діяльність керівництва суб’єкта господарювання;
• нормативна документація;
• норми та правила;
• незалежна лабораторія контролю якості.
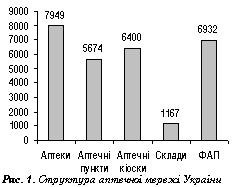
Сьогодні в Україні діяльність, пов’язану з обігом ЛЗ, здійснюють понад 5 тис. суб’єктів господарювання — юридичних осіб, що налічує близько 1200 складів, 8000 аптек, 12 000 структурних підрозділів аптек та 7000 фельдшерсько-акушерських пунктів (ФАП), які ще функціонують на цей час (рис. 1).
?
 |
ДІКЯ ЛЗ МОЗ України забезпечує відсутність у системі постачання фармацевтичної продукції фальсифікованих і субстандартних ЛЗ, а також дотримання пунктами та уповноваженими особами, що здійснюють діяльність у сфері обігу ЛЗ, вимог законодавства. До порушників законодавства державними інспекціями з контролю якості ЛЗ вживаються адміністративні заходи, їм надають обов’язкові до виконання приписи. В одних випадках матеріали перевірок передаються до органу ліцензування для вирішення питання подальшої дії ліцензії, в інших — до правоохоронних органів залежно від рівня виявлених порушень. Перевірку установ проводили з метою
• забезпечення захисту громадян від зловживань дистриб’юторів та постачальників ЛЗ;
• забезпечення дотримання законодавства і нормативних актів, які регулюють виготовлення, дистриб’юцію та зберігання ЛЗ;
• забезпечення високих етичних та професійних стандартів фармацевтичної практики.
Сьогодні ДІКЯ у своїй діяльності керується рекомендаціями ВООЗ, які передбачають такі різновиди перевірок:
•?Повний (стандартний) контроль — передбачається у разі появи нової фармацевтичної установи або, коли установа звертається за дозволом розширити сферу діяльності понад межі, на які має ліцензію. Такий тип перевірки передбачений і в разі здійснення кадрових змін в адміністративній структурі закладу, зміни приміщення закладу або перевищення терміну 3 роки з часу останньої перевірки. Проводити контроль у повному обсязі необхідно в тому разі, якщо є інформація (навіть неофіційна) про серйозні недоліки в роботі суб’єкта господарювання.
•?Коротка перевірка. Передбачається для закладів, діяльність яких раніше перевірялася, з метою оцінки якості ЛЗ та стандартів належної фармацевтичної практики. Можна проводити без попередження.
•?Наступна перевірка. Контроль вжитих заходів з усунення недоліків, що стосуються зауважень чи рекомендацій, висунутих під час попередньої перевірки. Якщо для усунення недоліків було встановлено відповідний термін, цю перевірку здійснюють без попередження.
•?Спеціальна перевірка. Проводиться за конкретними скаргами стосовно недоліків та недотримання професійних стандартів фармацевтичної практики, а також для контролю продукту, що оцінюється з метою реєстрації. Цю перевірку бажано проводити без попередження.
•?Частота перевірок. Приміщення мають перевірятися не рідше одного разу на 12–18 міс. У разі систематичного виявлення порушень або постійного надходження інформації про недоліки перевірки таких установ мають здійснюватися частіше.
Несанкціоновані ринки для дистриб’юції ЛЗ створюють серйозну загрозу здоров’ю та справі, яку ведуть добросовісні оператори фармацевтичного ринку. Інспектори (інколи із залученням груп фахівців) досліджують обсяги несанкціонованих ринків, групи ЛЗ, що надходять та поширюються на цих ринках, джерела надходження. Несанкціонований обіг ЛЗ по можливості забороняється шляхом ефективної діяльності інспекції спільно з правоохоронними органами. Інспектори виявляють також джерела і шляхи надходження підозрілих, фальсифікованих та субстандартних ЛЗ.
У разі надходження ЛЗ від виробника до дистриб’юторів і далі до споживача повинна вестися відповідна облікова документація:
• назва та адреса дистриб’ютора з підтвердженням про наявність ліцензії;
• найменування ЛЗ та його реєстраційне посвідчення, опис форми, дози та вираженості дії;
• кількість кожного ЛЗ в партії та номер його серії;
• дата виробництва і термін придатності ЛЗ кожної серії;
• номер і дата замовлення на поставку;
• дата поставки.
Такий облік також має здійснюватися оптовими та роздрібними торговцями. Виробники, дистриб’ютори та особи, які займаються оптовою реалізацією, повинні мати таку документацію:
• про порядок вилучення фармацевтичної продукції з ринку;
• про встановлений порядок роботи зі скаргами щодо якості продукції і небажані реакції, зумовлені дією ЛЗ;
• про встановлений порядок щодо повернутої продукції, термін придатності якої минув, фальсифікованої продукції тощо.
Оскільки головною турботою оптового та роздрібного постачальника фармацевтичної продукції має бути благополуччя громадян, яких вони обслуговують, то ні в якому разі не потрібно здійснювати поставки ЛЗ, якщо є будь-які підстави сумніватися щодо їх безпеки, ефективності та якості. Недотримання більшістю оптових і роздрібних структур України елементарних вимог до фармацевтичної діяльності, не тільки загрожує здоров’ю населення, а й негативно впливає на репутацію провідних вітчизняних і світових виробників ЛЗ. Оптові та роздрібні постачальники фармацевтичної продукції повинні вжити заходи, спрямовані на те, щоб упевнитися, що джерела надходження ЛЗ мають добру репутацію, насправді існують і що ЛЗ не матиме негативного впливу на здоров’я споживача.
Варто зазначити, що наказом МОЗ України від 19 березня 2002 р. № 103 затверджено Настанову 42-01-2002 «Лікарські засоби. Належна практика дистриб’юції». Оператори ринку отримали дієвий інструмент для створення системи забезпечення якості дистриб’юторської практики. Зрозуміло, що для цього потрібен певний час, тому на сьогодні дистриб’юторські компанії можуть добровільно керуватися положеннями Настанови під час проведення сертифікації.
Нещодавно ДІКЯ ЛЗ МОЗ України, було проведено аналіз роботи суб’єктів фармацевтичної діяльності, який дав змогу виявити і з’ясувати причини погіршення якості ЛЗ. Унаслідок аналізу даних, отриманих під час перевірок аптечних складів, аптек, аптечних пунктів, кіосків та лікувально-профілактичних закладів (ЛПЗ) (рис. 2–6) виявлено ряд порушень.
 |
 |
 |
 |
 |
|
* Заборонені до реалізації приписами ДІКЯ; за візуальними показниками не відповідають вимогам аналітично-нормативної документації (АНД), ЛЗ, термін придатності яких минув; незареєстровані ЛЗ. |
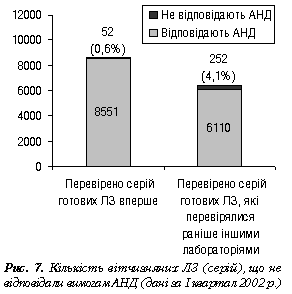
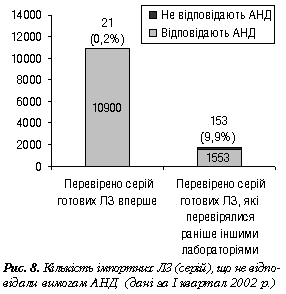
Наведені дані свідчать про те, що якість ЛЗ вірогідно змінюється у процесі їх оптової та роздрібної реалізації. Мабуть, це зумовлено насамперед недотриманням санітарних і гігієнічних нормативів та умов зберігання ЛЗ значною кількістю суб’єктів фармацевтичного ринку, які зберігають та реалізують лікарські препарати. На підтвердження цього цікавою буде інформація стосовно кількості вітчизняних та імпортних ЛЗ, якість яких погіршується у процесі дистриб’юції (рис. 7, 8).
 |
|
Стає зрозумілим давно відоме правило: у разі дотримання вимог належного обігу ЛЗ на етапах дистриб’юції та роздрібної торгівлі, знизиться ймовірність погіршення якості, а також продажу неякісних та заборонених до реалізації ЛЗ. Мета ДІКЯ ЛЗ — сприяти зменшенню зловживань з боку суб’єктів господарювання, діяльність яких пов’язана з обігом ЛЗ. Крім здійснення контрольних функцій, ДІКЯ надає консультативну допомогу операторам фармацевтичного ринку.
Максим Плошенко

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим