 Со вступлением в силу технических регламентов для всех медицинских изделий зарубежного производства необходимо назначить Уполномоченного представителя, который является резидентом Украины или зарегистрирован в соответствии с законодательством Украины. При беглом просмотре технических регламентов становится понятно, что Уполномоченный представитель получает ряд прав и обязанностей, и его наименование и адрес должны быть указаны на маркировке либо в инструкции. Более подробно о функциях, ответственности, правах и обязанностях Уполномоченного представителя расскажут сотрудники компании «Кратия».
Со вступлением в силу технических регламентов для всех медицинских изделий зарубежного производства необходимо назначить Уполномоченного представителя, который является резидентом Украины или зарегистрирован в соответствии с законодательством Украины. При беглом просмотре технических регламентов становится понятно, что Уполномоченный представитель получает ряд прав и обязанностей, и его наименование и адрес должны быть указаны на маркировке либо в инструкции. Более подробно о функциях, ответственности, правах и обязанностях Уполномоченного представителя расскажут сотрудники компании «Кратия». |
 |
| Ольга ПУШЕНКО | Николай РОМАНЁК |
Нормы украинского законодательства устанавливают право потребителя обратиться в суд, правоохранительные органы или органы рыночного надзора при появлении каких-либо вопросов в отношении качества и безопасности медицинских изделий, а также самостоятельно защитить свои права, обратившись непосредственно к производителю. Возникает вопрос относительно адресата подобного обращения, если производитель — зарубежная компания, и эффективности выдвижения каких-либо требований/претензий к производителю. Не стоит также забывать о возможных языковых барьерах в коммуникации.
Технические регламенты предусматривают понятие «Уполномоченный представитель» с целью решения вышеуказанных проблем.
Уполномоченный представитель — любое юридическое лицо или физическое лицо — предприниматель — резидент Украины или зарегистрированное в соответствии с законодательством Украины представительство зарубежного субъекта хозяйствования, имеющий надлежащим образом подтвержденные полномочия от производителя для выполнения обязанностей, установленных техническими регламентами.
Если производителем медицинских изделий является зарубежная компания, она обязана назначить на территории Украины Уполномоченного представителя — резидента Украины.
Уполномоченный представитель выполняет ряд специальных функций и, по сути, является связующим звеном между производителем и потребителями, а также органами рыночного надзора, оценки соответствия, фискальными, правоохранительными и др.
Директивы Евросоюза относительно медицинских изделий, на основании которых были разработаны технические регламенты, так же как и украинское законодательство, не описывают достаточно подробно роль и обязанности, возлагаемые на Уполномоченного представителя. Европейская система оценки соответствия, в отличие от национальной, предполагает использование ряда нормативной документации (MEDDEV, Решения ЕС), которая объясняет многие вопросы, не нашедшие отражения в национальных нормативно-правовых актах.
Отечественное законодательство в сфере обращения медицинских изделий в рамках гармонизации с законодательством ЕС подвергается постоянным корректировкам, доработкам и изменениям. При этом существует масса вопросов, которые на сегодня нормативно не закреплены в Украине. В связи с этим целесообразно изучить опыт и законодательство ЕС и заранее использовать при осуществлении процедуры оценки соответствия как основу для принятия решений.
Руководящие принципы ЕС относительно роли Уполномоченного представителя отражены в MEDDEV 2.5/10 «Guideline for authorised representatives» (Руководство для уполномоченных представителей).
Целью данного руководства является описание принципов ответственности Уполномоченных представителей, а также раскрытие порядка взаимодействия с органами рыночного надзора. С текстом данного документа можно ознакомиться, перейдя по ссылке http://www.meddev.info.
Назначение и функции Уполномоченного представителя
Выбор и назначение Уполномоченного представителя в Украине является концептуальным моментом для производителя. Уполномоченный представитель должен иметь достаточный уровень знаний и компетенции для выполнения обязательств, которые возлагаются национальным законодательством. Производителю необходимо информировать Уполномоченного представителя обо всех изменениях, касающихся изделий, находящихся на рынке Украины. Назначение Уполномоченного представителя никоим образом не изменяет степень ответственности производителя в отношении продукта.
В частности, на плечи Уполномоченного представителя возлагается ведение постмаркетинговой стадии совместно с производителем. То есть Уполномоченный представитель должен быть осведомлен обо всех поставках соответствующих изделий на территорию Украины и иметь доступ к документации производителя при необходимости.
В национальном законодательстве не отражено, на каком этапе процедуры оценки соответствия назначается Уполномоченный представитель. Однако при введении в обращение медицинских изделий на маркировке продукции должно быть указано наименование и местонахождение Уполномоченного представителя в случае, если производитель не является резидентом Украины. Следовательно, можно сделать вывод, что Уполномоченный представитель должен быть назначен до окончания процедуры оценки соответствия  .
.
Согласно требованиям соответствующих технических регламентов наименование Уполномоченного представителя должно быть указано на маркировке. Европейцы, как правило, используют следующий символ. При этом действующий в Украине нормативный документ ДСТУ EN 980:2007 «Символы графические для маркировки медицинских изделий», который включен в перечень стандартов под соответствующий технический регламент, не содержит аналогичного символа для Украины (рисунок).
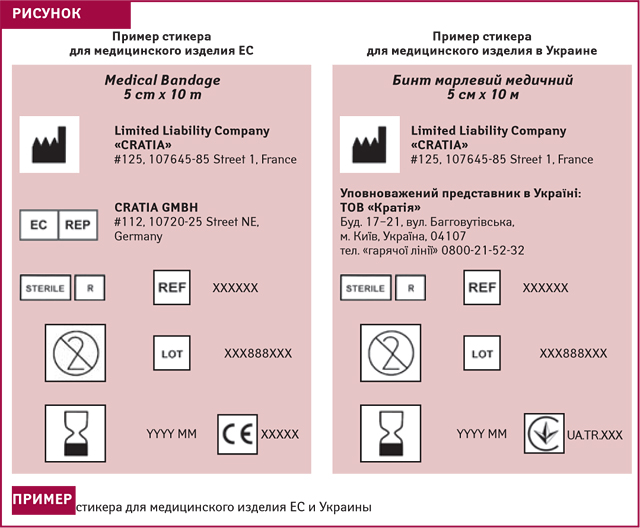
Как в украинском законодательстве, так и в европейском, можно найти ссылки-подтверждения тех или иных функций, которые возлагаются на Уполномоченного представителя. Некоторые из них представлены в таблице ниже.
| Таблица | Ссылки-подтверждения функций, которые возлагаются на Уполномоченного представителя |
| Суть требования законодательства относительно действий Уполномоченного представителя | Регуляторная норма |
| Размещение наименования и местонахождения на этикетке или внешней упаковке, или в инструкции по применению | П. 44 Приложения 1 к Постановлению КМУ от 02.10.2013 г. № 753: «Этикетка медицинского изделия должна содержать следующие элементы: 1) наименование или торговую марку и местонахождение производителя. Для медицинских изделий, импортируемых с целью введения в обращение, на этикетке или внешней упаковке, или в инструкции по применению дополнительно указывается наименование и местонахождение уполномоченного представителя, если производитель не является резидентом Украины» |
| Хранение и предоставление документации в компетентные органы, объем которой предусмотрен соответствующими приложениями к техническим регламентам относительно медицинских изделий | П. 16 Приложения 3 Постановления КМУ № 753: «16. Производитель или его уполномоченный представитель в течение не менее пяти лет, а для медицинских изделий, которые имплантируют, — не менее пятнадцати лет с момента изготовления последнего медицинского изделия должен хранить для предоставления в случае необходимости органам рыночного надзора: декларацию о соответствии; документацию по системе управления качеством, указанную в пункте 3 настоящего приложения, а также документы, данные и записи, касающиеся процедур мониторинга и проверки проектирования медицинских изделий согласно подпункту 3 пункта 5 настоящего приложения; изменения, указанные в пункте 7 настоящего приложения; документацию, указанную в пункте 9 настоящего приложения; решения и отчеты органов по оценке соответствия, указанные в пунктах 6, 10, 11, 14 и 15 указанного Приложения» |
| Инициация запрета реализации продукции, а также ввода в эксплуатацию соответствующих медицинских изделий по согласованию с производителем | Подпункт g части A.1.5. MEDDEV 2,5/10 «Руководство для Уполномоченных представителей»: g) Решения в отношении запрета или ограничения реализации Любое решение, принятое в соответствии с этой директивой (а) запрет или ограничение размещения на рынке или ввод в эксплуатацию медицинского изделия, или (б) приостановка продаж изделия, должны быть мотивированы точными причинами, на которых оно основано. О таких решениях без промедления необходимо уведомлять производителя или его Уполномоченного представителя |
| Доступ ко всей документации и информации касательно медицинских изделий, относительно которых Уполномоченный представитель был назначен, в случае, если производителем принято решение по хранению документации Уполномоченным представителем | Подпункт а части A.1.5. MEDDEV 2.5/10 «Руководство для Уполномоченных представителей»: Если производитель принимает решение не хранить информацию у Уполномоченного представителя, он обязан предоставить Уполномоченному представителю доступ ко всей документации и информации, которая может быть востребована органами рыночного надзора. При получении запроса Уполномоченный представитель направляет информацию производителю. Уполномоченные представители должны иметь доступ ко всей документации и информации. В этом случае договор должен обязать производителя своевременно предоставлять запрашиваемую Уполномоченным представителем информацию, а также незамедлительно уведомлять Уполномоченного представителя о любых изменениях, касающихся изделия и порядка его использования |
| Инициация начала проведения ряда процедур оценки соответствия | П. 21 Технического регламента относительно медицинских изделий, утвержденного постановлением КМУ № 753: «Производитель может поручить своему уполномоченному представителю инициировать проведение процедур, предусмотренных в приложениях 4, 5, 8 и 9» |
| Принятие решения относительно выбора органа по оценке соответствия, в случае если категория/класс медицинского изделия предполагает привлечение такого органа для проведения процедуры | П. 22 Постановления КМУ № 753: «Если процедура оценки соответствия предусматривает привлечение органа по оценке соответствия, производитель или его уполномоченный представитель могут обратиться в такой орган по его выбору в рамках задач, для выполнения которых такой орган был назначен» |
| Уведомление регуляторного органа о намерении проведения клинических исследований | П. 32. Постановления КМУ № 753: «В случае выпуска медицинских изделий, предназначенных для клинических исследований, производитель или его уполномоченный представитель, зарегистрированный в Украине, обязаны соблюдать процедуры, указанные в приложении 9, и сообщить об этом Государственной службе Украины по лекарственным средствам (далее — Гослекслужба) путем подачи заявления» (требования по заполнению установлены в пункте 2 приложения 9) |
| Предоставление документации для подтверждения соответствия продукции требованиям технического регламента относительно медицинских изделий | П. 23 Постановления КМУ № 753: «Орган по оценке соответствия может (при условии надлежащего обоснования) отправить производителю или его уполномоченному представителю запрос на предоставление любой информации или данных, необходимых для установления или подтверждения соответствия изделия требованиям настоящего Технического регламента в соответствии с выбранной процедурой оценки соответствия» |
| Инициация начала проведения клинических исследований | П. 32 Постановления КМУ № 753: «В случае выпуска медицинских изделий, предназначенных для клинических исследований, производитель или его уполномоченный представитель, зарегистрированный в Украине, должны соблюдать процедуры, указанные в приложении 9, и сообщить об этом Гослекслужбе путем подачи заявления» (требования по заполнению установлены в пункте 2 приложения 9) |
| Доступ ко всей документации и информации касательно медицинских изделий, относительно которых Уполномоченный представитель был назначен, в случае, если производителем принято решение по хранению документации Уполномоченным представителем | Подпункт а части A.1.5. MEDDEV 2.5/10 «Руководство для Уполномоченных представителей»: Если производитель принимает решение не хранить информацию у Уполномоченного представителя, он обязан предоставить Уполномоченному представителю доступ ко всей документации и информации, которая может быть востребована органами рыночного надзора. При получении запроса Уполномоченный представитель направляет информацию производителю. Уполномоченные представители должны иметь доступ ко всей документации и информации. В этом случае договор должен обязать производителя своевременно предоставлять запрашиваемую Уполномоченным представителем информацию, а также незамедлительно уведомлять Уполномоченного представителя о любых изменениях, касающихся изделия и порядка его использования |
Документация, которая должна храниться у Уполномоченного представителя
Объем необходимой документации, которую следует хранить Уполномоченному представителю на территории Украины, определен техническими регламентами.
Следует отметить, что перечень документации, которую необходимо хранить Уполномоченному представителю, для изделий всех классов потенциального риска использования практически идентичен.
Проанализировав европейское и национальное законодательство, мы составили ориентировочный перечень.
Требования, отраженные в Приложении 3 Постановления КМУ № 753:
- договор/доверенность относительно назначения Уполномоченного представителя;
- копия декларации соответствия;
- копия этикетки, упаковки и инструкции по использованию;
- описание изделия, в том числе, запланированных модификаций, а также его предусмотренное применение;
- краткий отчет относительно результатов анализа рисков;
- информация о применяемых стандартах;
- краткий отчет относительно доклинического оценивания;
- краткий отчет относительно клинической оценки;
- документация, подтверждающая соответствие изделия основным требованиям технических регламентов (чек-лист);
- подтверждение относительно содержания как неотъемлемой части веществ или производных крови человека; результаты проведенных в связи с этим испытаний (при наличии);
- документация относительно системы управления качеством: руководство по качеству (Quality management system, QMS), методики/процедуры/SOP и т.д.;
- сертификаты, решения, которые выданы назначенными органами по результатам проведения процедуры оценки соответствия.
В соответствии с процедурой «самодекларирования»:
- документ (договор/контракт), подтверждающий полномочия физического или юридического лица выступать в роли Уполномоченного представителя касательно того или иного продукта;
- декларация соответствия;
- копия этикетки, упаковки;
- инструкции по применению;
- документация, подтверждающая соответствие изделия основным требованиям технического регламента (чек-лист);
- описание изделия, в том числе запланированных модификаций, а также его предусмотренное применение;
- документация относительно постмаркетинговой стадии (результаты процесса наблюдения за рынком: инциденты, жалобы, нежелательные явления, побочные эффекты и т.п.; всевозможные отчеты по устранению тех или иных изъянов (краткий отчет относительно доклинического оценивания), процессов, влияющих на качество и безопасность продукции, информация о корректирующих действиях (краткий отчет относительно результатов анализа рисков) и т. д.);
- клинические данные;
- сведения о субъектах хозяйствования (производитель, Уполномоченный представитель, импортер, распространитель) относительно соответствующего медицинского изделия;
- руководство по качеству (QMS);
- сертификаты, решения, которые выданы назначенными органами по результатам проведения соответствующей процедуры оценки соответствия.
Перечисленная выше документация является той минимально достаточной частью технической документации на медицинское изделие, которая определяет ключевые понятия: что собой представляет данное изделие, каково его функциональное назначение и т.д., а также является базой для взаимодействия с компетентными органами.
При этом следует подчеркнуть, что некоторая документация может изменяться на протяжении жизненного цикла продукции, поэтому очень важно обращать внимание на ее актуальность.
Договор о назначении Уполномоченного представителя
В связи с тем, что технические регламенты относительно медицинских изделий не включают подробного описания роли и обязанностей Уполномоченного представителя, как для производителя, так и для Уполномоченного представителя необходимо заключить договор с четким описанием функций, которые производитель делегирует Уполномоченному представителю.
Для делегирования полномочий достаточно подписания и нотариального заверения доверенности. Но, на наш взгляд, дополнительно к доверенности необходимо заключение договора, в котором более точно могли бы быть урегулированы права, обязанности и функции обеих сторон, вопросы ответственности Уполномоченного представителя и производителя в отношении:
- сроков и порядка взаимных коммуникаций;
- сервисных функций;
- технической и медицинской поддержки;
- порядка работы с рекламациями и сообщениями о нежелательных явлениях;
- порядка осуществления постмаркетингового надзора;
- правовых аспектов взаимоотношений и реакции обеих сторон вследствие изменений законодательства;
- актуальности, объемов хранения, предоставления, конфиденциальности и т.д. документации и информации об изделии;
- решения относительно отказа, запрета, временного приостановления введения в обращение продукции, а также возможной необходимости утилизации;
- механизма взаимодействия с потребителем (например в части изменений в инструкции по применению);
- проведения расследований по фактам возникновения неблагоприятных ситуаций (примером может стать выявление брака партии продукции по причине нарушений условия хранений);
- осуществления одной или другой стороной маркировки продукции в соответствии с национальными требованиями;
- полномочий по регистрации цен и т.д.
Заключая договор о назначении Уполномоченного представителя, важным моментом является не только соблюдение всех существенных условий национального законодательства к составлению подобных договоров.
Не следует забывать и о роли всех субъектов хозяйствования, участвующих в цепи поставки. Уполномоченный представитель является лишь звеном и должен тесно сотрудничать не только с производителем, но и с импортерами и распространителями. Поскольку согласно определению, приведенному в новом Законе Украины «О технических регламентах и оценке соответствия», — «…субъекты хозяйствования — производитель, Уполномоченный представитель, импортер и распространитель…».
Зачастую производители практикуют разделение полномочия торговых компаний и Уполномоченных представителей, ответственных за регуляторные и юридические вопросы. Разделение функций позволяет ограничить возможные злоупотребления, которые потенциально могут привести к недобросовестной конкуренции среди распространителей продукции.
Перед заключением договора следует учитывать все особенности деятельности Уполномоченного представителя и возможные подводные камни с целью четкого разделения ответственности в будущем.
Как правило, даже определения всех прямых обязанностей/прав Уполномоченного представителя в договоре недостаточно для обеспечения полной гарантии безопасности предоставления услуги.
Очень важным моментом является то, что Закон Украины «Об общей безопасности непищевой продукции» приравнивает Уполномоченного представителя к производителю. Уполномоченный представитель принимает на себя «первую волну» претензий, которую должен «выдержать» до момента перехода ответственности в порядке регресса к фактическому производителю.
Для этого рекомендуется осуществлять страхование ответственности. Такая страховка сможет покрыть расходы на непредвиденные обстоятельства в будущем, связанные не только с качеством продукции, но и с возможным недостаточным уровнем профессионализма сотрудников, выполняющих действия от имени Уполномоченного представителя.
Страхование ответственности вместе с правильно составленным договором является частью механизма регресса, что означает обратное требование о возмещении уплаченной суммы, предъявленной одним юридическим лицом другому обязанному лицу.
Нецелесообразно также переносить разрешение споров касательно деятельности Уполномоченного представителя в Украине в иную юрисдикцию, поскольку его действия прямо регулируются национальным законодательством. Исключением могут быть коммерческие вопросы, вопросы компенсации, порядочности и этики взаимоотношений между сторонами.
Еще одним важным примером может стать вопрос относительно правильного проведения постмаркетингового надзора, который предполагает сбор всех данных (рекламаций, претензий, жалоб, наблюдений) относительно качества и безопасности введенного в обращение продукта.
Согласно с требованиями стандарта ISO 13485 производитель должен соблюдать все необходимые задокументированные процедуры, в частности, относительно разработанных порядков/методик/SOP и имеющихся и отработанных у производителя механизмов по проведению постмаркетингового надзора.
Поэтому перед началом выполнения функций Уполномоченному представителю необходимо ознакомиться с такого рода документацией системы управления качеством, а также уточнить необходимость и обязательность применения.
Это поможет как Уполномоченному представителю, так и производителю правильно и эффективно задействовать инструменты управления качеством на протяжении всего жизненного цикла медицинского изделия.
Вывод
Уполномоченный представитель является связующим звеном между производителем, всеми участниками цепи реализации, потребителями, а также государственными регуляторными органами.
Основной функцией Уполномоченного представителя является независимое осуществление постмаркетингового надзора.
Авторизация Уполномоченного представителя может быть признана производителем посредством доверенности, а также заключения договора о его назначении.
Компетентность и осведомленность в национальном и европейском законодательстве компании, претендующей на роль Уполномоченного представителя, не должна вызывать сомнений.
специалист по оценке соответствия
компании «Кратия»
партнер компании «Кратия»

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим