 Валентин Черных, ректор Национального фармацевтического университета (НФаУ), доктор химических наук, доктор фармацевтических наук, академик НАН Украины, отметил, что сегодня от представителей власти можно услышать обещания, что лекарства будут дешевыми. Однако, как отметил ученый, это невозможно. Лекарственные средства — это продукт высоких технологий, и если общество хочет получать эффективные, безопасные и качественные препараты, то оно должно понимать, что такой продукт априори не может быть дешевым. Поэтому задача нашего государства состоит в обеспечении доступности эффективных лекарственных средств путем внедрения компенсаторных механизмов по примеру развитых стран. Речь идет о реимбурсации — частичной компенсации стоимости лекарственных средств со стороны государства.
Валентин Черных, ректор Национального фармацевтического университета (НФаУ), доктор химических наук, доктор фармацевтических наук, академик НАН Украины, отметил, что сегодня от представителей власти можно услышать обещания, что лекарства будут дешевыми. Однако, как отметил ученый, это невозможно. Лекарственные средства — это продукт высоких технологий, и если общество хочет получать эффективные, безопасные и качественные препараты, то оно должно понимать, что такой продукт априори не может быть дешевым. Поэтому задача нашего государства состоит в обеспечении доступности эффективных лекарственных средств путем внедрения компенсаторных механизмов по примеру развитых стран. Речь идет о реимбурсации — частичной компенсации стоимости лекарственных средств со стороны государства.
 Очевидно, что средства государственного бюджета должны расходоваться на препараты с доказанной эффективностью и при этом — оптимальной ценой, то есть с наиболее приемлемым соотношением цена/качество. Под качеством понимаются эффективность, безопасность и соответствие производства требованиям стандартов. В этом контексте эксперт сделал акцент на возможности отечественной промышленности, которая к 2013 г. полностью перешла на европейские стандарты качества. В то же время средневзешенная стоимость 1 упаковки лекарственного средства украинского производства почти в 5 раз ниже зарубежного. Теперь перед отечественными производителями стоит новый вызов — они должны доказать обществу, что их генерические препараты эквивалентны оригинальным/референтным. Дальше всех в этом вопросе продвинулся лидер отечественного сегмента фармрынка — компания «Фармак».
Очевидно, что средства государственного бюджета должны расходоваться на препараты с доказанной эффективностью и при этом — оптимальной ценой, то есть с наиболее приемлемым соотношением цена/качество. Под качеством понимаются эффективность, безопасность и соответствие производства требованиям стандартов. В этом контексте эксперт сделал акцент на возможности отечественной промышленности, которая к 2013 г. полностью перешла на европейские стандарты качества. В то же время средневзешенная стоимость 1 упаковки лекарственного средства украинского производства почти в 5 раз ниже зарубежного. Теперь перед отечественными производителями стоит новый вызов — они должны доказать обществу, что их генерические препараты эквивалентны оригинальным/референтным. Дальше всех в этом вопросе продвинулся лидер отечественного сегмента фармрынка — компания «Фармак».
Филя Жебровская, генеральный директор ПАО «Фармак», подчеркнула, что основная задача украинской фармацевтической промышленности — показать, что она работает на благо народа. Украинский пациент должен быть уверен в том, что в аптеке или больнице он получает эффективные медикаменты. Поэтому исследования биоэквивалентности таблетированных лекарственных форм генерических препаратов должны стать непременным условием для включения препаратов в программы государственных закупок и реимбурсации.
 Надежда Жукова, начальник управления экспертизы материалов по биоэквивалентности ГП «Государственный экспертный центр МЗ Украины», в докладе «Биоэквивалентность. Достижения и перспективы развития в Украине» детально осветила различные аспекты этого исследования. На сегодня специалисты здравоохранения имеют общее представление о биоэквивалентности, но как проводятся такие исследования и почему они важны, понимают не все. Что же предшествовало появлению исследований биоэквивалентности в мире? Еще в 60–70-е годы прошлого столетия ученые заметили, что изменения биодоступности препаратов повлекли за собой серьезные терапевтические отклонения. Например, в 1968 г. производитель фенитоина изменил состав вспомогательных веществ — лактозу он заменил на сульфат кальция. После этого терапевтическое действие препарата изменилось. Более того, была выявлена токсичность. Замена вспомогательного вещества привела к изменениям фармакокинетического профиля препарата и его биодоступности. Не менее интересная история произошла с дигоксином в 1971 г. Врачи заметили, что препараты с одним и тем же действующим веществом, но разных производителей, проявляют разную эффективность. Когда исследователи проанализировали сравнительную фармакокинетику препаратов 4 разных производителей, то оказалось, что она имеет принципиальные различия. Соответственно, отличались их биодоступность и терапевтический эффект.
Надежда Жукова, начальник управления экспертизы материалов по биоэквивалентности ГП «Государственный экспертный центр МЗ Украины», в докладе «Биоэквивалентность. Достижения и перспективы развития в Украине» детально осветила различные аспекты этого исследования. На сегодня специалисты здравоохранения имеют общее представление о биоэквивалентности, но как проводятся такие исследования и почему они важны, понимают не все. Что же предшествовало появлению исследований биоэквивалентности в мире? Еще в 60–70-е годы прошлого столетия ученые заметили, что изменения биодоступности препаратов повлекли за собой серьезные терапевтические отклонения. Например, в 1968 г. производитель фенитоина изменил состав вспомогательных веществ — лактозу он заменил на сульфат кальция. После этого терапевтическое действие препарата изменилось. Более того, была выявлена токсичность. Замена вспомогательного вещества привела к изменениям фармакокинетического профиля препарата и его биодоступности. Не менее интересная история произошла с дигоксином в 1971 г. Врачи заметили, что препараты с одним и тем же действующим веществом, но разных производителей, проявляют разную эффективность. Когда исследователи проанализировали сравнительную фармакокинетику препаратов 4 разных производителей, то оказалось, что она имеет принципиальные различия. Соответственно, отличались их биодоступность и терапевтический эффект.
Эти и подобные случаи привели к тому что в 90-е годы прошлого века регуляторные органы — Европейское агентство по лекарственным средствам (EMA), Управление по контролю за пищевыми продуктами и лекарственными средствами США (FDA), ВОЗ — разработали и внедрили регуляторные документы, регламентирующие подходы к определению биоэквивалентности для генерических препаратов. С течением времени подходы совершенствовались, что нашло отображение в международной регуляторной базе.
Что касается Украины, то в вопросе биоэквивалентности среди стран СНГ она занимает лидирующие позиции. Понятие «биоэквивалентность» впервые появилось в приказе МЗ Украины от 26.08.2005 г. № 426. Требования к выбору метода доказательства биоэквивалентности появились в приказе МЗ Украины от 17.04.2007 г. № 190. По мнению докладчика, принятие этого приказа можно считать переворотом в контексте внедрения исследований биоэквивалентности в Украине. Подходы к доказательству биоэквивалентности, изложенные в приказе МЗ Украины от 26.08.2005 г. № 426, приведены в соответствие с международными нормами приказом МЗ Украины от 04.01.2013 г. № 3.
На сегодня Порядок экспертизы регистрационных материалов на лекарственные средства, которые подаются на государственную регистрацию, а также экспертизы по внесению изменений в регистрационные материалы на протяжении действия регистрационного свидетельства принят в редакции приказа МЗ Украины от 23.07.2015 г. № 460. Но требования к доказательству биоэквивалентности не изменились.
В настоящее время в Украине действуют следующие регуляторные документы по вопросам биоэквивалентности:
- Постановление КМУ от 26.05.2005 г. № 376 с изменениями;
- Приказ МЗ Украины от 26.08.2005 г. № 426 с изменениями в версии приказа МЗ Украины от 23.07.2015 г. № 460;
- CPMP/QWP/EWP/1401/98 Rev. 1. Guideline on the investigation of bioequivalence, 2010 г.;
- Руководство 42-7.1:2014 «Исследования биоэквивалентности»;
- WHO Technical Report Series 937. WHO expert committee on specifications for pharmaceutical preparations. 2005 г.;
- FDA — Guidance for Industry. Bioavailability and Bioequivalence.
Переходя к понятийному аппарату, эксперт дала определение, что такое генерик. Генерический лекарственный препарат (генерик, взаимозаменяемый) — лекарственный препарат, который имеет такой же качественный и количественный состав действующих веществ и лекарственную форму, как и референтный препарат, и чья взаимозаменяемость с референтным препаратом доказана соответствующими исследованиями. Различные соли, простые и сложные эфиры, изомеры, смеси изомеров, комплексы или производные действующего вещества считаются одним и тем же действующим веществом при условии, что они существенно не отличаются с точки зрения безопасности и эффективности. Различные лекарственные формы перорального применения с немедленным высвобождением считаются одной и той же лекарственной формой.
Взаимозаменяемый лекарственный препарат — это препарат, который является эквивалентным референтному лекарственному средству и может заменять его в медицинской практике.
Докладчик отметила, что для некоторых лекарственных форм подтверждение эквивалентности базируется на фармацевтической эквивалентности. Это парентеральные препараты, растворы для перорального применения, порошки для приготовления растворов, газы, глазные, ушные лекарственные средства в форме водных растворов, препараты местного действия в форме водных растворов, назальные спреи и ингаляционные препараты в форме водных растворов, ректальные лекарственные средства в форме водных растворов. Проще говоря, это те лекарственные формы, применяя которые пациент получает действующее вещество в растворенном состоянии. Считается, что для таких лекарственных препаратов биодоступность равна 100%.
Основные критерии оценки фармацевтической эквивалентности:
- идентичность дозы действующего вещества и его химических характеристик;
- идентичность лекарственной формы;
- идентичность или подобие состава вспомогательных веществ;
- схожесть фармразработки;
- аналогичность требований к спецификации качества и требований к производству (GMP);
- аналогичный путь введения препарата.
Для некоторых лекарственных форм необходимо подтверждение эквивалентности in vivo или, если это возможно, исследование по процедуре биовейвер на основании биофармацевтической системы классификации (БСК). Почему это так? Потому что в случае применения этих препаратов пациент получает действующее вещество не в растворенном состоянии. Соответственно, процессы растворения, высвобождения, распределения, абсорбции действующего вещества влияют на его биодоступность. Это пероральные препараты системного действия с немедленным высвобождением (таблетки, капсулы, суспензии); непероральные и непарентеральные препараты системного действия (трансдермальные пластыри, суппозитории, гель тестостерона, трансдермальные контрацептивы, никотиновые жевательные резинки); препараты модифицированного высвобождения; препараты с фиксированной комбинацией системного действия, у которых для как минимум одного действующего вещества необходимо доказательство эквивалентности in vivo; препараты не в форме растворов (например для перорального, назального, офтальмологического, дерматологического, ректального или вагинального использования) несистемного действия и без системной абсорбции; генерический препарат, который, в отличие от референтного препарата, содержит другой эфир, изомер, рацемат, комплексы или продукты дериватизации действующего вещества.
Существует 4 метода оценки эквивалентности, для каждого их них существуют определенные критерии выбора, а именно:
- сравнительные фармакокинетические исследования — для препаратов системного действия, для которых возможно определить концентрации действующего вещества в биологических жидкостях;
- сравнительные фармакодинамические исследования — для препаратов, для которых невозможно определить концентрации действующего вещества в биологических жидкостях, но возможно оценить значимые фармакодинамические показатели, вызываемые лекарственным средством;
- сравнительные клинические исследования — для препаратов, для которых невозможно определить фармакокинетические параметры или получить соответствующие фармакодинамические точки;
- исследования in vitro по БСК (процедура биовейвер по БСК) — для препаратов в твердой дозированной форме немедленного высвобождения системного действия, если выполняются все условия для этой процедуры.
Два лекарственных средства считаются биоэквивалентными, если они фармацевтически эквивалентны или являются фармацевтическими альтернативами, а их биодоступность после назначения одинаковой молярной дозы при одинаковых условиях является настолько схожей, что можно ожидать по сути одинакового их действия.
Биодоступность — скорость и степень поступления (всасывания) действующего вещества из соответствующей лекарственной формы в системный кровоток, в результате чего оно становится доступным в месте действия. Для графического изображения биодоступности строится фармакокинетическая кривая, отображающая концентрацию действующего вещества в организме человека во времени. Площадь под кривой определяет биодоступность. Сравнительные фармакокинетические исследования — это прямой метод определения биодоступности.

Докладчик схематично продемонстрировала концепцию фармакокинетики следующим образом. Попав в организм человека, препарат растворяется и происходят его абсорбция, распределение и затем элиминация. Влияя на определенные рецепторы, молекулы действующего вещества вызывают отклик организма на препарат, то есть эффект. Абсорбция, распределение и элиминация описываются фармакокинетической кривой, а распадаемость, растворение и дальнейшая абсорбция определяют биодоступность.
Эксперт также обратила внимание на разницу в подходах к исследованиям и разработке оригинальных препаратов и генериков. В случае с оригинальным препаратом его свойства, в том числе и биодоступность, изучаются в ходе доклинических, клинических, а затем постмаркетинговых исследований. То есть оригинальный препарат изучен с разных сторон — на разных популяциях, при разных сопутствующих заболеваниях и т.д. Полученные в ходе исследований данные находят отображение в инструкции по применению препарата.
Если же речь идет о генерике, то доклинические и клинические исследования не проводятся, а его эффективность и безопасность подтверждаются в исследованиях биоэквивалентности. Основная задача исследователей — подтвердить, что генерик по сути аналогичен оригинальному препарату, но не исследовать препарат заново.
Особенности исследований биоэквивалентности следующие:
- важен правильный выбор референтного препарата — в идеале это должен быть оригинальный препарат, зарегистрированный по полному досье;
- это не терапевтические исследования;
- субъекты исследования — здоровые добровольцы;
- очень важны планирование и максимальная стандартизация всех этапов;
- обоснованное количество субъектов исследования;
- обоснованный дизайн и подходы к проведению и оценке.
Н. Жукова обратила внимание на то, что существует понятие «биодрейф». Если в сравнительных исследованиях генерик сравнивался с генериком, то в ряде случаев он не может считаться взаимозаменяемым с оригинальным препаратом (рисунок).
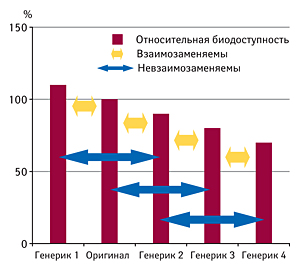
По словам эксперта, как правило, исследования биодоступности требуются для утверждения и новых препаратов, и препаратов-генериков. Биоэкивалентность, которая основывается на сравнительных фармакокинетических исследованиях, то есть на определении в плазме максимальной концентрации вещества и площади под фармакокинетической кривой, получила наибольшее распространение и стала наиболее успешным биомаркером безопасности и эффективности лекарственного средства. Генерические препараты, для которых доказана биоэквивалентность, могут заменять референтный препарат без коррекции дозы и без дополнительного терапевтического мониторинга.
 Игорь Зупанец, доктор медицинских наук, профессор, заведующий кафедрой клинической фармакологии и клинической фармации НФаУ, главный внештатный специалист МЗ Украины по специальности «Клиническая фармация», представил вниманию участников сателлитного симпозиума доклад на тему «Изучение эквивалентности лекарственных препаратов как основа внедрения генерической замены в практику специалистов здравоохранения».
Игорь Зупанец, доктор медицинских наук, профессор, заведующий кафедрой клинической фармакологии и клинической фармации НФаУ, главный внештатный специалист МЗ Украины по специальности «Клиническая фармация», представил вниманию участников сателлитного симпозиума доклад на тему «Изучение эквивалентности лекарственных препаратов как основа внедрения генерической замены в практику специалистов здравоохранения».
Тема биоэквивалентности и биодоступности актуальна не только для Украины. В августе текущего года проходил VII Мировой конгресс по биодоступности и биоэквивалентности. Во время этого международного форума обсуждались практически те же самые вопросы, которые сегодня волнуют украинских экспертов.
Докладчик отметил, что в настоящее время уровень украинских клинических баз и аналитических лабораторий, которые занимаются исследованиями биоэквивалентности, как и уровень самих исследований, достаточно высок. Украинские производители задаются вопросом — какие преференции должен получить производитель, который провел сравнительные исследования для своих продуктов? Ведь такие исследования довольно дорогостоящие.
В США и ЕС эта проблема отрегулирована с помощью различных механизмов, таких как реимбурсация — в списки возмещаемых препаратов включаются только препараты с доказанной эффективностью.
Эксперт обратил внимание на то, что украинский фармрынок — генерический. Если, к примеру, в Германии соотношение оригинальных препаратов и генериков составляет 45 и 55% соответственно, то в Украине в этом соотношении оригинальные продукты занимают только 15%, а генерики — 85%. По словам докладчика, на сегодня в ассортименте аптечного учреждения оригинальные продукты составляют не более 5%.
Какова судьба инновационного продукта? Его патентная защита продолжается 20 лет. Если объем его мировых продаж достигает 1 млрд дол. США, то он становится блокбастером и превращается в бренд. По истечении срока патентной защиты на рынке появляются его генерические копии. Многие компании идут на то, чтобы модифицировать свой оригинальный препарат и за счет этого продлить патентую защиту.
В медицинской практике врач сталкивается с проблемой взаимозаменяемости лекарственных средств. Опрашивая врачей, докладчик пришел к выводу, что подавляющее большинство предпочитают генерические препараты оригинальным. Иногда после применения генерика врач отказывается от него в пользу другого генерика. И лишь незначительная часть специалистов возвращаются к оригинальному препарату.
Всегда ли генерик эквивалентен оригинальному препарату? Основное требование взаимозаменяемости — терапевтическая эквивалентность, когда доказана фармацевтическая и фармакокинетическая эквивалентность. Проблема взаимозаменяемости актуальна не только для Украины.
Так, в результате сравнительного изучения в США кларитромицина (Abbott) и 40 генериков из 13 стран Азии и Латинской Америки установлено, что в 8 препаратах содержание действующего вещества не соответствовало стандартам компании-разработчика, 70% генериков растворяются значительно медленнее оригинального препарата, что критично для их усвоения. У 24 препаратов превышен 3% предел допустимых примесей (до 32%). А ведь это препараты, которые присутствуют на рынке.
Генерические и оригинальные препараты, с одной стороны, схожи, а с другой — имеют отличия. Их объединяют субстанция, доза и лекарственная форма. Различия могут быть во вспомогательных веществах и технологии производства. Докладчик отметил, что генерический производитель может либо приобрести технологию оригинального препарата, либо создать свою. Создание технологий — это дорогостоящий процесс. Поэтому лекарственный препарат, для которого проведены исследования биоэквивалентности, должен быть дороже, чем тот, для которого сравнительные исследования не проводились. Эксперт обратил внимание на важный момент — фармацевтическая эквивалентность не гарантирует эквивалентность фармакокинетическую в 100% случаев.
Страны стараются использовать генерические продукты с доказанными эффективностью и безопасностью из экономических соображений. По данным Бюджетного управления конгресса США, применяя генерики, американцы ежегодно экономят 8–10 млрд дол.1
Тем не менее, вокруг темы «что лучше — генерик или оригинальный препарат» постоянно продолжается дискуссия. В чем же преимущества генерика? Разработка генерика в десятки раз дешевле бренда. Он появляется на рынке через несколько лет после истечения срока действия патента на оригинальный препарат. Его эффективность и безопасность должны соответствовать оригинальному препарату и доказать это можно путем сравнительных исследований. И, наконец, генерик доступен для широкого применения социально незащищенными слоями населения.
По словам эксперта, украинские производители, например компания «Фармак», вкладывают значительные ресурсы в качество, эффективность и безопасность лекарств.
Украинский генерический рынок имеет ряд проблем. В то время как емкость рынка генериков по сравнению с инновационными препаратами составляет 80–90%, на сегодня точно неизвестно, сколько препаратов исследованы на биоэквивалентность, насколько качественно проведены эти исследования и проводились ли они для отдельно взятых препаратов.
В 2009 г. в ответ на запрос НФаУ по поводу исследований лекарственных средств в Украине, Государственный фармакологический центр (ГФЦ, ныне ДЭЦ) привел следующие данные. Общее количество предрегистрационных клинических испытаний, которые были одобрены ГФЦ для проведения в Украине, составляло: в 2004 — 195, 2005 — 154, 2006 — 174, 2007 — 98, 2008 — 50 и за 9 мес 2009 — 25. Из них клинические испытания I фазы: в 2004 — 11, 2005 — 15, 2006 — 14, 2007 — 2, 2008 — 5 и за 9 месяцев 2009 — 6; и клинические испытания по биоэквивалентности: в 2004 — не проводились, 2005 — 2, 2006 — 6, 2007 — 2, 2008 — 3 и за 9 мес 2009 — 3.
То есть исследований по биоэквивалентности не так уж много, потому что регуляторные условия позволяют находиться на рынке препаратам с различной степенью доказательности. И в этом нет ничего плохого, главное, чтобы для каждого препарата соблюдались нормативные требования, а именно: регистрация по полному досье, по результатам сравнительных клинических исследований, на ограниченном контингенте, по биовейверам, по литературной справке («хорошо изученное медицинское применение»), по биоэквивалентности.
Что касается исследований биоэквивалентности, то это вопрос государственной безопасности. Так, ВОЗ определила, что недостаточная концентрация препарата в крови приводит к:
- снижению эффективности терапии социально значимых заболеваний (туберкулез, СПИД, онкопатология, ишемическая болезнь сердца и т.д.);
- распространению резистентности бактериальных и вирусных патогенов;
- увеличению количества случаев тяжелых осложнений и инвалидности;
- увеличению расходов системы здравоохранения;
- снижению качества и продолжительности жизни населения.
На сегодня причина 67% всех случаев смерти в Украине приходится на сердечно-сосудистые заболевания. То есть это перспективный сегмент для создания генерических продуктов, и исследования биоэквивалентности тут весьма важны.
Докладчик привел три примера исследований биоэквивалентности.
1. Исследование по оценке биоэквивалентности препаратов Торсид, таблетки по 10 мг производства ПАО «Фармак» (Украина), и Трифас 10, таблетки по 10 мг производства компании «Берлин-Хеми АГ (Менарини Групп)» (Германия).
Исследование проводилось по классической схеме — скрининг субъектов исследования, рандомизация (распределение по группам), 1-й период, отмывочный период, 2-й период, «ослепление» и анализ данных. Исследование проведено в соответствии с этическими принципами Хельсинкской декларации, Законом Украины «О лекарственных средствах», соблюдением принципов GCP и GLP.
Дизайн исследования: открытое сравнительное рандомизированное (1:1) перекрестное с двумя периодами и двумя последовательностями исследование по изучению биоэквивалентности при однократном приеме здоровыми добровольцами натощак средней разовой дозы тестируемого и референтного лекарственных препаратов. Количество и контингент испытуемых — 24 здоровых добровольца обоего пола в возрасте от 18 до 50 лет. Биоаналитический метод: высокоэффективная жидкостная хроматография с УФ-детекцией, пробоподготовка с твердофазной экстракцией торасемида из плазмы крови и его концентрированием под вакуумом.
Кривые зависимости «концентрация — время» торасемида у отдельных добровольцев после приема тестируемого и референтного препаратов, а также совокупность индивидуальных фармакокинетических кривых торасемида у 24 добровольцев после приема тестируемого и референтного препаратов практически совпали. Усредненные фармакокинетические профили торасемида у 24 участников исследования и совмещенные лог-преобразованные средние арифметические кривые зависимостей «концентрация-время» (AUC0-t) совпали практически на 100%.
Критерии биоэквивалентности — препараты считаются биоэквивалентными, если 90% доверительные интервалы для отношения средних логарифмически преобразованных значений параметров Cmax и AUC0-t находятся в пределах 0,8000÷1,2500 (80,00÷125,00%). Границы 90% доверительных интервалов для отношения средних значений Cmax и AUC0-t составляют 85,68÷94,99 и 95,59÷101,05%. Таким образом препараты биоэквивалентны, а значит, взаимозаменяемы.
Если препарат прошел исследование биоэквивалентности, то его инструкция должна полностью соответствовать референтному препарату.
2. Клиническое исследование по оценке биоэквивалентности препаратов Бисопролол, таблетки по 10 мг (ПАО «Фармак», Украина), и Конкор, таблетки, покрытые оболочкой, 10 мг («Мерк КГаА», Германия для «Никомед», Германия), с участием здоровых добровольцев.
Дизайн исследования: открытое сравнительное рандомизированное перекрестное с двумя периодами и двумя последовательностями исследование по изучению биоэквивалентности при приеме здоровыми добровольцами натощак однократной дозы тестируемого и референтного лекарственных средств. Количество и контингент испытуемых — 18 здоровых добровольцев обоего пола в возрасте от 18 до 50 лет. Биоаналитический метод: высокоэффективная жидкостная хроматография с флуориметрической детекцией; пробоподготовка — твердофазная экстракция бисопролола и концентрирование пробы под вакуумом.
Кривые зависимости «концентрация — время» бисопролола после приема тестируемого и референтного препаратов совпали практически на 100%. Совмещенные лог-преобразованные средние арифметические AUC0-t у 18 добровольцев совпали практически на 100%.
Критерии биоэквивалентности — препараты считаются биоэквивалентными, если 90% доверительные интервалы для отношения средних логарифмически преобразованных значений параметров Cmax и AUC0-t находятся в пределах 0,8000÷1,2500 (80,00÷125,00%). Границы 90% доверительных интервалов для отношения средних значений Cmax и AUC0-t составляют 82,87÷94,76 и 85,02÷92,87% (с учетом фактора коррекции). Таким образом, препараты биоэквивалентны, а значит, взаимозаменяемы.
3. Клиническое исследование по оценке биоэквивалентности препаратов Эналозид форте, таблетки (производства ПАО «Фармак», Украина), и Ко-ренитек, таблетки (производства «Merck Sharp & Dohme B.V.», Нидерланды), с участием здоровых добровольцев (код: FM ENF/KR).
Дизайн исследования — открытое сравнительное рандомизированное перекрестное с двумя периодами и двумя последовательностями исследование по изучению биоэквивалентности при приеме здоровыми добровольцами натощак однократной дозы тестируемого и референтного лекарственных средств. Количество и контингент испытуемых — 24 здоровых добровольца обоего пола в возрасте от 18 до 55 лет. Биоаналитический метод — высокоэффективная жидкостная хроматография с масс-спектрометрическим детектором.
Усредненные фармакокинетические профили эналаприлата и гидрохлоротиазида после однократного перорального приема препаратов Эналозид форте и Ко-ренитек 24 участниками исследования совпадают.
Границы 90% доверительных интервалов для отношения средних значений Cmax и AUC0-t по эналаприлату составляют 96,51÷112,48 и 93,63÷114,01% (с учетом фактора коррекции) и по гидрохлоротиазиду — 97,29÷106,31 и 93,23÷124,48% (с учетом фактора коррекции) соответственно. Результат — препараты биоэквивалентны. Вывод: препараты взаимозаменяемы.
Завершая доклад, эксперт отметил, что недопустимо переносить данные по эффективности и безопасности инновационного препарата на все генерики. Он посоветовал врачам ориентироваться на данные доказательной медицины, и при отсутствии информации предпочтение отдавать генерикам известных компаний-производителей с доказанной терапевтической эквивалентностью.
Что касается пациентов, то им не стоит самостоятельно производить генерическую замену. В свою очередь, регуляторные органы должны создать доступную для врачебного сообщества базу данных — реестр групп генерических препаратов (по аналогии с «Orange Book»), а также разработать оперативную систему оповещения (интернет-ресурсы) о новых генерических лекарственных средствах, прошедших исследования на биоэквивалентность.
В настоящее время по инициативе НФаУ издан только справочник эквивалентности лекарственных средств, который не является государственным. В справочнике впервые представлены данные по эквивалентности (взаимозаменяемости) лекарственных средств. Необходимо, чтобы подобный справочник или реестр был издан на государственном уровне и имел официальный статус.2
фото Сергея Бека
2В Национальной политике по обеспечению лекарственными средствами на период 2017–2025 гг. будут предусмотрены разработка и внедрение системы (методики оценки, классификации, порядок внесения информации и ведения и т.п.) открытого доступа к информации об уровне доказательной терапевтической эквивалентности и эффективности лекарственных средств, которые допускаются на рынок Украины (по аналогии с американской Orange Book)

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим