Для выведения нового препарата на рынок требуется в среднем 10 лет и 2 млрд дол. США. С таким количеством заболеваний и состояний, для которых все еще не разработано эффективного лечения, например болезнь Альцгеймера, которая затрагивает более 5 млн американцев, необходимость ускорить появление новых, более эффективных методик лечения и лекарственных средств является очевидной.
Использование регуляторными и профильными органами здравоохранения фактических данных доказательств, или real-world evidence (RWE), отражающих практический опыт пациентов в реальных ситуациях, в дополнение к использованию данных, полученных из обычных рандомизированных контролируемых исследований, даст возможность улучшить доступ к безопасному и эффективному лечению для населения.
Но, что более важно, процесс одобрения, основанный на RWE, который поддерживает самые высокие стандарты безопасности, но при этом позволяет быстрее выводить на рынок новые лекарства, поможет сотням тысяч людей, которые ждут своего лечения, в том числе и новых препаратов.
Оцифровка существующих данных и значительное увеличение количества электронных данных, полученных в ходе рутинной помощи работниками сферы здравоохранения или непосредственно самими пациентами, создают беспрецедентную возможность для модернизации и расширения данных клинических исследований, улучшения процесса постмаркетингового мониторинга лекарственных средств.
Как препараты попадают на рынок?
Процесс выведения лекарственного средства на рынок является достаточно длительным, комплексным и сложным (табл. 1). При этом клинические исследования — наиболее критический, дорогостоящий и трудоемкий этап процесса разработки препаратов, на который уходит в среднем около 7 лет и 1,6 млрд дол. (табл. 2). Решение об окончательном одобрении препарата в значительной степени основывается на данных клинических испытаний.
| Таблица 1 | Современный процесс разработки лекарств |
| Этап | Описание действий |
| Доклиническая фаза | Спонсор разрабатывает (покупает или лицензирует) новое лекарственное соединение и проводит исследования на животных для оценки его токсичности.Спонсор подает заявку на проведение клинических исследований нового лекарственного средства, основанную на результатах первоначального тестирования, и разрабатывает план тестирования на людях. FDA рассматривает заявку на предмет того, подвергают ли предполагаемые клинические исследования человека неоправданной угрозе причинения вреда |
| Клинические исследования | Обычно препараты проходят 3 этапа клинических исследований:• Исследования I фазы являются первыми исследованиями применения нового препарата человеком. Этот этап призван обеспечить более глубокое понимание безопасности препарата, включая побочные эффекты, связанные с его дозой.• Исследования II фазы оценивают эффективность препарата для конкретного терапевтического применения у пациентов. При этом продолжается оценка безопасности лекарственного средства. Основная цель — получить предварительные данные о том, работает ли препарат у людей с определенным заболеванием или состоянием.• Исследования III фазы включают относительно большое число пациентов и предназначены для сбора достаточной информации о безопасности и эффективности препарата для удовлетворения требований FDA по адекватной оценке соотношения польза/риск, а также для подготовки информации для маркировки лекарства |
| Рассмотрение регистрационного досье | • После проведения клинических исследований спонсор подает в FDA на рассмотрение регистрационное досье, которое включает данные, полученные в результате всех исследований (на животных и на людях), а также информацию о том, как лекарственное средство ведет себя в организме и как оно производится.• FDA рассматривает маркировку лекарственного средства и обеспечивает наличие соответствующей информации, которая предоставляется к сведению медицинских работников и потребителей.• FDA инспектирует объекты, на которых будет производиться лекарственное средство.• FDA либо одобряет заявку, или выдает ответное письмо |
| Постмаркетинговая деятельность | • После одобрения препарата начинается IV фаза — постмаркетинговые исследования, по результатам которых спонсор обязан представлять периодические обновления в FDA.• FDA также установлена постоянная система постмаркетинговых наблюдений за препаратом для выявления серьезных, неожиданных побочных эффектов и принятия соответствующих мер в случае необходимости |
| Таблица 2 | Среднее время и стоимость процесса выведения препарата на рынок |
| Факторы | Доклиническое изучение | Клинические исследования | Рассмотрение FDA | Постмаркетинговыеисследования | ||
| Фаза I | Фаза II | Фаза III | ||||
| Время, годы | 1 | 1,65 | 2,53 | 2,56 | 1,33 | Бессрочно |
| Общая средняя продолжительность клинических исследований — 6,74 | ||||||
| Стоимость,дол. | 182 млн | 375 млн | 542 млн | 689 млн | 129 млн | 312 млн |
| Общая средняя стоимость клинических исследований — 1,6 млрд | ||||||
Исследователи из США в течение более 50 лет проводили клинические исследования для одобрения Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) одинаковым образом. Эти клинические исследования в значительной степени основаны на рандомизированных клинических исследованиях, которые, как правило, являются плацебо-контролируемыми, двойными слепыми, в которых пациенты распределены по группам, но ни пациент, ни исследователь не знают, что принимает пациент — плацебо или лекарственное средство. Такой тип исследований является золотым стандартом клинических исследований, однако имеет некоторые ограничения.
Плотно контролируемая природа рандомизированных клинических исследований позволяет получить убедительные доказательства эффективности и безопасности использования лекарственного средства, но только в относительно небольших и узко определенных популяциях, что ограничивает данные об их применения у более широкого круга пациентов. Часто в данных клинических исследований отсутствует информация о применении препарата у пациентов со множественными сопутствующими заболеваниями, с сопутствующим приемом других препаратов, а также различных рас и этнических групп, возраста и т.д.
То есть из-за ограниченности количества пациентов, включенных в исследование, невозможно получить полную картину того, как препарат поведет себя в реальных условиях. Например, исследование для нового противодиабетического препарата обычно не включает пациентов, у которых также выявлены другие заболевания, так что исследователи могут оценить влияние лекарственного средства только на целевое состояние, а не на сопутствующие виды патологии. Однако у многих пациентов с сахарным диабетом очень часто отмечают и другие заболевания, такие как сердечно-сосудистые, например. По большей части клинические исследования не могут продемонстрировать, будет ли препарат влиять на этих пациентов по-разному или как он способен взаимодействовать с другими лекарственными средствами, которые может принимать пациент.
Поскольку невозможно предсказать все эффекты препарата во время клинических исследований, FDA создало систему постмаркетинговой безопасности для выявления серьезных непредвиденных нежелательных явлений и принятия мер в случае необходимости.
Однако даже учитывая постмаркетинговые исследования, в эру перехода к индивидуализированной медицине, когда принимаются во внимание индивидуальные генетические особенности каждого пациента, данные рандомизированных клинических исследований не могут обеспечить полный объем необходимой информации о применении препарата.
Многие эксперты согласны с тем, что RWE, используемые в сочетании с протоколами клинических исследований, могут помочь устранить некоторые из этих ограничений.
RWE: новая возможность для улучшения процесса
Данные, полученные из источников за пределами рандомизированных клинических исследований, отражающие фактический опыт пациентов, часто называются реальными данными (real-world data — RWD). RWE получают из источников RWD, таких как электронные медицинские записи, лабораторные информационные системы, аптечные и радиологические системы, системы административных требований и реестры (рис. 1). Также источниками получения RWD являются данные, полученные от пациентов, собранные ими на домашних и портативных устройствах мониторинга, а также из сетей обмена информацией, социальных сетей и мобильных приложений.
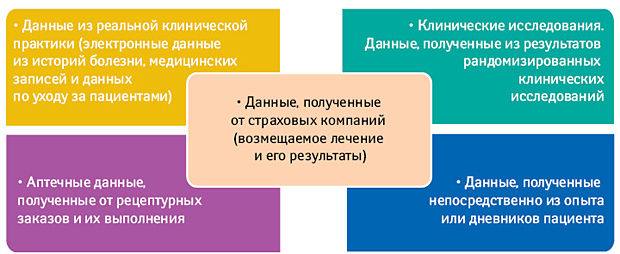
Значительное увеличение использования электронных медицинских записей в клинических условиях в сочетании с резким увеличением числа лиц, записывающих медицинскую информацию с помощью устройств и приложений для обмена информацией, создает беспрецедентные объемы данных, которые могут быть полезны и использоваться при принятии регуляторных решений. Около 83% врачей и 84% лечебных учреждений сегодня используют какой-либо тип электронных медицинских записей, создавая каждый день невероятное количество клинических данных, которые сегодня не используются.
Кроме того, 7 из 10 взрослых американцев говорят, что они отслеживают по крайней мере один индикатор состояния здоровья для себя или для кого-то другого ежедневно в домашних условиях. 58% владельцев смартфонов в США имеют на телефоне приложение для фитнеса или здоровья, и около 65% этих людей открывают приложение по крайней мере 1 раз в день. Многие из таких приложений подключаются к носимым устройствам, которые отслеживают активность и фиксируют важные показатели состояния здоровья.
Все они являются источниками потенциально полезных данных о состоянии здоровья, которые могут дополнять данные, полученные в результате рандомизированных клинических исследований.
Обзор real-world data
Реальные данные сегодня уже используются для поддержки целого ряда инициатив по улучшению здоровья и медицинского обслуживания.
FDA уже использует RWD в постмаркетинговом надзоре за фармацевтическим рынком. Однако использование реальных данных менее распространено при получении доказательств в ходе клинических исследований и в качестве аргументов для предоставления разрешения на выведение препарата на рынок.
Несмотря на то что использование RWD при сборе доказательств эффективности до выхода препарата на рынок не запрещено законом в США, оно не распространено широко из-за отсутствия ясности в отношении требований к доказательствам, связанным с их использованием, и устоявшимися представлениями о том, что только рандомизированные клинические исследования являются достаточной базой для одобрения препарата FDA.
Использование прагматических рандомизированных клинических исследований — один из способов начать накопление опыта с использованием RWD в рамках клинических исследований. Прагматические клинические исследования — это исследования, которые проводятся в местах, где осуществляется обычный уход за пациентами, например в клиниках, больницах, домах престарелых и других медицинских учреждениях, и в которые включаются разнообразные репрезентативные группы населения с многочисленными гетерогенными показателями.
Преимущества Real-World Evidence
RWЕ имеют массу перспективных сфер применения (рис. 2), в том числе и на этапе проведения клинических исследований препарата. Так, RWD могут ускорить процесс создания гипотез для информирования о разработке клинических исследований и дают возможность идентифицировать подгруппы с более высоким соотношением риск/польза в качестве целевой аудитории.

Также данные RWD могут способствовать более эффективному и целенаправленному набору пациентов для участия в клинических исследованиях. Мониторинг процесса исследований в режиме реального времени может помочь спонсорам быстрее выявить проблемы безопасности и применения препарата, требующие принятия мер, чтобы избежать развития нежелательных явлений и возникновения ненужных задержек.
Использование RWD может улучшить обобщаемость исследований путем увеличения числа рандомизированных клинических исследований с помощью данных более широкой, более разнообразной группы пациентов в различных условиях практики, нежели те, которые доступны в настоящее время. RWD могут сделать исследования и их результаты более релевантными для пациентов и предоставить информацию о долгосрочных результатах.
Наконец, более раннее генерирование данных об эффективности лекарственного средства может помочь быстрее допускать препарат на рынок, а также формировать решение относительно его стоимости и уровня возмещения, что является очень важным в рамках государственных программ по обеспечению населения надлежащей медицинской помощью.
RWE также предоставляют значительные возможности для совершенствования постмаркетинговой деятельности, сокращая время и затраты на проведение IV фазы исследований, за счет более эффективных и своевременных методов сбора информации. RWE могут также повысить эффективность исследований, подтверждающих клиническую пользу применения лекарственных средств, одобренных в рамках ускоренных программ FDA.
Интеграция RWE в процесс разработки лекарственных средств
Интеграция RWE в современный процесс разработки лекарственных средств является очень важным и выгодным процессом, однако требует повышения уверенности в типах доказательств, которые используются, и обстоятельств, при которых это будет происходить. Улучшение качества данных и изменений в политике обмена информацией сделает использование RWE более доступным и позволит значительно упростить и удешевить современные производственные процессы.
Проблемы, которые стоят на пути интеграции
Существует ряд трудных, но преодолимых вызовов с имплементацией RWE (рис. 3), в том числе отсутствие полноты данных для клинических исследований, отсутствие принятых стандартов для обеспечения эффективной интероперабельности и использования данных в разных системах, отсутствие согласия в отношении методов точного сопоставления групп пациентов, а также отсутствие прослеживаемости данных или информации об их происхождении. В настоящее время ведется работа по решению многих из этих проблем, но потребуются дополнительные меры для поддержки создания и использования RWE.
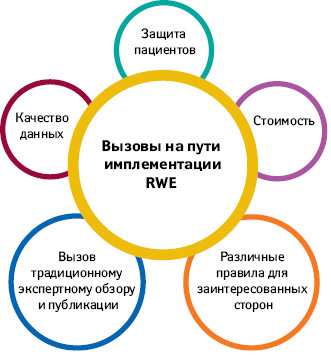
В частности, необходимо преодолеть вызовы в следующих областях:
- качество данных. Большинство источников RWE не собирают данные в исследовательских целях. Многие исследователи вынуждены «чистить» пробелы и несоответствия в данных с помощью методов, которые могут пока еще не иметь широкого признания в сфере статистической достоверности;
- стоимость. Хотя стоимость сбора и хранения данных считается издержками производителей (данные клинических исследований и их результаты), финансовые модели для данных, поддерживаемых другими заинтересованными сторонами (группами пациентов, профессиональными сообществами, поставщиками), неопределенные, особенно в той мере, в какой они подпадают под государственное финансирование;
- защита пациентов. Повторяющиеся утечки данных в отрасли здравоохранения подрывают доверие пациентов к конфиденциальности предоставляемых ими данных. Между тем на данный момент не существует урегулированной законодательной базы относительно того, когда и как часто пациенты должны давать согласие на использование персональных данных;
- различные правила для заинтересованных сторон. Предприятиям, регулируемым FDA, таким как изготовители фармацевтических и медицинских устройств, обычно запрещается предъявлять претензии или комментировать использование их продуктов, которые не имеют маркировки, одобренной FDA, и их использование не подтверждается доказательствами рандомизированных клинических исследований. Другие заинтересованные лица, имеющие доступ к «Big Data», такие как страховщики и провайдеры медицинских услуг, не сталкиваются с подобными ограничениями. RWE из разрозненных источников необходимо разрабатывать и оценивать открытым транспарентным образом всеми заинтересованными сторонами;
- вызов традиционному экспертному обзору и публикации. По мере того, как источники RWE расширяются, повышается и способность заинтересованных сторон самостоятельно генерировать RWE. Темпы, с которыми генерируются RWE, могут превзойти таковые, с которыми обычно публикуются результаты исследований. Это представляет огромный потенциал для ценных инноваций, но также бросает вызов традиционной парадигме, в которой консенсус в отношении действительных медицинских доказательств разрабатывается с помощью публикаций, прошедших экспертную оценку.
Вывод
RWE бросают вызов традиционной парадигме, в которой единственные авторитетные медицинские данные генерируются с помощью проспективных рандомизированных клинических исследований, которые подтверждаются публикацией в научных журналах и получили экспертную оценку.
Увеличение объема имеющихся электронных данных в сочетании с научными достижениями, приводящими к персонализированным и более сложным схемам лечения, требуют нового, модернизированного подхода как в разработке лекарственных средств, так и в принятии решений относительно их допуска на рынок. И именно RWE могут сыграть значительную роль в модернизации этих процессов и обеспечить безопасным и эффективным лекарственным средствам более быстрое и экономичное выведение на рынок. Использование RWE не только улучшит глобальную конкурентоспособность, но, что более важно, поможет сотням тысяч пациентов, которые ждут лечения.
Для того чтобы заложить основу для новой эры точной медицины, потребуются адаптивные подходы к принятию нормативных решений. По мере того, как медицина становится более персонализированной и узконаправленной, традиционные масштабные рандомизированные клинические исследования постепенно утрачивают свою актуальность.
Новые подходы будут необходимы для обеспечения безопасности и эффективности лечения и для защиты здоровья пациента.
список использованной литературы
находится в редакции

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим