У 2017 р. на реалізацію урядової програми «Доступні ліки» в Державному бюджеті передбачено 700 млн грн., проте за 6 міс її реалізації було використано 235 млн грн., тобто близько 33%.
Відповідно до проекту Бюджетної резолюції до 2020 р., яку Уряд України ухвалив у липні 2017 р., на реалізацію програми «Доступні ліки» у 2018–2020 рр. планується виділяти 1 млрд грн. щорічно. Передбачивши збільшення фінансування, Кабінет Міністрів доручив МОЗ України опрацювати питання щодо можливості розширення програми.
Як ми вже повідомляли раніше, на сьогодні існує кілька можливих шляхів розширення та удосконалення програми «Доступні ліки»:
- збільшення кількості міжнародних непатентованих назв (МНН) у рамках уже охоплених програмою нозологій (серцево-судинні захворювання, цукровий діабет ІІ типу, бронхіальна астма);
- збільшення кількості нозологій;
- зміна підходів до механізму відшкодування вартості лікарських засобів з метою створення конкурентного середовища серед лікарських засобів, вартість яких повністю відшкодовується державою.
ШЛЯХИ РОЗШИРЕННЯ
Щодо збільшення кількості МНН у рамках вже охоплених програмою «Доступні ліки» нозологій зазначимо, що в даному випадку вибір препаратів обмежений Національним переліком лікарських засобів. Тобто в програму неможливо включити препарати, які не включені до Національного переліку.
Аналіз свідчить, що на сьогодні майже всі МНН, які передбачені Національним переліком для лікування серцево-судинних захворювань, цукрового діабету ІІ типу, бронхіальної астми, вже включені в програму «Доступні ліки».
Існує лише один препарат, який можна включити до програми відшкодування, — глібенкламід, таблетки 5 мг. Даний препарат входить до протоколів лікування цукрового діабету II типу, а тому може бути задіяний у системі реімбурсації.
Обсяг споживання глібенкламіду у формі таблеток з дозуванням 5 мг, за підсумками 2016 р., становив 432,5 тис. упаковок та 15,6 млн грн. (рис. 1).
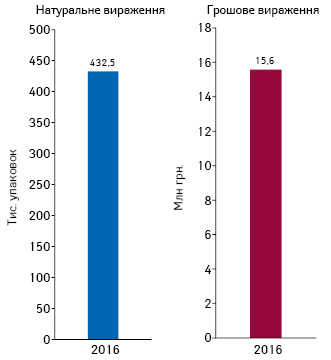
Також слід звернути увагу, що в сучасних схемах лікування перевага надається 2- та 3-компонентній терапії. Тобто доцільно було б включити в програму відшкодування вартості лікарські засоби з фіксованими комбінаціями діючих речовин. Однак на сьогодні в Національний перелік входять переважно монопрепарати, що унеможливлює введення в програму реімбурсації більшості комбінованих препаратів.
Можливе розширення кількості нозологій також обмежене Національним переліком. МОЗ України розглядає можливість включення в систему реімбурсації препаратів з наступних розділів Національного переліку:
- гормони щитоподібної залози й антитиреоїдні лікарські засоби;
- антианемічні лікарські засоби;
- лікарські засоби, що застосовуються при захворюваннях суглобів (таблиця).
| МНН | Код АТХ | Лікарська форма |
| Гормони щитоподібної залози і антитиреоїдні лікарські засоби | ||
| Левотироксин (Levothyroxine) | H03A A01 | Таблетки: 25 мкг; 50 мкг; 100 мкг (натрієва сіль) |
| Калію йодид (Рotassium iodide) | H03C A | Таблетки: 100 мкг; 200 мкг; 1 мг; 60 мг; 250 мг |
| Пропілтіоурацил (Рropylthiouracil) | H03B A02 | Таблетки: 50 мг |
| Люголя розчин (Lugolʹs solution) | Розчин | |
| Антианемічні лікарські засоби | ||
| Заліза сіль (Ferrous salt) | B03A A07 | Розчин для перорального застосування: еквівалентно 8 мг — 25 мг заліза (у вигляді сульфату)/мл |
| Таблетки: еквівалентно 60 мг — 80 мг заліза | ||
| Заліза сіль+фолієва кислота (Ferrous salt+Folic acid) | B03A D | Таблетки: еквівалентно 60 мг — 100 мг заліза + 350 мкг — 400 мкг фолієвої кислоти |
| Фолієва кислота (Folic acid) | B03B B01 | Таблетки: 400 мкг; 1 мг; 5 мг |
| Лікарські засоби, що застосовуються при захворюваннях суглобів | ||
| Алопуринол (Allopurinol) | M04A A01 | Таблетки: 100 мг |
| Хлорохін (Chloroquine) | P01B A01 | 100 мг; 150 мг (у вигляді фосфату або сульфату); 250 мг (фосфат) |
| Азатіоприн (Azathioprine) | L04A X01 | Таблетки: 50 мг |
| Гідроксихлорохін (Hydroxychloroquine) | P01B A02 | Тверді пероральні дозовані форми: 200 мг (у вигляді сульфату) |
| Метотрексат (Methotrexate) | L04A X03 | Таблетки: 2,5 мг (у вигляді натрієвої солі) |
| Пеніциламін (Penicillamine) | M01C C01 | Тверді пероральні дозовані форми: 250 мг |
| Сульфасалазин (Sulfasalazine) | A07E C01 | Таблетки: 500 мг |
Перелік лікарських засобів, які розглядаються на предмет їх включення до програми «Доступні ліки», наразі налічує 14 МНН, загальноприйнятих назв та фіксованих комбінацій.
За підсумками 2016 р., загальний обсяг реалізації зазначених препаратів через аптечну мережу становив 223 млн грн. за 3,8 млн упаковок (рис. 2). При цьому левову частку цих препаратів акумулюють гормони щитоподібної залози й антитиреоїдні лікарські засоби.
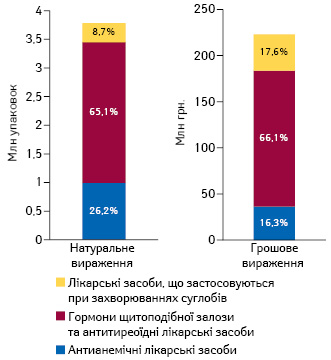
З приводу терапії захворювань щитоподібної залози зауважимо, що на сьогодні в Україні відсутні відповідні клінічні настанови та протоколи лікування, проте визначені нормативи надання медичної допомоги та показників якості медичної допомоги, затверджені наказом МОЗ України від 28 грудня 2002 р. № 507. Відповідно до цього наказу нормативи надання медичної допомоги дорослому населенню в амбулаторно-поліклінічних закладах за спеціальністю «Ендокринологія» передбачають лікування гіпотиреоїдного стану, хронічного тиреоїдиту (Ріделя) та аутоімунного тиреоїдиту препаратами левотироксину (L-тироксину).
Як відомо, через 7–10 років застосування L-тироксину у пацієнтів розвивається резистентність до цього препарату. За результатами декількох опитувань, у Великобританії 21–59% пацієнтів після 10-річної терапії L-тироксином повідомляють про погіршення ефективності цього препарату (UK Guidelines for the Use of Thyroid Function Tests, 2006).
При розвитку резистентності до L-тироксину в Україні рекомендується корекція дози препарату залежно від рівня тиреотропного гормону (ТТГ) в крові, але не частіше 1 разу на 1,5–2 міс.
У Великобританії та інших країнах — членах ЄС у таких випадках рекомендують ліотиронін як заміну L-тироксину, а з 2014 р. застосовують комбінації левотироксин+ліотиронін, що забезпечує більший контроль дозування.
На сьогодні в Україні не зареєстровані препарати ліотироніну та його комбінації з левотироксином. Проте до 1998 р. в Україні був зареєстрований препарат Тиреокомб (левотироксин натрію+ліотиронін+калію йодид), а до 2004 р. діяла реєстрація препарату Трийодтиронін (ліотиронін) німецької компанії «Berlin-Chemie». Компанія не продовжила реєстрацію цих препаратів, оскільки вони не включені до схем лікування і їх споживання знаходилося на низькому рівні.
Таким чином, якщо держава намагається фінансувати амбулаторне лікування пацієнтів із захворюваннями щитоподібної залози, то необхідно забезпечити наявність препаратів ліотироніну та його комбінації з левотироксином.
Щодо включення в перелік розчину Люголя, слід зазначити, що даний препарат застосовується переважно при запальних захворюваннях слизових оболонок глотки та гортані, а для лікування захворювань щитоподібної залози, відповідно до нормативів надання медичної допомоги, застосовується при гіпертиреозі як йодовмісний препарат другого ряду після Мерказолілу (тіамазол). Тому його включення до системи реімбурсації є недоцільним. До того ж цей препарат є безрецептурним, тому неможливо буде контролювати його відпуск у рамках реімбурсації.
Стосовно включення препарату пропілтіоурацилу, слід зазначити, що на сьогодні він не включений до схем лікування захворювань щитоподібної залози в Україні. У Великобританії він застосовується як альтернатива метимазолу (Мерказолілу) у випадках, коли виявлено непереносимість та в період вагітності, оскільки викликає менший тератогенний ефект на плід. До того ж препарати пропілтіоурацилу на сьогодні не зареєстровані в Україні.
Також відзначимо, що перелік лікарських засобів, який наразі аналізує МОЗ України стосовно включення до програми «Доступні ліки», містить препарати з фіксованими комбінаціями діючих речовин, для яких неможливо визначити добову дозу, рекомендовану ВООЗ (defined daily dose — DDD). А оскільки порядок розрахунку граничних оптово-відпускних цін на лікарські засоби на основі референтних цін базується на розрахунку вартості саме DDD, то в разі включення фіксованих комбінацій до переліку препаратів, вартість яких відшкодовується, необхідно буде підготувати і зміни до цього порядку щодо одиниці лікарської форми, для якої розраховуватиметься гранична вартість фіксованих комбінацій. Наприклад це може бути 1 таблетка з фіксованим дозуванням кожної діючої речовини.
Щодо сегменту препаратів для лікування захворювань суглобів, то слід зазначити, що деякі з них є неконкурентними, і в Україні зареєстровані препарати лише одного виробника.
УДОСКОНАЛЕННЯ ПРОГРАМИ
На сьогодні актуальним є питання підвищення мотивації виробників та аптечних закладів долучатися до програми «Доступні ліки». Відтак існує необхідність в удосконаленні програми.Щодо підвищення мотивації аптечних закладів, то, як ми вже неодноразово повідомляли, найбільш прийнятною моделлю є підвищення граничної роздрібної націнки з 15 до 25%. Адже на сьогодні препарати, які включені до програми реімбурсації, знаходяться в дискримінаційному становищі порівняно з іншими лікарськими засобами, що входять до Національного переліку, для яких роздрібна націнка становить 25%. При цьому аптеки, які не беруть участі в програмі, знаходяться в більш вигідному становищі, оскільки при реалізації цих препаратів, навіть з націнкою 15%, вони не відчувають додаткового навантаження — ані фінансового, ані бюрократичного, пов’язаного з обслуговуванням рецептів, формуванням звітів та відправкою їх розпорядникам коштів.
Аналіз свідчить, що запровадження роздрібної націнки на рівні 25% призведе до збільшення фінансування з боку держави на 9%, також на 9% збільшиться загальний обсяг доплати з боку громадян. При цьому запровадження націнки у 25% суттєво підвищить мотивацію аптечних закладів, сприятиме їх залученню до участі в програмі та підвищить ефективність програми.
Наразі, крім підвищення рівня націнки до 25%, розглядаються можливості для запровадження фіксованої націнки або оплати за фармацевтичну послугу. Натомість аналіз свідчить про те, що запровадження фіксованої націнки викликає цілу низку ризиків. Наприклад, при зростанні інфляції або включенні в Реєстр відшкодування дорогих препаратів фіксованої націнки буде недостатньо для покриття витрат аптеки на відпуск препаратів у рамках реімбурсації. До того ж важко визначити обґрунтований рівень фіксованої націнки.
Стосовно запровадження фармацевтичної послуги, слід зазначити, що, по-перше, на сьогодні таке поняття, як «фармацевтична послуга», не визначене в українському законодавстві, по-друге, незрозуміло, як розраховувати вартість такої послуги, і, по-третє, запровадження фармацевтичної послуги потягне за собою сплату податку на додану вартість (ПДВ) 20%, що призведе до збільшення витрат держави чи громадян. При цьому запровадження оплати за фармацевтичну послугу потребує внесення змін до низки нормативно-правових актів, зокрема й до Бюджетного кодексу, оскільки витрати держави необхідно буде розділити на дві статті — відшкодування вартості лікарських засобів та оплата фармацевтичної послуги.
Щодо удосконалення системи відшкодування вартості можна запропонувати декілька варіантів.
Як відомо, на сьогодні механізм реімбурсації передбачає відшкодування вартості на рівні найдешевшого препарату в межах кожного конкретного МНН. Відтак найдешевший препарат знаходиться у виключному монопольному становищі, оскільки його вартість відшкодовується державою повністю. У перші місяці реалізації програми керівники аптечних закладів наголошували на дефіциті саме цих препаратів.
З метою уникнення подібної ситуації необхідно сприяти розвитку конкуренції у сегменті лікарських засобів, вартість яких повністю компенсується державою.
На нашу думку, найбільш сприятливим механізмом підвищення конкуренції є запровадження співоплати (часткової оплати вартості з боку держави та громадянина) щодо усіх препаратів, які включені в Реєстр відшкодування. Така модель використовувалася під час реалізації Пілотного проекту з відшкодування вартості антигіпертензивних препаратів у 2012–2014 рр. (далі — Пілотний проект). Тоді препарати залежно від вартості DDD в рамках кожного дозування розподілялися на групи відшкодування за принципом двох медіан. Препарати I групи відшкодовувалися на 90%, ІI групи — менше 90%, а ІІІ групи не підпадали під відшкодування.
Запровадження аналогічного механізму у програмі «Доступні ліки» підвищило б конкуренцію та суттєво знизило ризики зловживання. Проте сьогодні Уряд позиціонує програму «Доступні ліки» як шлях до забезпечення населення безкоштовними ліками. Тому перспектива запровадження копейменту наразі виглядає сумнівною.
Як же досягти створення конкуренції в сегменті безкоштовних ліків?
Один із шляхів — запровадження медіанного підходу. Тобто в сегменті лікарських засобів, вартість яких не перевищує граничний рівень, розрахований на основі референтного ціноутворення, необхідно здійснити розподіл за медіанним принципом залежно від вартості добової дози на дві групи. При цьому препарати I групи відшкодовувати на 100%, а ІI групи — частково. Розмір часткового відшкодування визначатиметься за принципом, який використовувався під час Пілотного проекту. Тобто розмір часткового відшкодування (референтна ціна) 1 упаковки дорівнюватиме:
Цреф= ГрРВуп х ГВДДм/ГВДД,
де Цреф — рівень часткового відшкодування;
ГрРВуп — гранична роздрібна вартість упаковки препарату, який підпадає під часткове відшкодування вартості (розрахована на основі задекларованої виробником оптово-відпускної ціни з урахуванням оптової та роздрібної націнок та ПДВ);
ГВДДм — гранична роздрібна вартість добової дози споживання, яка дорівнює медіанній вартості добової дози споживання лікарського засобу, що визначається у діапазоні препаратів, вартість яких є нижчою за граничний рівень, розрахований на основі референтного ціноутворення;
ГВДД — гранична роздрібна вартість встановленої добової дози споживання препарату (розрахована на основі задекларованої виробником оптово-відпускної ціни).
Наша редакція розрахувала, як зміняться обсяги державного фінансування та доплати пацієнтів при запровадженні такої моделі.
За підсумками 2016 р., при існуючій моделі відшкодування вартості та націнці у 15% обсяги коштів, необхідних для відшкодування вартості всіх реалізованих лікарських засобів, включених до програми реімбурсації, становлять 525,7 млн грн., а обсяги доплати пацієнтів — 282,6 млн грн. При цьому у 2016 р. на ринку реалізовувалося 29 препаратів, вартість яких відшкодовується повністю.
При запровадженні медіанного принципу обсяги коштів, необхідних для відшкодування вартості всіх реалізованих лікарських засобів, становлять 746 млн грн., а обсяги доплати пацієнтів — 62,3 млн грн.
Таким чином, обсяги державного фінансування збільшаться на 42%, а обсяги доплати пацієнтів зменшаться майже на 80%. Проте кількість препаратів, вартість яких відшкодовуватиметься повністю, збільшиться з 29 до 98. При цьому безкоштовні препарати з’являться для кожного дозування лікарських засобів у межах кожного МНН. Такий підхід суттєво підвищить конкуренцію у сегменті безкоштовних ліків, що надасть пацієнту право вибору безкоштовного препарату з необхідним дозуванням.
Зауважимо, що при запровадженні медіанного принципу та встановленні граничної націнки на рівні 25% обсяги коштів, необхідних на відшкодування вартості, становитимуть 811 млн грн. Таким чином, коштів, виділених Урядом на наступний рік, цілком вистачить.
Ще одним варіантом підвищення конкуренції в сегменті безкоштовних лікарських засобів може бути принцип дисперсії. Тобто під повне відшкодування вартості підпадатимуть препарати, вартість яких є вищою за найдешевший на певний відсоток. Ми розрахували, як зміниться кількість безкоштовних препаратів при встановленні граничної вартості повного відшкодування на рівні 5; 10 та 20% вартості найдешевшого препарату.
Так, за підсумками 2016 р., за існуючої моделі відшкодування на ринку реалізовувалось 29 препаратів, вартість яких відшкодовується повністю. При підвищенні рівня 100% відшкодування на 5% від вартості найдешевшого кількість безкоштовних препаратів збільшиться до 44, на 10% — до 48, на 20% — до 56.
Крім того, для підвищення конкуренції в сегменті безкоштовних лікарських засобів можна розглянути можливості надання виробникам дозволу реалізовувати лікарські засоби за ціною найдешевшого препарату з групи. При цьому виробник зазначатиме на упаковці роздрібну ціну, яка відповідатиме рівню повного відшкодування, та інформацію про те, що це вартість препарату виключно для реалізації в межах програми «Доступні ліки».
Іншими словами, необхідно надати виробнику можливість провести пілотний проект щодо реалізації лікарських засобів у межах програми відшкодування за нижчими цінами, ніж вони задекларували для сегменту державних закупівель. Надання такої можливості дозволить виробникам гнучко управляти ціною в різних сегментах ринку і мотивуватиме їх знижувати ціну до рівня повного відшкодування. Для початку його можна запровадити у якості пілотного проекту та через деякий час оцінити ефект від такої регуляції.
ВИСНОВКИ
Підвищення роздрібної надбавки на лікарські засоби, включені до урядової програми «Доступні ліки», до 25% мотивуватиме аптечні заклади та виробників долучатися до цієї програми. Навіть якщо держава погодиться на запровадження медіани при визначенні рівня повного відшкодування та поверне 25% роздрібну надбавку, то запланованого обсягу фінансування цілком вистачить. Натомість якщо цього не зробити, то освоїти 1 млрд грн. буде дуже складно.
Одним з можливих шляхів удосконалення програми вбачається створення сприятливих умов для розвитку конкуренції в сегменті препаратів, вартість яких повністю відшкодовується державою. Найбільш прийнятна модель, яка дозволяє суттєво мінімізувати ризики зловживань, — запровадження копейменту (співоплати).
Але якщо залишиться існуюча на сьогодні модель, за якої зберігається повне відшкодування вартості окремих препаратів з боку держави, то доцільно надати виробникам можливість без регуляторних наслідків робити спроби щодо зниження вартості лікарського засобу до рівня повного відшкодування виключно для реалізації в межах програми «Доступні ліки».

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим