|
(по материалам семинара, состоявшегося в рамках конференции |
|
По обеспеченности здравоохранения основными ресурсами, по уровню экономического развития Украину трудно сравнивать с другими странами Европы, особенно Центральной. Практически все стороны жизни страны проходят период становления. И только отдельные сферы, например, организация и проведение КИ, в своем динамичном развитии набирают обороты очень быстро, привлекая значительные инвестиции из-за рубежа. У нашей страны огромный потенциал в этой сфере, учитывая количество ЛПУ, хорошо проработанную законодательно-нормативную базу, накопленный в регуляторной сфере опыт.
 ГФЦ регулярно организовывает обучающие семинары во время различных профильных конференций, и состоявшаяся 31 мая — 1 июня конференция по фармаконадзору не стала исключением. Программа однодневного семинара включала доклад руководителя отдела координации и контроля клинических испытаний лекарст-венных средств ГФЦ МЗ Украины, профессора Владимира Мальцева, и лекции о порядке проведения КИ лекарственных средств в Украине, об основных видах их дизайна и классификации КИ по фазам, этических аспектах КИ, обязанностях спонсора и исследователя, основных документах исследования, а также о регуляторных инспекциях клинических баз и контрактных исследовательских организаций. Все лекции читали представители ГФЦ МЗ Украины — заместитель начальника отдела координации клинических испытаний
ГФЦ регулярно организовывает обучающие семинары во время различных профильных конференций, и состоявшаяся 31 мая — 1 июня конференция по фармаконадзору не стала исключением. Программа однодневного семинара включала доклад руководителя отдела координации и контроля клинических испытаний лекарст-венных средств ГФЦ МЗ Украины, профессора Владимира Мальцева, и лекции о порядке проведения КИ лекарственных средств в Украине, об основных видах их дизайна и классификации КИ по фазам, этических аспектах КИ, обязанностях спонсора и исследователя, основных документах исследования, а также о регуляторных инспекциях клинических баз и контрактных исследовательских организаций. Все лекции читали представители ГФЦ МЗ Украины — заместитель начальника отдела координации клинических испытаний  Татьяна Ефимцева, эксперт отделения аттестации и инспекции клинических баз Сергей Распутняк и руководитель отдела аттестации и инспекции клинических баз Людмила Ковтун. Таким образом, на семинаре были освещены все разделы руководства по надлежащей клинической практике Международной конференции по гармонизации (International Conference of Harmonization Good Clinical Practice — ICH GCP), а также основные украинские приказы и руководства.
Татьяна Ефимцева, эксперт отделения аттестации и инспекции клинических баз Сергей Распутняк и руководитель отдела аттестации и инспекции клинических баз Людмила Ковтун. Таким образом, на семинаре были освещены все разделы руководства по надлежащей клинической практике Международной конференции по гармонизации (International Conference of Harmonization Good Clinical Practice — ICH GCP), а также основные украинские приказы и руководства.
То, что Украина занимает все более прочные позиции в мире КИ, подтверждалось и широким географическим кругом участников: представители регуляторных органов Узбекистана и Молдовы, например, с интересом слушали доклады, задавали вопросы и перенимали опыт своих украинских коллег, а участники из Прибалтики смогли лучше разобраться в украинской регуляторной базе, врачи и представители фармацевтического бизнеса из разных уголков Украины получили новые знания о правилах проведения КИ, нашли ответы на сложные вопросы и, безусловно, все они имели возможность эффективно пообщаться друг с другом в перерывах.
В. Мальцев в своем вступительном докладе остановился на основных тенденциях развития сферы R&D фармацевтической промышленности — рост затрат отрасли при уменьшении количества одобренных препаратов (только 18 новых лекарственных средств одобрено Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) в 2006 г.), усиление партнерства с биотехнологической промышленностью, увеличение средних временных затрат на разработку новых препаратов. Он привел определение понятия «клиническое испытание» и подчеркнул, что регуляторные органы при регистрации лекарственных средств полагаются именно на данные КИ, что обусловливает важность их правильной организации и проведения. В. Мальцев акцентировал внимание слушателей на том, что прием лекарственного средства всегда несет определенную долю риска для организаторов, а риск, которому подвергаются испытуемые в течение КИ, еще выше. Согласившись с периодизацией, предложенной руководителем специализированной магистерской программы по подготовке специалистов по КИ Дрексельского университета Уильяма Хиршхорна (William Hirschhorn) на весеннем семинаре для украинских врачей, В. Мальцев выделил восемь шагов КИ (рис. 1).
|
Докладчик рассказал слушателям об основополагающих этических принципах, соответствующих международных документах (Нюрнбергском кодексе, Хельсинкской декларации, Бельмонтском отчете), структуре и деятельности ICH и зарождении правил GCP. Интересно, что впервые эти правила были разработаны в США сравнительно недавно — в 1977 г., в Европе принципы GCP начали внедрять только в 1990 г., а уже через 6 лет, в 1996 г., в Украине также появилась соответствующая нормативно-правовая база. В. Мальцев упомянул об основных документах КИ и особо остановился на роли исследователя. Так, он рекомендовал исследователям перед началом любого испытания задавать себе ряд вопросов (рис. 2).
|
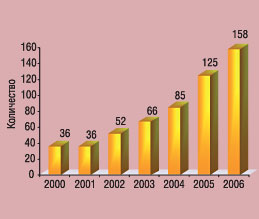
В. Мальцев подчеркнул также, что в США и Евросоюзе существуют так называемые черные списки исследователей, которые были замечены в фальсификации данных и других серьезных нарушениях. Докладчик рассказал подробно об основных нормативно-правовых документах, регулирующих проведение КИ в Украине, и отметил, что приказ МЗ Украины № 66 был разработан именно для гармонизации национальных требований с современными международными стандартами. Успехи Украины в сфере КИ подтверждаются и статистическими данными — неуклонно с каждым годом растет количество КИ, регистрируемых в Украине: в 2006 г. 322 КИ, из которых 158 международных (в 2000 г. — только 36 международных КИ, в 2002 г. — 52, а в 2004 г. — 85) (рис. 3). На протяжении последних 7 лет наблюдается стабильная позитивная динамика зарегистрированных международных КИ: на протяжении всего этого времени наблюдался ежегодный прирост на уровне 30–40%. Соответственно, увеличивается количество пациентов, включенных в эти исследования (на 2006 г. было запланировано включение 17 тыс. пациентов с различными заболеваниями).
|
Это говорит о том, что за последние 10–15 лет Украина заслужила доверие среди фармацевтических фирм. Неуклонно растет и число компаний, занимающихся организацией КИ (33 контрактные исследовательские организации, заказывающие около 90% КИ, и 11 представительств фармацевтических компаний, регистрирующих остальные 10%), а также количество врачей, задействованных в них (396 клинических баз согласно приказу МЗ Украины № 560). В заключение В. Мальцев подчеркнул, что стратегия интеграции Украины в ЕС требует дальнейшей гармонизации системы регламентации в отношении лекарственных средств в Украине со стандартами и директивами ЕС, а значит, и дальнейшего усовершенствования регуляторной базы проведения КИ.
Лекции, представленные в рамках семинара, были очень информативными и содержательными, полностью отвечали заявленной тематике и поглотили внимание аудитории. Т. Ефимцева рассказала о действующем в Украине порядке проведения КИ, коснулась временных интервалов рассмотрения документов и порядка отчетности о нежелательных явлениях; отдельный ее доклад был посвящен описанию различных видов дизайна КИ и технологий их проведения.
 Л. Ковтун в своей лекции, посвященной этическим аспектам проведения КИ, подробно остановилась на процедуре информирования пациентов и подписания информированного согласия. Важность этого вопроса трудно переоценить, поскольку права пациента и защита его интересов стоят выше интересов общества и науки в целом. Л. Ковтун подчеркнула, что пациент дает добровольное информированное согласие, во-первых, на участие в исследовании, а во-вторых, на использование его клинических данных в анализе, и врач обязан убедиться в том, что пациент понимает и принимает оба пункта. В случае, когда пациент не может лично подписать документ, согласие может подписать законный представитель. Здесь крайне важно понимать, что такое «законный представитель», чтобы действовать в рамках правового поля. Законный представитель — это физическое или юридическое лицо, имеющее юридические основания представлять потенциального испытуемого и подписывать от его имени официальные документы, в том числе согласие на участие в исследовании. В украинском законодательстве четко прописано, кто может быть законным представителем недееспособного пациента, и этот перечень внесен в приказ № 66.
Л. Ковтун в своей лекции, посвященной этическим аспектам проведения КИ, подробно остановилась на процедуре информирования пациентов и подписания информированного согласия. Важность этого вопроса трудно переоценить, поскольку права пациента и защита его интересов стоят выше интересов общества и науки в целом. Л. Ковтун подчеркнула, что пациент дает добровольное информированное согласие, во-первых, на участие в исследовании, а во-вторых, на использование его клинических данных в анализе, и врач обязан убедиться в том, что пациент понимает и принимает оба пункта. В случае, когда пациент не может лично подписать документ, согласие может подписать законный представитель. Здесь крайне важно понимать, что такое «законный представитель», чтобы действовать в рамках правового поля. Законный представитель — это физическое или юридическое лицо, имеющее юридические основания представлять потенциального испытуемого и подписывать от его имени официальные документы, в том числе согласие на участие в исследовании. В украинском законодательстве четко прописано, кто может быть законным представителем недееспособного пациента, и этот перечень внесен в приказ № 66.
Л. Ковтун остановилась также на еще одном термине из ICH GCP — «незаитересованный свидетель» — это физическое лицо, не участвующее в проведении исследования, которое присутствует при процедуре информированного согласия и подписания формы. Необходимость подписи такого независимого свидетеля может предусматриваться отдельными протоколами, связанными с лечением неотложных состояний, и нарушения в этой процедуре могут стать очень серьезной находкой при инспекции регуляторных органов.
С. Распутняк рассказал об обязанностях основных сторон КИ — спонсора, исследователя и контрактной исследовательской организации, коснулся методов обеспечения качества КИ (в том числе обычного мониторинга, аудитов и инспекций). Также он остановился на перечне документов, которые должны храниться на клинической базе и/ или у спонсора КИ до его начала, во время проведения испытания и после его окончания и закрытия исследования на клинической базе.
Отдельная лекция, представленная также Л. Ковтун, была посвящена регуляторным инспекциям КИ в Украине. Так, всего сотрудниками ГФЦ к 2007 г. было проведено 316 инспекций КИ (в 2004 г. — 36, в 2005 г. — 40, в 2006 г. — 47). По их результатам было приостановлено 18 КИ и полностью прекращены 2 (эти статистические данные касаются как международных многоцентровых КИ, так и КИ национального уровня). Интересен перечень наиболее часто встречающихся нарушений, выявленных при регулярных инспекциях ГФЦ. К ним относятся: (1) плохое знание протокола и своих обязанностей, недоукомплектованность файла исследователя; (2) нарушение маркировки, условий хранения и распределения исследуемого препарата; (3) нарушение процедуры получения информированного согласия; (4) замечания по ведению индивидуальных регистрационных форм; (5) нарушение процедуры предоставления информации о побочных реакциях; (6) замечания по ведению первичной документации или ее отсутствие. Л. Ковтун подчеркнула, что основанием для дисквалификации исследователей может быть выявленная фальсификация данных КИ, повторяющиеся нарушения при проведении КИ, нарушение этических норм, сокрытие информации о побочных реакциях, отказ от инспекционных проверок.
В заключение хотелось бы подчеркнуть, что очень важно, когда тренинг по принципам и правилам проведения КИ проводят именно представители национальных регуляторных органов (стоит отметить, что Украина и в этом опережает многих своих соседей: семинары такого формата — редкость для многих стран). Ведь в таком случае разговор идет не просто о международных правилах, а о конкретной их интерпретации, связи с национальным законодательством и, что самое важное, о практическом их применении в конкретной стране, Украине. Будем надеяться, что подобная практика будет продолжаться, и мы еще не раз расскажем о таких обучающих семинарах на страницах нашего издания. n
Пресс-служба «Еженедельника АПТЕКА»,
фото Елены Старостенко
и предоставленные
организаторами конференции



Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим