РЕФЕРЕНТНИЙ ПРЕПАРАТ (лат. referens — сповіщальний, засвідчувальний, рекомендаційний) у фармації — препарат, який використовується як стандарт, що засвідчує якість, ефективність та безпеку нового відтвореного ЛП, який виводиться на фармринок. Зазвичай як Р.п. використовують оригінальний, або інноваційний, препарат, якість, ефективність та безпека якого всебічно вивчені, а також обґрунтований зв’язок основних його властивостей з особливостями фармацевтичної розробки (див. Фармацевтична розробка). За відсутності оригінального, або інноваційного, ЛП на фармринку країни ВООЗ рекомендує як Р.п. використовувати відтворений ЛП (генерик), що є лідером ринку, був зареєстрований за повним реєстраційним досьє і може розглядатися як препарат порівняння. Препарат-копія та препарат-стандарт повинні мати ідентичний АФІ, його дозу (силу дії), ідентичну лікарську форму і виготовлятися відповідно до вимог GMP. У США з метою уникнення непорозумінь рекомендується звертатися до регуляторних органів за підтвердженням правильності вибору Р.п. З цією метою заздалегідь регуляторним органом складається і затверджується перелік Р.п. та рекомендації вивчення біоеквівалентності відтвореного ЛП шляхом порівняння із стандартом, що дозволяє значно знизити вартість та прискорити його виведення на фармринок. У кожному конкретному випадку обґрунтовується вибір Р.п. відповідно до фармацевтичної розробки відтвореного ЛП. Найважливішою проблемою при цьому є обґрунтування біоеквівалентності відтвореного ЛП порівняно з Р.п. за допомогою необхідних і доступних методик. У разі підтвердження терапевтичної еквівалентності препарату-копії відповідно до Р.п. його відносять до групи «А», а якщо вона не доведена, позначають буквою «Б». З часом, коли змінюється інформація про біоеквівалентність відтвореного ЛП, коди також можуть змінюватись. Таке кодування значно підвищує інформативність відтворених ЛП, присутніх на фармринку, і дозволяє професійно їх призначати (рекомендувати) та використовувати.
Вибір Р.п. при поданні скороченої заявки на одержання дозволу на маркетинг препарату-копії у різних країнах може бути різним, наприклад, в країнах ЄС переліків Р.п. не існує. Р.п. визначається заявником разом з регуляторним органом (Директива 2001/83/ЕС). ВООЗ як регуляторний орган, що тісно співпрацює з підприємствами фармацевтичної галузі різних країн у складанні переліку Р.п., закликає виробників, що прагнуть вивести на ринок відтворений ЛП, враховувати найвищі вимоги, які висуваються до якості ліків вітчизняним регуляторним органом.

Літ.: Бухтиарова Т.А. Нам важно знать, что волнует заявителей // Еженедельник АПТЕКА. — 2006. — № 47; Критерии выбора референтных препаратов // Там же, 2006. — № 47.
КЛАСИФІКАЦІЙНІ СИСТЕМИ ЛІКАРСЬКИХ ПРЕПАРАТІВ (лат. classis — розряд, клас + facio — роблю, розкладаю та гр. systema — ціле, складене з частин) — система супідрядних понять у певній сфері, яка використовується як засіб для встановлення зв’язків або орієнтації в різноманітних поняттях відповідних об’єктів. У фармації К.с. виконують функцію «загальної мови» уніфікованого опису номенклатури ліків, присутніх на фармринку, з метою порівняння обсягу їх споживання на національному або міжнародному рівнях. Іншими словами, К.с. забезпечують порівняння стандартизованої та валідованої інформації про використання ЛП з метою аудиту (див. Аудит) структури їх споживання, виявлення недоліків при використанні, ініціювання освітніх та інших спеціальних заходів (наприклад класифікації побічних реакцій ЛП, вивчення структури споживання антибіотиків у різних регіонах або окремих країнах з метою посилення боротьби з антибіотикорезистентністю тощо), а також моніторингу (див. Моніторинг) кінцевих результатів цих заходів.
У другій половині ХХ ст. ВООЗ було запропоновано декілька уніфікованих систематик ліків, позбавлених недоліків класифікацій, що застосовувались раніше (див. Лікарський препарат). Вони поєднали декілька класифікаційних принципів: механізм дії ліків, показання до застосування та хімічну структуру присутнього АФІ. На сьогодні широко використовується Анатомо-терапевтично-хімічна — АТХ (Anatomical Therapeutic Chemical — АТС) К.с. з метою одержання статистичних даних про споживання ліків на регіональному або міжнародному рівні, вивчення ринку ЛП, потреби їх виробництва, класифікації побічних реакцій ЛП та в інших випадках. За допомогою К.с. АТХ можна кодувати ЛП, визначати їх можливе використання в терапії, силу дії та склад. Відповідно до К.с. АТХ усі ЛП поділяються на основні групи п’яти рівнів залежно від їх дії на певний анатомічний орган або систему, а також від їх хімічних, фармакологічних, терапевтичних і хімічних властивостей. На першому рівні нараховується 14 основних анатомічних груп, позначених однією латинською літерою: А — ЛП, що впливають на травну систему та метаболізм; В — ЛП, що впливають на систему крові та гемопоез; С — ЛП, що впливають на серцево-судинну систему і т.д. Кожна група, в свою чергу, поділяється на терапевтичні/фармакологічні підгрупи (другий та третій рівні). Четвертий рівень представлений терапевтичними/фармакологічними/хімічними підгрупами; п’ятий — хімічною речовиною (АФІ). Другий — четвертий рівень ЛП нерідко використовують для визначення фармакологічних підгруп (коли це є більш адекватним, ніж визначення терапевтичних та хімічних підгруп).
Структуру кодування ЛП за К.с. АТХ можна простежити на прикладі повної класифікації глібенкламіду:
А ЛП, які впливають на травну систему та метаболізм (перший рівень, головна анатомічна група, позначається однією літерою).
А10 Антидіабетичні ЛП (другий рівень, головна терапевтична група, позначається двома цифрами).
А10В Пероральні гіпоглікемічні препарати (третій рівень, терапевтична/фармакологічна підгрупа, позначається однією латинською літерою).
А10В В Сульфонаміди, похідні сечовини (четвертий рівень, терапевтична/фармакологічна/хімічна підгрупа, позначається однією латинською літерою).
А10В В01 Глібенкламід (п’ятий рівень — хімічна речовина, позначається двома цифрами).
Відповідно до К.с. АТХ усім некомбінованим ЛП, які містять глібенкламід, надається код А10В В01. У разі, якщо ЛП містить фурасемід, то він буде мати такий за АТХ код — С03С А01, який означає, що:
С — ЛП впливає на серцево-судинну систему.
С03 — Належить до основної терапевтичної групи сечогінних ЛП.
С03С — Терапевтична (фармакологічна) підгрупа високоактивних діуретиків.
С03С А — З хіміко-терапевтичної підгрупи простих сульфаніламідів.
С03С А01 — Містить хімічну речовину (АФІ) фуросемід.
Таким чином, ЛП класифікують за основним показанням до медичного застосування із збереженням базового принципу — кожному ЛП (певного складу, сили дії і ЛФ) надається тільки один АТХ-код. Більше одного АТХ-коду може бути надано ЛП, які виробляються в двох або більше дозуваннях (сила дії) або ЛФ з чітким розмежуванням показань до медичного застосування. Наприклад: 1. Статеві гормони в певних ЛФ або з певною силою дії використовуються винятково в терапії злоякісних пухлин і тому класифікуються за кодом L02 — препарати, що використовуються для гормональної терапії. Препаратом в інших ЛФ або з іншою силою дії надають класифікаційний код G03 — гормони статевих залоз і ЛП, що застосовують при патології статевої сфери. 2. ЛП з бромокриптином можуть вироблятися з різним дозуванням. Так, таблетки з низькою дозою АФІ використовують як інгібітор синтезу пролактину, їм надається код G02, тобто ЛП, що застосовується в гінекології, а таблетки бромокриптину з вищою дозою використовуються в терапії паркінсонізму і мають АТХ-код N04 — протипаркінсонічні ЛП. Отже, ЛП з різним складом і ЛФ, які мають різні показання до застосування, також можуть мати різні АТХ-коди, що можна продемонструвати на прикладі ліків з преднізолоном:
А07Е А01 Протизапальні ЛП, які застосовуються при хворобах кишечнику (клізми і ректальні піноутворювальні засоби).
С05А А04 Антигемороїдальні ЛП для місцевого застосування (ректальні супозиторії).
D07А А03 Кортикостероїди, що застосовуються в дерматології (мазі, креми, гелі).
Н02А В06 Кортикостероїди для системного застосування (розчини для ін’єкцій, таблетки).
R01A D02 ЛП протинабрякової дії та інші для місцевого застосування при хворобах порожнини носа (назальні спреї, краплі).
S01В А04 ЛП, що застосовують в офтальмології (очні краплі).
S02В А03 ЛП, що застосовують в отології (вушні краплі).
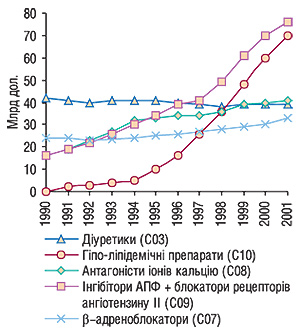
Система АТХ не є виключно терапевтичною К.с. На всіх її рівнях АТХ-коди можуть надаватись відповідно до фармакологічних властивостей ЛП, де переважає механізм їх дії, що не завжди бажано, наприклад, у разі антидепресантів. Деякі АТХ-групи ЛП поділяють на хімічні і фармакологічні групи (наприклад АТХ-група J05А — противірусні препарати прямої дії; якщо нова лікарська речовина відповідає обом групам, перевагу віддають фармакологічній). АФІ, які посідають в К.с. однаковий четвертий рівень, не слід розглядати як еквівалентні за фармакотерапевтичною дією, оскільки особливості механізмів їх дії, терапевтичних ефектів, взаємодії з іншими ЛП та побічні реакції можуть відрізнятися. Інформація про ЛП за К.с. АТХ може бути надана на різних рівнях, наприклад, від загальних статистичних даних використання усіх ЛП, які впливають на серцево-судинну систему (перший рівень), до показників за різними підгрупами (другий, третій та четвертий рівень) і використання окремих діючих речовин. Більш докладну інформацію можна отримати на нижчих (четвертому і п’ятому) рівнях. Більш високі рівні використовують тоді, коли необхідно порівняти обсяги споживання окремих груп ЛП або мати уявлення про тенденції споживання ЛП в різних терапевтичних (медичних) напрямках (рис. 1).
|
К.с. АТХ дозволяє виробити національну політику з регулювання ліків на ринку та активно впливати на якість надання фармакотерапії (правильне призначення ЛП, дозування, передбачення можливих взаємодій і побічних реакцій, врахування вікових, генетичних та інших особливостей стану пацієнта), моніторинг загального обсягу витрат ЛП, контроль результативності фармакотерапії тощо.
Однак порівняння обсягу використаних ЛП та їх вартості в різних країнах неможливе без визначення кількісних обсягів споживання ЛП або обсягів певних АФІ. З цією метою в 70-ті роки ХХ ст. була експериментально розроблена нова умовна одиниця виміру споживання ліків або «узгоджена добова доза», яка згодом була перейменована в «defined daily dose (DDD) — визначена добова доза». Цю одиницю визначають як середню підтримувальну дозу ЛП, що застосовується за його основним показанням у дорослих. Застосування цієї умовної одиниці виміру значно розширило можливості К.с. АТХ. У 1996 р. уніфікована К.с. АТС/DDD була рекомендована ВООЗ як міжнародний стандарт при проведенні аналізу кількості споживання ЛП у різних країнах. З 2000 р. рекомендована в маркетингових дослідженнях ЛП на фармринку України (лист МОЗ України № 1801.05/907 від 30.05.2000 р.).
Для систематики та ідентифікації ЛП, присутніх на фармринку переважно у вигляді торговельних марок та генериків, придатною є К.с. міжнародних непатентованих назв (МНН) — International Nonproprietary Nomes (INN). К.с. МНН була розроблена норвезькими вченими та рекомендована ВООЗ у середині ХХ ст. За цією класифікацією кожній активній субстанції надається тільки одна назва, що робить її придатною для ідентифікації присутніх на ринку ЛП та контролю їх обігу. Система МНН використовується при маркуванні ЛП, рекламі, систематизації ЛП у міжнародній та національних фармакопеях, у науковій і довідковій літературі, у мережі Інтернет, при захисті прав інтелектуальної власності, в назвах генеричних препаратів та в багатьох інших випадках, включаючи національну реєстрацію (ліцензуваня) ЛП.
Існує також біофармацевтична класифікаційна система, яка використовується для обґрунтування необхідності проведення випробувань біодоступності або біоеквівалентності ЛП чи АФІ (див. Біофармацевтична класифікаційна система).
Використання К.с. — справа трудомістка і потребує певних навичок та підготовки. Труднощі класифікації ЛП за будь-якою К.с. пояснюються можливістю використання ЛП за двома і більше однаково важливими показаннями та відмінностями основних показань до застосування у різних країнах, використання різних термінологічних одиниць (неоднозначних термінів) і впливом національних традицій на ці показники. Крім того, не завжди можна отримати прямі порівняльні дані навіть за допомогою уніфікованих К.с., які також мають дещо умовну систематику ЛП. Проте активне впровадження уніфікованих К.с. на сьогодні є потужним імпульсом для проведення національних досліджень у сфері споживання ЛП, оптимізації їх використання та створення дієздатних систем контролю якості.
Літ.: Еженедельник АПТЕКА. — 2004 — № 21; Еженедельник АПТЕКА. — 2005. — № 2; БСЭ — М., 1973 — Т. 12; 1976 — Т. 23; Guidelines for ATC classification and DDD Assignment Oslo, Norway, WHO Collaborating Centre for Drug Statistics Methodology, 2003; Running M et al. Different versions of the anatomical therapeutic chemical classification system and the defined daily dose — are drug utilization data comparable? // European Journal of Clinical Pharmacology. — 2000. — № 56.
ЛІКАРСЬКА ФОРМА — проміжний стан лікарської системи у процесі виготовлення ЛП, який забезпечує його оптимальний (з погляду фармакокінетики) терапевтичний ефект при мінімальній побічній дії та зручність при застосуванні та зберіганні. В повсякденній медичній практиці використовують найрізноманітніші ЛФ з урахуванням стану хворого, його віку та інших чинників. Однак протягом тривалого часу при розробленні ліків, їх виробництві та призначенні головна увага приділялась не ЛФ, а АФІ та його дозі у ЛП. Раніше ЛФ розглядали як більш-менш зручне вмістилище, що забезпечує збереження і доставку субстанції до місця всмоктування (див. Абсорбція ліків) та є зручною для хворого. Після встановлення впливу фармацевтичних чинників на терапевтичну ефективність ліків (див. Біологічна фармація) була переглянута і значимість ЛФ. Експериментально-клінічні дослідження довели, що вид ЛФ може суттєво впливати на ступінь абсорбції АФІ та її концентрацію в біологічних рідинах (див. Біологічна доступність ліків). Наприклад, концентрація спіронолактону в крові коливається в діапазоні 0,06–3,75 мкг/л при використанні однакових доз у пероральних ЛФ (таблетках, капсулах, драже, гранулах), незважаючи на їх повну відповідність вимогам Фармакопеї. Біофармацевтичні дослідження підтвердили також вплив ЛФ на прояв небажаних реакцій на введені ліки. Наприклад, тривала терапія з використанням супозиторіїв з індометацином проходить без помітних ускладнень при задовільному лікувальному ефекті, тоді як застосування таблеток з індометацином призводить до різноманітних побічних явищ, навіть до виразки та кровотечі в ШКТ. Небажані прояви відмічають і при застосуванні пероральних ЛФ з деякими серцевими глікозидами, в той час як використання ін’єкційних розчинів та супозиторіїв з цими ж АФІ дозволяє повністю або частково виключити їх небажану побічну дію.
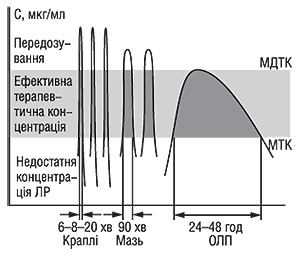
Розглядаючи ЛФ з біофармацевтичних позицій, необхідно переглянути й критерії їх класифікації. Найбільш доцільно при класифікації враховувати вплив виду ЛФ на ефективність і безпеку ліків як основних показників якості останніх. Порівнюючи офтальмологічні ЛФ у вигляді крапель, мазей та лікарських плівок (рис. 3), які містять один і той же АФІ, можна стверджувати, що основним недоліком очних крапель і мазей є їх недостатня терапевтична ефективність порівняно з очними плівками, зумовлена властивостями ЛФ (терапевтична концентрація лікарської речовини на слизовій оболнці ока триває протягом 20, 50 хв і 24–48 год відповідно). Можливе також передозування АФІ в краплях та мазях і значне (до 80%) їх видалення з поверхні слизової оболонки слізною рідиною. При використанні очних лікарських плівок їх поступова розчинність регулюється більш оптимальним носієм (потрійним складом співполімерів). Крім того, краплі слід застосовувати до 12 разів, мазі — 6, тоді як плівки — 1 раз на добу. Зазначені ЛФ мають також різні характеристики щодо терміну лікування, кількості процедур, терміну зберігання та ін.
|
В основу існуючих класифікацій ЛФ, які наведені в навчальній літературі, покладено різні принципи: шляхи уведення, способи призначення, агрегатний стан, властивості дисперсного середовища (дисперсологічна класифікація) та ін. За класифікацією з урахуванням шляхів введення ліків ЛФ поділяється на: а) ентеральні, що вводяться через ШКТ, а саме: пероральні (таблетки, капсули, драже, гранули, порошки, мікрокапсули, розчини, суспензії, емульсії, настої, відвари, настойки, сиропи, желе та ін.) та сублінгвальні (таблетки, капсули, драже, порошки, таблетки для смоктання (жування), розчини тощо); б) парентеральні, що вводяться не через ШКТ, а саме: у вигляді ін’єкцій (розчини, порошки і таблетки для отримання розчинів, суспензії та емульсії для ін’єкцій, ліпосомальні системи, таблетки і капсули для імплантацій та ін.); в) ректальні (супозиторії, капсули, мазі піно- та плівкоутворювальні аерозолі, розчини, суспензії, емульсії у вигляді мікроклізм та зрошення); г) для нанесення на слизові оболонки: вагінальні (кульки, песарії, мазі, таблетки, розчини, емульсії тощо) та очні (краплі, мазі, плівки, розчини для зрошування та ін.); д) уретральні (палички); е) для нанесення на шкіру (мазі, креми, гелі, пасти, порошки, пінні та плівкоутворювальні аерозолі тощо). Класифікація ЛФ залежно від шляху їх уведення і терапевтичного призначення, запропонована Я.І. Хаджаєм, є більш сучасною, але й набагато складнішою, а тому майже не використовується. З цих же причин не використовується і дисперсологічна класифікація ЛФ. Класифікація ЛФ за технологічними ознаками з точки зору порівняння їх терапевтичної ефективності менш приваблива. Так, пресовані таблетки і супозиторії мають подібну технологію, але з біофармацевтичної та клінічної точок зору ми маємо справу з різними ЛФ, які вводяться різними шляхами і мають різні фармакокінетичні умови просування лікарської субстанції в організмі, що визначає різний рівень їх ефективності. За цими ж ознаками небажано об’єднувати в одну групу такі ЛФ, як мазі, супозиторії та ін., що за технологічними та зовнішніми ознаками належать до м’яких ЛФ. Однак класифікація ЛФ за агрегатним станом — приваблива і зручна з огляду на вивчення технології ліків і традиційно використовується в навчальній літературі. За цією класифікацією ЛФ поділяють на: тверді (таблетки, драже, гранули, порошки, збори, капсули та ін.); м’які (мазі, креми, гелі, супозиторії, пластирі та ін.); рідкі (різні розчини, суспензії, емульсії, настої, відвари, настойки, екстракти та ін.); газоподібні (аерозолі, гази, пари тощо).
Усі запропоновані класифікації ЛФ відображають окремі сторони теорії та практики застосування ліків і використовуються в різних (особливо навчальних) джерелах залежно від поставлених завдань. На сьогодні класифікації ЛФ повинні враховувати не тільки властивості, агрегатний стан і технологію приготування ліків, але й їх біологічну функцію (біодоступність), що має першочергове значення, оскільки оптимальний вибір виду ЛФ та шлях уведення ліків в організм визначає ефективність фармакотерапії.
Літ.: БМЭ. — М., 1980; Гандель В.Г., Ажгихин И.С., Печенников В.М. Избранные очерки современной теории и практики производства лекарств. — Пермь, 1975; Тенцова А.И., Ажгихин И.С. Лекарственная форма и терапевтическая эффективность лекарств. — М., 1974; Фармацевтичні та медико-біологічні аспекти ліків / За ред. І.М. Перцева. — Вінниця, 2007.
НЕЯКІСНІ ЛІКИ. Ліки є особливою фармацевтичною продукцією, яка повинна бути якісною, мати постійні терапевтичні та інші характеристики і не виявляти помітних небажаних ефектів. На жаль, на фармринку, крім якісних ліків, можуть знаходитись так звані Н.л., або проблемні (фальсифіковані, субстандартні та незареєстровані). Ця група ліків може бути присутня як в легальних, так і нелегальних каналах збуту фармацевтичної продукції.
Фальсифіковані (контрафактні) ліки — це ЛП, які навмисно і протиправно неправильно промарковані щодо їх ідентичності та назви виробника. Згідно з визначенням ВООЗ виділяють такі чотири типи фальсифікатів: не містять АФІ, зазначених на етикетці; містять інші, ніж вказані на етикетці, компоненти; мають відповідну кількість АФІ, але іншого походження; містять АФІ в кількості, що не відповідає заявленим на етикетці, або містять домішки. Крім того, фальсифіковані ліки можуть бути присутні на ринку в підробленій упаковці. У будь-якому випадку — це свідоме виробництво та реалізація Н.л. з метою одержання незаконного прибутку і стосується як оригінальних (інноваційних), так і відтворених (генеричних) ЛП. Ліки, виготовлені легальним виробником, які за відсутності належних умов виробництва, транспортування та зберігання втратили властивості, визначені АНД, належать також до групи неякісних, або субстандартних. Незареєстровані ліки — це ліки, що не пройшли процедуру реєстрації, внаслідок чого не занесені до Державного реєстру лікарських засобів.
На жаль, обіг Н.л. набув значних обсягів (більше 20 млрд дол.) і становить 7–10% загального обігу ліків на фармринку. Поширення Н.л. має місце в усіх країнах світу, але переважає у тих, де не відпрацьована регуляторна політика щодо обігу ліків, недостатнє їх постачання, велика кількість посередників, відсутні уповноважені органи з контролю якості ліків тощо (наприклад, в країнах Африки більше 50% протималярійних препаратів визначаються як фальсифіковані). Н.л. за ефективністю та безпекою нерівноцінні аналогам, навіть коли у їх складі міститься необхідна кількість АФІ. Їх виробництво та реалізація знаходяться поза сферою діяльності контролюючих органів і за необхідності неможливо виявити їх дефекти при застосуванні та вилучити з обігу. Н.л. завдають значної шкоди здоров’ю людей, руйнують довіру громадськості до системи охорони здоров’я, фармацевтичної промисловості та національних органів контролю якості ліків. Крім того, виробництво та обіг фальсифікованих ліків як тіньова діяльність завдає великих збитків державі та легальним суб’єктам фармринку.
Враховуючи ситуацію, що склалася на світовому фармринку, в Україні розроблена програма боротьби з розповсюдженням фальсифікованої, неякісної та нелегальної продукції, введений статус «уповноваженої особи». Це переносить акцент відповідальності за якість ЛП на суб’єктів господарської діяльності при оптовій і роздрібній реалізації ліків, сприяє посиленню законодавчої бази та консолідації зусиль законодавчих, силових, контролюючих та інших структур, які можуть впливати на захист фармринку України від неякісної продукції. n
Літ.: Гончарук Т. «Фальсификаты» и «субстандарты» — две стороны одной монеты // Провизор — 2002. — № 7; Наказ КМУ від 30 жовтня 2002 р. № 436 // Провізор. — 2002. — № 4 (Нормативно-правові акти); Сур С.В. Стратегія захисту фармацевтичного ринку України від фальсифікованих лікарських засобів // Фармацевтична Україна, 2004. — № 1; Еженедельник АПТЕКА. — 2005. — № 24.
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
* Продовження. Початок у “Щотижневику АПТЕКА” №3(624) від 21 січня 2008 р.
Далі буде.
І.М. Перцев,
відповідальний секретар-координатор редакційної ради Фармацевтичної
енциклопедії, професор

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим