|
БРИТАНСКИЙ НАЦИОНАЛЬНЫЙ ФОРМУЛЯР
БНФ является совместной публикацией Британской медицинской ассоциации и Королевского фармацевтического общества Великобритании. За публикацию БНФ отвечает Объединенный формулярный комитет, состоящий из представителей этих двух профессиональных объединений и отделов Министерства здравоохранения Великобритании. Цель создания БНФ — предоставить врачам, фармацевтам и другим медицинским работникам современную и научно обоснованную информацию об использовании лекарственных средств.
БНФ непрерывно пересматривается, а новые издания публикуются ежегодно в марте и сентябре. Справочник распространяется преимущественно среди врачей и фармацевтов, работающих в системе Национальной службы здравоохранения, а также во всех больницах государственного сектора здравоохранения. БНФ также является учебным пособием для студентов медицинских и фармацевтических учебных учреждений Великобритании.
БНФ обеспечивает быстрый доступ к важной информации о выборе, назначении, отпуске и способе применения медикаментов. В справочник включены лекарственные средства, обычно назначаемые в Великобритании. В БНФ очень мало информации о безрецептурных лекарственных препаратах.
Основу информации о лекарственных средствах составляют данные литературы, опубликованной производителями лекарственных препаратов, данные медицинской и фармацевтической литературы, уполномоченных регуляторных органов, профессиональных обществ и др. Рекомендации по терапевтическому применению медикаментов и отбору лекарственных средств составлены на основе публикаций в медицинских клинических журналах, и отражают, по возможности, результаты оценки научных доказательств. Кроме того, Объединенный формулярный комитет получает от экспертов различных областей медицины клинические рекомендации, особенно это касается тех вопросов, которые пока недостаточно подкреплены убедительными научными доказательствами. Благодаря этому обеспечивается соответствие рекомендаций БНФ современной врачебной практике. В подготовку БНФ вносят вклад многие профессиональные организации и отдельные специалисты.
БНФ составлен в виде дайджеста для быстрого получения справки и не обязательно содержит всю информацию, необходимую для назначения и отпуска лекарственных средств. Кроме того, в справочнике не очень подробно освещаются такие области медицины, как акушерство, онкология и анестезиология, поскольку предполагается, что в этих областях лечение проводят специалисты, имеющие доступ к соответствующей специальной литературе. Информацию БНФ следует оценивать в контексте профессиональных знаний и при необходимости дополнять данными специальной литературы, в том числе опубликованной производителями соответствующих лекарственных средств.
БНФ — современное независимое профессиональное справочное карманное издание, которое удовлетворяет потребность врачей в информации о назначении лекарственных средств и способствует рациональному, экономически эффективному и безопасному их применению.
Благодаря выпуску БНФ 2 раза в год в нем отражены все изменения в отношении наличия препаратов на рынке, их безопасности, а также применения в клинической практике. В каждом выпуске справочника перечислены наиболее важные из указанных изменений.
БНФ доступен также в сети Интернет (). Там же можно найти и другую дополнительную информацию.
Историческая справка. История создания БНФ связана с составлением формуляров для целей медицинского страхования в 30-х годах прошлого столетия в Великобритании. После начала второй мировой войны эти формуляры объединили в Национальный военный формуляр, в котором указывались составы лекарственных средств с веществами, предназначенными для замены дефицитных импортируемых ингредиентов.
Первый БНФ был составлен в 1949 г. после создания Национальной службы здравоохранения Великобритании. Справочники, публикуемые вплоть до второй половины 70-х годов XX столетия приблизительно раз в полтора года, содержали избирательную информацию, поэтому возникла необходимость в создании исчерпывающего формуляра, включающего гораздо более широкий ассортимент лекарственных препаратов, но при этом дающего научно обоснованные рекомендации об относительных преимуществах представленных лекарственных средств. Новый БНФ, соответствующий указанным требованиям, был опубликован в 1981 г.
КАК ГОТОВИТСЯ СПРАВОЧНИК
Врачи и фармацевты — члены Объединенного формулярного комитета — назначаются Британской медицинской ассоциацией, Министерством здравоохранения и Королевским фармацевтическим обществом Великобритании. Комитет отвечает за содержание БНФ и проверку поправок, вносимых на основании новых научных данных и рекомендаций экспертов. Заседания комитета проходят ежеквартально. Перед новым изданием формуляра каждый член комитета получает корректуру всех глав БНФ.
Члены редколлегии отвечают за ведение и обновление определенных разделов БНФ. При подготовке очередного справочника они сверяют правильность информации в БНФ с различными источниками. Проекты поправок составляются в тех случаях, когда члены редколлегии уверены в надежности и адекватности новой информации. Затем эксперты сопровождают проекты поправок комментариями, после чего они утверждаются на заседании Объединенного формулярного комитета. Кроме того, из каждой главы отбирают отдельные разделы для тщательного рецензирования в отношении правильности всех данных и соответствия поправок требованиям лучшей современной клинической практики.
В подготовке каждого издания БНФ принимают участие более 50 постоянных экспертов — клинических консультантов со всей Великобритании. Они рецензируют текущее издание справочника и комментируют поправки к нему. Кроме постоянных экспертов, привлекают и других клинических специалистов для работы по отдельным вопросам (по терапии при шоке, инфаркте миокарда и др.).
Составители БНФ тесно сотрудничают с рядом экспертных органов, составляющих клинические руководства. Эти органы регулярно направляют составителям справочника копии проектов клинических руководств для отзывов и включения новой информации в БНФ.
При составлении БНФ используются различные источники информации:
– краткие характеристики лекарственных препаратов (тщательно проверяются при составлении БНФ) (прим. ред. — Краткая характеристика лекарственных препаратов (Summary of Product Characteristics — SPC) является частью регистрационного досье и содержит информацию о названии лекарственного препарата; качественном и количественном составе; лекарственной форме; фармакологических свойствах и фармакокинетических характеристиках; клинических характеристиках — показаниях, противопоказаниях, побочных реакциях, особых мерах предосторожности, применении в период беременности и кормления грудью, лекарственных взаимодействиях, дозах и способе введения, передозировке и т. п.; фармакологических характеристиках — несовместимости, сроке хранения, особых мерах предосторожности и т. п.; данных о владельце торговой лицензии. В Украине при регистрации лекарственного средства SPC не утверждается, ее ближайший аналог — инструкция для медицинского применения препарата, содержащая информацию для специалистов);
– консультации экспертов;
– научная литература (проводится мониторинг ведущих медицинских и фармацевтических журналов, проверка правильности информации в БНФ, особенно при несоответствии данных в справочнике и какой-либо научной статье, при необходимости вносятся поправки в БНФ);
– систематические обзоры (имеется доступ к базам данных систематических обзоров, включая Кокрановскую);
– согласованные клинические руководства («консенсусы») (рекомендации в БНФ проверяются в отношении соответствия согласованным руководствам, составленным экспертными органами);
– справочники (используются учебные и другие справочные пособия в качестве базовой информации);
– нормативно-правовая информация (осуществляется мониторинг информации различных государственных органов, имеющей отношение к обращению лекарственных средств: текстов Британской Фармакопеи, информации Регуляторного агентства по лекарственным средствам и изделиям медицинского назначения (the Medicines and Healthcare products Regulatory Agency — MHRA) о побочных реакциях лекарственных средств, информации Министерства внутренних дел Великобритании о контролируемых наркотических средствах, руководств о применении лекарственных средств Министерства здравоохранения, профессиональных медицинских и фармацевтических организаций и др.);
– информация о ценах (уполномоченного органа по ценообразованию рецептурных лекарственных средств, а также прайс-листы поставщиков медикаментов);
– отзывы читателей;
– отзывы производителей лекарственных средств (экземпляр БНФ получает каждая фармацевтическая компания с предложением высказать мнение по поводу справочника; как правило, представители компаний очень внимательно изучают БНФ).
КАК ПОЛЬЗОВАТЬСЯ БНФ
Информация о лекарственных средствах и препаратах и особенностях их применения
Основной текст справочника состоит из систематизированной информации о лекарственных средствах и препаратах и особенностях их клинического применения. Эта информация содержится в 15 главах, каждая из которых посвящена определенной системе организма или определенному аспекту оказания медицинской помощи. Каждая глава состоит из разделов, которые начинаются с информации для специалистов, назначающих лекарственные средства. Цель данной информации — облегчить врачам, фармацевтам, медицинским сестрам (прим. ред. — в Великобритании медицинские сестры имеют право назначать лекарственные средства, некоторые перевязочные материалы и другие средства медицинского назначения, входящие в специально утверждаемый перечень) и другим работникам системы здравоохранения выбор адекватной медикаментозной терапии. Затем следует подробная информация об отдельных лекарственных средствах и препаратах.
Лекарственные средства. Лекарственные средства указаны под фармакопейными или другими непатентованными названиями. Если есть соответствующая фармакопейная монография, то предпочтение отдается названию, вынесенному в заголовок монографии. При отсутствии монографии используются рекомендованные международные непатентованные названия ВОЗ, а при их отсутствии — Британские одобренные названия (BAN).
Лекарственные препараты. Препараты обычно следуют сразу же за лекарственным средством, которое является их основным ингредиентом. Лекарственные препараты указаны под непатентованным названием, если они реализуются под этим названием или же если их приготавливают экстемпорально. Затем следуют рекомендуемые лекарственные препараты под патентованными названиями.
Руководство по назначению лекарственных средств
В главе содержится общая информация о правилах выписывания рецептов на лекарственные средства, а также информация о назначении контролируемых наркотических средств, рассматриваются вопросы лекарственной зависимости, назначения лекарственных средств детям и людям пожилого возраста, а также назначение медикаментов при проведении паллиативного лечения. Приведены рекомендации относительно выявления и регистрации побочных реакций на лекарственные средства.
Неотложная терапия при отравлениях
В главе содержится информация о мерах, принимаемых при остром отравлении преимущественно в амбулаторных условиях, но упомянуты и некоторые аспекты лечения в условиях стационара.
Приложения и алфавитные указатели
В приложениях представлена информация о лекарственных взаимодействиях; особенностях назначения лекарственных средств при заболеваниях печени, при нарушении функции почек, в период беременности или кормления грудью; информация о дополнительных растворах для внутривенного введения, пограничных субстанциях, перевязочных материалах; этикетки с особыми указаниями и рекомендациями, прилагаемые фармацевтом к лекарственному средству при его отпуске. Информация в приложениях предназначена для использования с основным текстом БНФ.
Справочник публикуется 2 раза в год и в каждое новое издание вносится ряд изменений. Все важные изменения и дополнения, внесенные в новое издание, указаны в отдельном разделе.
Как пример подачи информации в БНФ с некоторыми сокращениями приводим главу «Руководство по назначению лекарственных средств».
РУКОВОДСТВО ПО НАЗНАЧЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Прием лекарственных средств для достижения оптимального эффекта
Проблемы соблюдения режима медикаментозного лечения отмечаются независимо от возраста пациентов. Факторы, негативно влияющие на степень соблюдения пациентом режима лечения (комплаентность):
– неясная для пациента цель приема медикамента;
– пациент считает, что препарат неэффективен;
– реальные или предполагаемые пациентом побочные эффекты;
– неясные инструкции по применению препарата;
– пациент испытывает физические трудности при приеме медикаментов (например, затруднения при глотании препарата, в обращении с маленькими по размеру таблетками или при вскрытии упаковки);
– состав препарата вызывает у пациента неприятные ощущения (например, вкусовые);
– сложная схема приема препарата.
Врач и пациент должны прийти к единому мнению (согласию) о желаемых для пациента результатах лечения и о стратегии, необходимой для их достижения.
Врач, уделяя время на объяснение пациенту (и его родным) обоснованности медикаментозной терапии и возможности развития побочных эффектов, может способствовать повышению комплаентности. Также эффективно закрепление и уточнение инструкций врача фармацевтом. Советы в отношении возможности применения альтернативных методов лечения будут стимулировать пациента обратиться к врачу при возникновении проблем с лечением вместо того, чтобы прекратить прием препаратов.
Часто помогает упрощение схемы медикаментозного лечения; необходимость частого приема препаратов снижает комплаентность, однако, по-видимому, нет особых различий в степени соблюдения режима лечения при приеме лекарственных средств 1 или 2 раза в сутки. Комбинированные лекарственные препараты уменьшают количество принимаемых лекарств, однако иногда это преимущество может достигаться за счет утраты возможности подбирать дозу каждого лекарственного средства в отдельности.
Непатентованные названия
Если в БНФ указаны непатентованные (генерические) названия, то их следует использовать при выписывании рецепта. Это поможет фармацевту отпустить любой подходящий пациенту лекарственный препарат, что может предупредить задержку в начале проведения медикаментозной терапии, а иногда и способствовать снижению расходов в рамках службы здравоохранения. Единственным исключением являются случаи, при которых аспекты биодоступности настолько важны, что пациент всегда должен принимать препарат с одним и тем же патентованным названием. В таких случаях в рецепте указывают патентованное название или производителя лекарственного препарата.
Названия, используемые в качестве заглавий для монографий Британской Фармакопеи, в других странах могут не использоваться. Многие непатентованные названия, использованные в БНФ, соответствуют либо заглавиям монографий Европейской Фармакопеи, Британской Фармакопеи или Британского фармацевтического кодекса (1973 г.). В этих случаях препараты должны соответствовать стандарту в соответствующем издании.
Названия с символом ® используются в Великобритании в качестве патентованных названий.
Торговые лицензии и рекомендации в БНФ
Дозы в БНФ указаны в качестве общей рекомендации и представляют, если не указано иначе, диапазон доз, обычно адекватный для применения у взрослых. В целом, дозы (способ применения), показания, особые указания и побочные эффекты в БНФ соответствуют указанным в инструкциях для медицинского применения, составленных производителями, или в краткой характеристике лекарственного препарата, которые, в свою очередь, отражают информацию, содержащуюся в соответствующих торговых лицензиях (регистрационных свидетельствах). Если в БНФ включено незарегистрированное лекарственное средство, то это указано в квадратных скобках. Если рекомендуемый в справочнике способ применения (показания или путь введения) зарегистрированного лекарственного препарата не указан в его торговой лицензии (незарегитрированное применение или применение, не соответствующее маркировке off-label use), это также указано в квадратных скобках. Если препарат поставляется несколькими производителями, то в БНФ даются такие рекомендации, которые в наибольшей степени соответствуют клинической практике, вне зависимости от каких-либо различий в торговых лицензиях разных производителей.
|
Сила действия и количество
Лицо, выписывающее рецепт, должно указать силу действия или количество действующего вещества в капсулах, леденцах для сосания, таблетках и других лекарственных формах.
Если фармацевт получает неполный рецепт на регулярно принимаемый препарат и считает, что из интересов пациента его лучше не возвращать врачу, в Великобритании применяется следующая процедура:
a) всегда следует попытаться установить связь с врачом, выписавшим рецепт, и выяснить, чем он руководствовался;
b) после общения с врачом фармацевт должен, если это практически осуществимо, принять меры для последующего указания врачом в бланке неполного рецепта требуемого количества лекарственного вещества, силы действия (если это необходимо) и дозировки;
c) если в результате общения с врачом не оказалось возможным получить письменное указание в отношении неполного рецепта, фармацевт может сделать в рецепте пометку «р.с.» (prescriber contacted — «с врачом связался») и внести данные о количестве, силе действия (если это необходимо в отношении данного препарата) и рекомендуемой дозе. При внесении данных в рецепт необходимо указать фамилию и инициалы фармацевта, дату;
d) если невозможно связаться с врачом, а фармацевт достаточно владеет информацией для профессионального заключения, препарат можно отпустить пациенту. Если количество не указано, то фармацевт может отпустить препарат в количестве, достаточном для проведения 5-дневного курса лечения; исключение составляют комбинированные упаковки (то есть комби-упаковки — патентованные упаковки, содержащие несколько лекарственных препаратов) или пероральные контрацептивы с указанием только названия средства, в этих случаях препараты отпускают в упаковках самого малого объема. Во всех случаях в рецепт необходимо внести пометку «p.n.c.» (prescriber non contacted — «с врачом не связался»), указать количество, дозу и силу действия (если необходимо) для отпущенного пациенту лекарственного препарата, с указанием фамилии и инициалов фармацевта и даты;
e) если у фармацевта какие-либо сомнения в отношении правомочности самоличного внесения уточнений в назначение врача, неполный рецепт необходимо вернуть врачу.
Вспомогательные вещества
Если жидкие лекарственные формы для приема внутрь не содержат фруктозы, глюкозы или сахарозы, то в БНФ указано «не содержащие сахара». Если они содержат гидрогенизированный сироп глюкозы, маннитол, мальтитол, сорбитол или ксилитол, то в справочнике также указано «не содержащие сахара», поскольку имеются доказательства, что эти вещества не вызывают развитие кариеса. Пациентам, применяющим лекарственные препараты, содержащие кариогенные сахара, следует рекомендовать принимать соответствующие санитарно-гигиенические меры, направленные на предупреждение развития кариеса.
При наличии аспартама, глютена, тартразина, арахисового или кунжутного масла, об этом указывают рядом с соответствующим лекарственным препаратом.
В БНФ представлена информация об отдельных вспомогательных веществах в лекарственных препаратах, применяемых в дерматологии, и об отдельных консервантах и вспомогательных веществах в глазных каплях и препаратах для парентерального введения. В БНФ указаны также дозирующие аэрозоли, содержащие хлорфторуглероды.
В справочнике указано наличие бензилового спирта и полиоксилового касторового масла (полиэтоксилированное касторовое масло) в препаратах для инъекций. Применение препаратов, содержащих бензиловый спирт, связывают с развитием фатального токсического синдрома у недоношенных детей, поэтому препараты с этим консервантом не следует назначать новорожденным. Применение полиоксилового касторового масла, используемого в качестве носителя в препаратах для внутривенных инъекций, обусловливало развитие тяжелых анафилактоидных реакций.
Экстемпоральные препараты
Экстемпорально можно отпускать только те препараты, зарегистрированные аналоги которых на рынке отсутствуют. Инструкция в Британской Фармакопее о том, что препарат должен быть свежеприготовленным, указывает на необходимость его приготовления не более чем за 24 ч до его отпуска. Инструкция о том, что препарат должен быть недавно приготовлен, указывает на то, что есть вероятность его порчи при хранении более 4 нед при 15–25 °C.
Термин «вода» при использовании без дальнейшего уточнения означает или питьевую воду, свежезаготовленную непосредственно из государственной сети водоснабжения и годную для питья, или же свежевскипяченную и затем охлажденную очищенную воду. Последнюю необходимо использовать в тех случаях, когда водоснабжение обеспечивается из местного резервуара для хранения воды или если питьевая вода не подходит для приготовления определенного препарата.
Меры предосторожности в домашних условиях
Следует предупредить пациента о необходимости хранения медикаментов в месте, не доступном для детей. Все твердые лекарственные формы и все жидкие лекарственные формы для внутреннего и наружного применения следует отпускать в закрывающихся контейнерах, устойчивых к вскрытию детьми, за следующими исключениями:
– лекарственный препарат находится в оригинальной упаковке;
– пациенту трудно открывать контейнер, устойчивый к вскрытию детьми;
– специально указано, что препарат нельзя отпускать в контейнере, устойчивом к вскрытию детьми;
– для данного препарата в жидкой лекарственной форме нет подходящего контейнера, устойчивого к вскрытию детьми.
Всем пациентам следует рекомендовать избавляться от ненужных медикаментов путем их возврата поставщику для дальнейшего уничтожения.
ПОБОЧНЫЕ РЕАКЦИИ НА ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Любое лекарственное средство может вызвать нежелательную или непредвиденную побочную реакцию. Выявление и регистрация таких реакций крайне важна. Поэтому врачей, фармацевтов, медицинских сестер и некоторых других профессиональных работников призывают оказывать помощь посредством направления сообщений о побочных реакциях на специальных «желтых карточках» («Yellow Cards», с оплаченной почтовой доставкой) в Комитет по безопасности лекарственных средств (CSM) при MHRA.
Необходимо сообщать о предполагаемой побочной реакции на любое терапевтическое средство, включая лекарственные средства (как при самолечении, так и при приеме рецептурных лекарственных средств), препараты крови, вакцины, рентгеноконтрастные средства и средства растительного происхождения.
Кроме того, в Великобритании существует специальная бесплатная круглосуточная телефонная служба для предоставления рекомендаций и информации в отношении предполагаемых побочных реакций и региональные центры по сбору данных о побочных реакциях. Мониторинг побочных реакций облегчен за счет специальной интерактивной системы слежения за информацией о побочных реакциях (ADROIT), поддерживаемой MHRA.
Более подробную информацию о сообщении о побочных реакциях и список препаратов, подлежащих в настоящее время интенсивному мониторингу, можно найти на сайте CSM ().
Мониторинг побочных явлений при назначении рецептурных лекарственных средств
Кроме системы «желтых карточек» существует еще одна независимая система мониторинга безопасности новых лекарственных препаратов, при которой используется другой подход. Независимая благотворительная организация по исследованию безопасности лекарственных средств (The Drug Safety Research Unit) выявляет пациентов, которым были назначены избранные новые лекарственные препараты, и собирает данные о побочных явлениях у этих пациентов. Информацию о побочных явлениях на добровольной основе направляют врачи общей практики на специальных бланках зеленого цвета. Подробнее об этой системе можно узнать на веб-сайте организации ().
Новые препараты и вакцины
Обычно в отношении новых лекарственных препаратов имеется ограниченный объем клинических данных о безопасности. Дальнейшая оценка их безопасности зависит от доступности информации, получаемой на основе повседневной клинической практики.
Недавно зарегистрированные лекарственные препараты подлежат интенсивному мониторингу со стороны MHRA и CSM и обычно в Великобритании во всех фармацевтических справочниках, в том числе в БНФ, в кратких характеристиках лекарственных препаратов и в рекламных материалах такие препараты сопровождаются символом 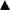 . К числу таких средств также относятся ранее лицензированные препараты с новым зарегистрированным путем введения или новой системой доставки лекарственного средства, или же с новыми важными показаниями к применению, поскольку это может повлиять на соотношение риск/польза данного препарата. MHRA/CSM обычно пересматривают данные по безопасности через 2 года. Однако черный треугольник сохраняется до тех пор, пока безопасность препарата не будет убедительно доказана.
. К числу таких средств также относятся ранее лицензированные препараты с новым зарегистрированным путем введения или новой системой доставки лекарственного средства, или же с новыми важными показаниями к применению, поскольку это может повлиять на соотношение риск/польза данного препарата. MHRA/CSM обычно пересматривают данные по безопасности через 2 года. Однако черный треугольник сохраняется до тех пор, пока безопасность препарата не будет убедительно доказана.
Спонтанные сообщения о побочных реакциях особенно ценны тем, что помогают быстро выявить характер возможной опасности для здоровья, связанной с применением определенного препарата. MHRA и CSM обычно просят сообщать с помощью Системы «желтых карточек» о всех предполагаемых побочных реакциях (в том числе и о тех, которые не относятся к серьезным) на препараты, сопровождаемые черным треугольником. Сообщать о побочной реакции следует даже тогда, когда нет полной уверенности в том, что она вызвана данным препаратом, когда наряду с этим препаратом пациент принимал другие медикаменты, а также в тех случаях, когда отмеченная побочная реакция на лекарственное средство хорошо известна.
Давно применяемые средства и вакцины
Врачей, фармацевтов, медицинских сестер и некоторых других медицинских работников просят сообщать обо всех серьезных предполагаемых побочных реакциях, включая и те, которые привели к смерти, представляют угрозу для жизни, приводят к нетрудоспособности/инвалидности, требуют госпитализации или продления срока госпитализации; о таких побочных реакциях следует сообщать, даже если они хорошо известны. Сообщения о серьезных побочных реакциях необходимы для их сравнения с другими лекарственными средствами сходного класса. Сообщения о передозировке (намеренной или случайной) могут затруднить оценку побочных реакций, но дают важную информацию о потенциальной токсичности лекарственных средств.
В отношении давно применяемых средств нет необходимости сообщать об известных побочных явлениях легкой степени тяжести, например, о сухости во рту при приеме трициклических антидепрессантов или запоре при приеме опиоидных средств.
Побочные эффекты в БНФ
В БНФ включены клинически значимые побочные эффекты большинства лекарственных средств; исчерпывающий список не представлен для тех лекарственных средств, которые применяют специалисты (например, цитотоксические лекарственные средства и анестетики). Если причинная связь побочных эффектов, обнаруженных в исследованиях, спонсированных фирмой-производителем, не установлена, то такие эффекты могут не указываться в БНФ.
Побочные эффекты обычно перечисляются в порядке частоты развития и в целом сгруппированы по органам и системам. Иногда может быть приведен редкий побочный эффект, в первую очередь, если его сочли особенно важным в связи с его опасностью.
В данных литературы о лекарственном препарате частота развития побочных эффектов обычно описывается следующим образом:
– очень часто — больше чем у 1/10 пациентов;
– часто — у 1/100–1/10 пациентов;
– нечасто — у 1/1000–1/100 пациентов;
– редко — у 1/10 000–1/1000 пациентов;
– очень редко — менее чем у 1/10 000 пациентов.
Для наглядного представления лекарственных препаратов, входящих в Примерный формуляр ВОЗ и БНФ, в ближайшем номере «Еженедельника АПТЕКА» будут рассмотрены отдельные группы лекарственных средств, описанные в формулярах.?n
Николай Холоденко, Андрей Спасокукоцкий

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим