За основу при подготовке материала был взят отчет компании «PricewaterhouseCoopers» под названием «».

Большая перестройка
Фармацевтический рынок изменяется очень быстро. Можно выделить семь основных социо-экономических трендов, которые оказывают воздействие на развитие фарминдустрии в целом.
Распространение хронических болезней, таких как сахарный диабет, увеличивается. Правительства многих стран повышают пенсионный возраст, вследствие чего развитие хронических заболеваний приходится на экономически активную часть жизни, что еще больше усилит давление затрат на здравоохранение. Соответственно, возрастет социальная и экономическая ценность лечения этих заболеваний. Однако фармкомпании будут вынуждены снизить цены на препараты, применяемые для терапии хронических заболеваний, а рост доходов будет обеспечиваться за счет увеличения физического объема продаж.
Государство, страховые компании и пациенты выдвигают все более определенные требования к тому, что и как врачи должны назначать. На смену протоколам, регулирующим назначение медикаментозной терапии того или иного заболевания, пришло индивидуальное лечение. Это сделало целевую аудиторию фармацевтических компаний более консолидированной и влиятельной, что, в свою очередь, не может не повлиять на продажи компаний и их маркетинговую стратегию. Теперь для получения прибыли придется приложить намного больше усилий — наладить взаимодействие с плательщиками и поставщиками, доказать преимущества препарата для пациента.
Цена входа на рынок продолжает расти. Все большее число государств и страховых компаний прибегают к фармако-экономической оценке характеристик лекарственных средств. Широкое распространение электронных баз медицинских данных предоставит им возможность определять наиболее эффективные в клинической практике препараты.
Таким образом, появится возможность сравнить эффективность препарата и его стоимость и уже на этой основе принимать решения о назначении препарата, а не только базируясь на фармакологических характеристиках лекарственного средства. Игроки Большой Фармы будут вынуждены доказывать не только эффективность применения их препаратов, но и соответствие цены положительному действию, которое они оказывают. В случае существования аналогичных лекарственных средств необходимо продемонстрировать, что новый препарат имеет ряд преимуществ по сравнению с его аналогами.
Границы между различными формами организации медицинской помощи стираются. Направление, занимающееся предоставлением первичной медико-санитарной помощи активно развивается, не в последнюю очередь в ответ на рост распространенности хронических заболеваний. Также все большее распространение в последнее время получает самолечение, что обусловлено расширением списка безрецептурных лекарственных средств. В соответствии с этим меняются и потребности пациентов.
Сегменты, где процесс лечения частично либо полностью перекладывается на пациента, требуют предоставления более широкой информационной поддержки. Сдвиг приоритетов с больничной формы оказания медицинской помощи в сторону первичной медико-санитарной будет способствовать развитию сервиса доставки лекарственных средств на дом.
Прогнозируется, что в ближайшие 12 лет на развивающихся рынках будет отмечен значительный рост спроса на лекарственные средства. Развивающиеся страны неоднородны по своим экономическим, социальным и другим характеристикам. Также большие различия касаются законодательных норм, регулирующих защиту прав интеллектуальной собственности. Любая компания, которая хочет успешно работать на развивающихся рынках, будет вынуждена диверсифицировать стратегию своего развития с учетом особенностей бизнеса и локальных рынков.
Многие правительства начинают обращать больше внимания на предотвращение развития разнообразных заболеваний, хотя пока инвестирование в программы не обрело широкой популярности. Большая Фарма также может расширить свое присутствие в этой нише, но для этого ей понадобится активно сотрудничать с правительственными организациями.
Ведущие национальные и многонациональные регуляторные органы стали гораздо более осторожно относиться к одобрению инновационных лекарственных средств и без энтузиазма воспринимают рискованные проекты. Таким образом, количество новых препаратов из года в год продолжает уменьшаться.
Направо пойдешь…
Традиционной стратегией развития фармацевтических компаний является инвестирование значительных финансовых средств в небольшое количество действующих веществ, их активную промоцию с целью сделать их блокбастерами, что в течение многих лет неизменно получало одобрение акционеров. Однако в последние годы продуктивность такого подхода значительно снизилась. Разработка новых активных фармацевтических ингредиентов охватывает все более разнообразные сферы. Так, активная работа ведется в области создания лекарственных средств для терапии редких заболеваний.
В 2007 г. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) одобрило наименьшее количество препаратов с 1983 г. — всего лишь 18 новых лекарственных средств. После этого спада в 2008 г. было одобрено 24 препарата, в 2009 г. — 25, а в 2010 г. тенденция к снижению продуктивности R&D возобновилась — FDA зарегистрировало 21 лекарственное средство.
Хотя число одобренных препаратов в последующие годы несколько увеличилось, однако проблему продуктивности разработки лекарственных средств это так и не устранило. Затраты на разработку новых препаратов продолжают увеличиваться, результат же при этом остается малопрогнозированным (рис. 1).
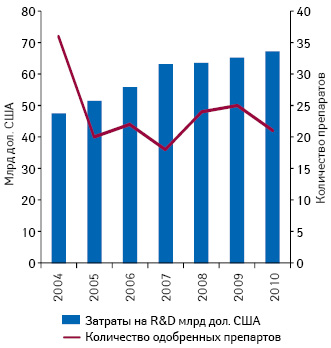
Кроме того, сроки патентной защиты многих лекарственных средств истекают в течение следующих нескольких лет. Согласно данным «Sanford C. Bernstein», к 2015 г. в результате возросшего конкурентного давления со стороны генериков прибыль 10 крупнейших мировых фармацевтических компаний сократится по разным оценкам на 2–40%. И при этом только 4 из десяти продуктовых портфелей данных компаний содержат препараты, продажи которых способны покрыть эти потери.
Таким образом, отмечается инновационный дефицит, который затронул фармацевтическую отрасль в целом. Для решения этой проблемы каждая компания выбирает свой путь, но какой бы способ решения вопроса она не выбрала, R&D-сектор был и остается одним из основных элементов успешности фармацевтического бизнеса.
Некоторые компании для повышения продуктивности своего R&D-подразделения предпочитают работать в узком направлении, не распыляя своих ресурсов, и разрабатывать лекарственные средства для терапии заболеваний, против которых пока нет эффективного лечения либо их массовая медикаментозная терапия недоступна по технологическим или финансовым причинам. При разработке таких лекарственных средств фармкомпании должны быть абсолютно уверены, что общество не только захочет, но и сможет платить за них. Однако даже это — лишь временное решение проблемы.
Основными путями, которые позволят фарминдустрии повысить продуктивность R&D- сегмента и снизить временные и денежные затраты на разработку инновационных лекарственных средств, могут стать:
- получение достаточного количества данных для создания полного представления о работе человеческого организма на молекулярном уровне;
- улучшение понимания патофизиологических процессов, которые происходят во время развития и течения заболевания;
- более широкое использование новых технологий для «виртуализации» исследовательского процесса и ускорения разработки, исследования новых молекул;
- расширение сотрудничества между фармацевтическими компаниями, научно-исследовательскими центрами, регуляторными органами, правительством и медицинскими учреждениями.
Далее мы более подробно остановимся на «виртуализации» исследовательского процесса и преимуществах, которые она может принести.
Узнать себя лучше
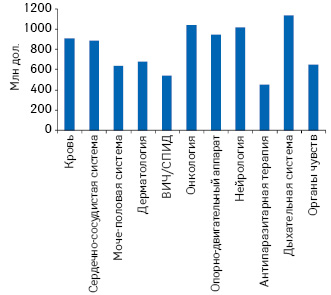
На сегодня всего лишь 11% новых активных фармацевтических ингредиентов проходят все фазы клинических исследований и получают одобрение регуляторных органов — именно поэтому затраты на разработку новых лекарственных средств так высоки. Согласно оценкам Центра по исследованию разработок лекарственных средств при Тафтском университете (Tufts Center for the Study of Drug Development — Tufts CSDD) стоимость разработки нового лекарственного средства, включая все этапы исследований, составляет 868 млн дол. США. При этом в разных сферах медицины стоимость разработки инновационных препаратов варьирует (рис. 2). А по расчетам аналитической компании «PricewaterhouseCoopers», средняя стоимость разработки одного препарата (с учетом стоимости разработки новых молекул, не прошедших какую-либо из фаз R&D-процесса) составляет 454 млн дол.
Одним из возможных способов удешевления этого затратного процесса является разработка виртуальных систем, позволяющих проводить на их базе некоторые этапы разработки нового препарата. Так, одним из перспективных является проект создания «виртуального человека», в рамках которого будут математически прописаны все процессы, проходящие на молекулярном и клеточном уровне в его организме. С помощью данной программы появится возможность симулировать физиологические реакции организма в ответ на применение различных веществ.
Ныне многие организации и компании разрабатывают модели разнообразных органов и клеток организма. Например, Американская диабетологическая ассоциация (American Diabetes Association) и фармкомпания «Entelos» создает виртуальную мышь, больную сахарным диабетом І типа, для изучения воздействия на ее состояние инновационных лекарственных средств. При этом одной из наибольших проблем, связанных с созданием таких моделей, является нехватка фундаментальных знаний об этиологии и патогенезе многих заболеваний на молекулярном уровне, а также о генетических и фенотипических вариациях, характерных для человеческой популяции.
Несмотря на эти трудности, различные совместные научно-исследовательские проекты по созданию виртуальной модели человеческого организма уже запущены в работу. Так, например, «StepConsortium» разрабатывает целостную модель функционирования человеческого организма, а «Living Human Project» работает над моделью человеческого опорно-двигательного аппарата для компьютерного моделирования биологических экспериментов (in silico). Международная организация «Physiome Project» намерена разработать программное обеспечение для интегративного понимания функционирования клеток, органов и организма в целом. Все эти программы обладают огромным коммерческим потенциалом и могут заинтересовать крупные фармацевтические компании. Однако вероятность создания «виртуального пациента» в течение ближайших 12 лет остается низкой.
Биомоделирование начинает играть все большую роль в R&D-процессе. Например, ученые из Университетского колледжа Лондона (University College, Великобритания) использовали компьютерное моделирование для расчета эффективности лечения ВИЧ-инфекции путем блокирования одного из ключевых белков этого вируса. Аналогичным образом компания «Roche» при разработке лекарственного средства Pegasys™/Copegus™ (пегинтерферон α-2а), предназначенного для терапии гепатита С, использовала этот метод для определения оптимальной дозировки действующего вещества для разных популяций населения. Со временем эта тенденция усилиться и к 2020 г. виртуальные клетки, органы и подопытные животные будут широко использовать в исследованиях, проводимых фармацевтическими компаниями (рис. 3).
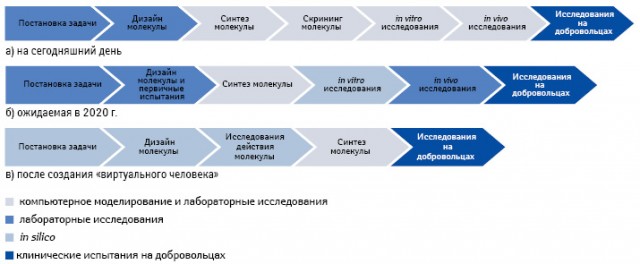
Для внедрения компьютерных технологий в процесс разработки лекарственных средств сейчас используют два подхода, которые позволяют создавать программы, основанные на семантическом вводе данных, и автоматизированный молекулярный дизайн.
Традиционные подходы в информатике ограничены как структурой данных, которые они могут обрабатывать, так и по форме, в которой они могут эти данные представлять. Программы, основанные на семантическом подходе, позволят исследователям автоматически анализировать большие объемы информации, несмотря на отличия формулировок и названий веществ. Это значительно упростит анализ взаимосвязи между химическим соединением и его воздействием на организм человека.
Широкое внедрение компьютерных технологий в процесс создания новых лекарственных средств позволит сократить время, необходимое на разработку, и сэкономить финансовые средства, а также может избавить от необходимости использования подопытных животных в экспериментах.
по материалам www.pwc.com, www.phrma.org, www.fda.gov

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим