
В начале было слово, и было оно — термин.
Англо-русский словарь переводит «counterfeit» как «фальшивый, поддельный, подложный».
Согласно определению ВОЗ (2010):
«Контрафактные лекарственные средства — это лекарственные средства с неправильной маркировкой в отношении их подлинности и/или изготовителя, нанесенной преднамеренно и в обманных целях. Использование контрафактных лекарственных средств может привести к безуспешности лечения или даже смерти. После использования и/или выявления контрафактных лекарственных средств доверие населения к системам здравоохранения может быть подорвано. Подделываются как патентованные препараты, так и генерики. Подделываются все виды лекарственных средств — от препаратов, предназначенных для лечения состояний, представляющих угрозу для жизни, до недорогих аналогов обезболивающих и антигистаминных средств. Контрафактные лекарственные средства могут включать продукты с правильными или неправильными ингредиентами, без активных ингредиентов, с недостаточным или избыточным количеством активного вещества или с поддельной упаковкой».
Законодательство США провозглашает следующее определение фальсифицированного лекарственного средства:
«Лекарство, упаковка или маркировка которого без законных на то оснований содержат торговый знак, торговое наименование либо любые другие идентификационные указания в печатном или электронном формате, либо любую другую информацию, указывающую или напоминающую другого/других производителя, поставщика, упаковщика или дистрибьютора, нежели те, кто в действительности произвел, поставил, упаковал или распространил/отпустил данное лекарство, — которое, таким образом, преднамеренным подложным путем стремятся представить как продукт (или объект поставки/ упаковки/ распространения) другого производителя, поставщика, упаковщика или дистрибьютора лекарственных средств».
По характеристике И. Бернстайн, определение, заложенное в законодательстве США, не до конца понятно для широкой публики, поскольку носит более юридический характер и по сути тяготеет к плоскости прав интеллектуальной собственности, затрагивает вопросы торговой марки, внешнего вида, соответствия оригиналу. Однако один из основных принципов деятельности FDA заключается в открытости и прозрачности в борьбе с НПЛФК, в которой значительную роль играет осведомленная общественность. Важным инструментом для достижения этой цели служит система MedWatch — электронная база данных, насчитывающая более 1 млн (!) зарегистрированных онлайн-пользователей. Поэтому на сайте FDA (где среди прочего представлены четкие и понятные инструкции, как составить отчет о подозрении на подделку, как ее дифференцировать и т.д.) дана несколько более медико-утилитарная интерпретация фальсификата в более общедоступной форме:
«Фальсифицированное (counterfeit) лекарство — это поддельное (fake) лекарство. В нем могут быть примеси, оно может содержать другой активный ингредиент или вообще его не содержать. Фальсифицированные лекарственные средства являются незаконными и могут быть опасны для вашего здоровья. FDA тщательно рассматривает все сообщения о подозрении в подделке и, с целью борьбы с фальсифицированными препаратами, работает совместно с другими организациями и частным сектором для содействия защите национальной системы поставок лекарств от угрозы фальсификата».
Докладчик отметила, что в США не принята такая аббревиатура, как НПЛФК (используются определения «контрафактный», «субстандартный», «некондиционный»), и рассказала о подходах и методах мониторинга и надзора за такой продукцией, применяемых FDA в целях обеспечения безопасности цепочки медикаментозного обеспечения. Причем цель состоит в том, чтобы обезопасить эту цепочку на всем ее протяжении, для чего необходимо сделать ее как можно более замкнутой и закрытой. Для этого тщательно отслеживается полный жизненный цикл лекарственного препарата и его ингредиентов.
Как же необходимо действовать для обеспечения безопасности сети медикаментозного обеспечения? — задается вопросом американский регулятор. В первую очередь, были названы:
- прозрачность и подотчетность цепочки медикаментозного обеспечения («Чем лучше мы знаем, что и где должно находиться в цепочке лекарственного обеспечения, тем лучше мы распознаем продукцию, которая НЕ должна там находиться»);
- усиление правоприменения и улучшение регуляторных инструментов;
- ответственность всех задействованных сторон и заинтересованных лиц («Производители, оптовые компании, аптеки как прямые участники процесса должны взять на себя больше ответственности: не только за продукцию, но и за цепочку снабжения в целом»);
- надзор/мониторинг (на национальном и глобальном уровнях);
- повышение бдительности и осведомленности («Обычно люди склонны быстро забывать об опасности. Об угрозе фальсифицированных лекарств им нужно напоминать постоянно. Будь-то население или люди, представляющие цепочку обеспечения: все должны быть настороже»);
- сотрудничество/партнерство — на местном и международном уровнях.
Цель FDA — предусмотреть и обезвредить все возможные уязвимые места цепочки медикаментозного обеспечения и все возможные методы преднамеренной подделки, среди которых в США уделяют прицельное внимание возможной террористической подоплеке таких деяний. В структуре FDA создано специальное подразделение (FDA’s Office of Criminal Investigations) по уголовным расследованиям всех дел, связанных с фальсификацией/подделкой лекарственных средств (на рис. 1 представлено количество случаев выявления фальсификата на территории США за последние полтора десятилетия).
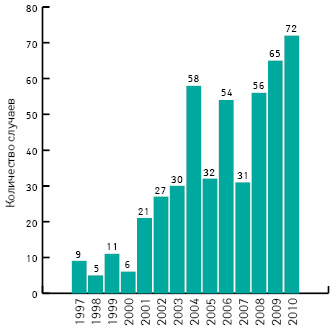
В приведенных данных нет намека на распространенность этого явления (FDA считает ее низкой), а дано только количество случаев, однако FDA очень беспокоит тревожная динамика: количество выявляемого фальсификата из года в год возрастает и в 2010 г. стало максимальным со времени начала этого мониторинга. Фальсификации подвергаются как оригинальные, так и генерические препараты либо используемые для их выпуска ингредиенты in bulk, как средства рецептурного отпуска, так и ОТС-продукты. Выявляют поддельные продукты без активного фармацевтического ингредиента (АФИ) либо содержащие его в недостаточном или чрезмерном количестве, содержащие другой АФИ либо установленные в поддельной упаковке. Во многих случаях фальшивотаблетчики задействуют в неблагих своих целях интернет и другие онлайн-компоненты, поэтому FDA тщательно изучает интернет-ресурсы, имеющие отношение к дистрибьюции лекарств. Отдельную проблему составляют похищенные рецептурные препараты: похитителям трудно быстро сбыть товар, и они могут спрятаться с ним и на месяц, и на год. Именно так и случилось недавно в США: произошла кража крупной партии инсулина — препарата, категорически требующего строго соблюдения температурного режима хранения. По результатам расследования выяснилось, что этот инсулин прятали в огромных фурах жарким летом под палящим солнцем Флориды. Когда начался сбыт товара, через систему MedWatch поступило несколько отчетов об отсутствии эффекта от получаемого инсулина (уровень глюкозы в крови не снижался при оттитрованных дозах препарата). В ходе расследования специалистам удалось выявить этих пациентов, определить источники приобретения ими испорченного инсулина, оказавшегося частью украденной партии, и размотать весь клубок фактов, что и содействовало оперативному разоблачению преступной схемы и перекрытию канала поступления негодного препарата к пациентам (никто из них, к счастью, не успел серьезно пострадать).

Увы, регуляторным органам не всегда удается заполучить информацию о местонахождении и перемещениях краденых и поддельных лекарств: они могут всплыть где угодно, циркулировать в пределах территории страны, появляться на глобальном рынке либо, наоборот, проникать в страну из зоны международного коммерческого оборота. Получить эту информацию крайне сложно, поэтому такие примеры, как с американским инсулином, должны выставляться на всеобщее обозрение в качестве предупреждения и служить пищей для серьезных выводов.
Прозрачность и отчетность
В настоящее время США предпринимают усилия для внедрения системы отслеживания «track and trace» (след в след). Недавно Конгресс США принял закон, предписывающий FDA разработать такую систему в пределах США, но при этом в законе отдельно прописано, что работа по отслеживанию должна быть максимально гармонизирована с международными стандартами. Сейчас в FDA идет разработка стандартов, которые обеспечат подчинение всей цепочки медикаментозного обеспечения единым правилам отслеживания не просто каждой серии, но каждой упаковки лекарственного средства. Благодаря системе электронного документирования каждого этапа жизненного цикла препарата (и в рамках деятельности этой системы) регуляторный орган будет располагать информацией о том,
- какие препараты, в каком количестве, когда, откуда и куда поступили,
- как долго и в каких условиях они хранились и транспортировались,
- кем, когда и кому были отгружены,
- и так вплоть до этапа аптеки, которая четко уверена в том, что имеет дело с дистрибьютором, официально лицензированным на территории США, и завершает цикл аутентификации путем выверения уникального серийного номера препарата, которым каждая упаковка будет снабжена подобно тому, как каждый автомобиль снабжен уникальным номерным знаком.
Четкие сроки внедрения этой системы еще не назначены, поскольку FDA лишь приступило к разработке стандартов ее деятельности, однако она будет создана, как того требует федеральный закон.
Ответственность заинтересованных сторон
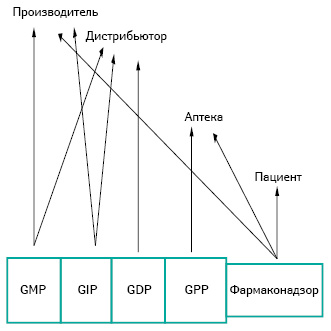
Следует убедиться в том, что производители, дистрибьюторы и аптеки выполняют установленные требования. Но невозможно обеспечить постоянное присутствие представителя FDA на каждом фармацевтическом заводе и оптовом складе (для этого есть инспектирование по поводу выявления порочных практик), поэтому участники рынка должны сами следить за собой и друг за другом в плане соответствия своих производственных и технологических процессов действующим требованиям. Они должны взять на себя больше ответственности за мониторинг продукции, за пунктуальную документальную отчетность о том, кто, что и когда сделал. FDA стремится нарастить на фундамент концепции фармацевтических надлежащих практик (GХP) новую парадигму, в рамках которой каждый — производитель, дистрибьютор, аптека, назначающий препараты врач, пациент — будет осознавать свой уровень ответственности в цепочке медикаментозного обеспечения. В этом контексте д-р Илиза Бернстайн представила слушателям оригинальную схему распределения ответственности заинтересованных сторон (рис. 2), базирующуюся на фармаконадзоре и таких GХP:
- Надлежащей производственной практике — Good manufacturing practices (GMP);
- Надлежащей дистрибьюторской практике — Good distribution practices (GDP);
- Надлежащей практике импорта — Good importer practices (GIP);
- Надлежащей аптечной практике — Good pharmacy practices (GPP).
Надзор и мониторинг
- Отбор образцов на рынке методом случайных проб; для препаратов, импортируемых на территорию США, — тоже рандомизированный посерийный контроль.
- Система фармаконадзора, оптимизированная и адаптированная для получения извещений о подозрении на контрафактное лекарство либо появлении в цепочке обеспечения других «проблемных» (украденных, попавших вне места назначения и др.) продуктов. В целом в системе фармаконадзора FDA произошли большие перемены, нацеленные на ужесточение контроля качества фармацевтической продукции; были изменены многие инструкции и расположение интерфейса, а публике заявлено: мы призываем вас сообщать нам обо всех предположительно поддельных или других проблемных лекарственных продуктах.
- Проводится активная образовательная работа с медицинскими работниками и потребителями по пользованию системой отчетов FDA.
- Система мониторинга FDA основывается на существовании и функционировании единого алгоритма, с помощью которого можно зафиксировать сигнал о том, что в цепочке обеспечения выявлена продукция, качество которой вызывает подозрения. Если в определенной части США фиксируются множественные факты («территориальные вспышки») побочных реакций, либо недостаточной эффективности при применении того или иного препарата (пример рассмотрен выше), это служит для надзирательно-регуляторного органа не только громким сигналом тревоги, но и ориентирует в территориальных рамках для поиска и устранения источника опасности, раскручивания всего клубка возможного злонамеренного деяния.
Бдительность и осведомленность
Необходима интенсивная социально-ориентированная образовательная работа: очень важно напоминать людям об их собственной ответственности, о необходимости всегда соблюдать бдительность, быть настороже и направлять в FDA отчеты о подозрительных фактах, связанных с использованием лекарственных средств (рис. 3).
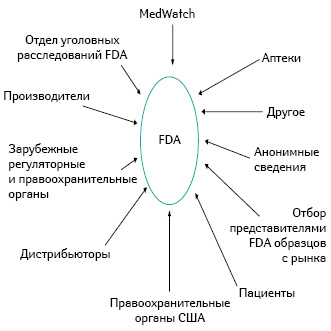
О чем нужно сообщать через MedWatch:
- серьезные побочные эффекты лекарственного средства;
- ненадлежащее качество продукта (подозрение на подделку, загрязнение, нестабильность, дефекты упаковки/маркировки);
- терапевтическая неэффективность (отсутствие ожидаемого терапевтического действия);
- ошибочное использование/применение лекарственного препарата/медицинского прибора.
В форме для подачи отчета в системе MedWatch надлежит заполнить несколько граф (контактные данные (телефон, факс, электронный адрес), имя пациента, название продукта, описание побочного действия или проблемы, данные лица, направляющего отчет). При этом много внимания уделяется защите конфиденциальности информации.
Судьба полученного отчета в MedWatch:
- отчет заносится в базу данных;
- база данных постоянно мониторируется специалистами FDA и рутинно монитурируется на поступление новых сигналов;
- описанные проблемы с лекарственным препаратом поступают для анализа в Систему отчетности о качестве лекарственных средств (Drug Quality Reporting System);
- в случае подозрения на поддельный препарат отчет отправляется также в Отдел криминальных расследований FDA;
- отчет изучается, оценивается, кодируется;
- отчет приоритезируется;
- определяются потенциальные опасности для общественного здравоохранения (в ходе консультаций с направившим отчет лицом, диагностическими службами, производителями и др.; для дальнейшего изучения, расследования, инспектирования, по необходимости);
- издается публичное предупредительное сообщение (public alert): через MedWatch (1 млн пользователей), через Counterfeit Alert Network (объединяющей работников здравоохранения, торговые организации, потребительский сектор).
Сотрудничество и партнерство
Согласно стратегии FDA, важно именно активно «проталкивать» информацию в массы, распространять ее как можно интенсивнее и шире, а не предоставлять ей вытекать пассивной струей лишь по запросу. Информация о фактах выявления контрафактной продукции размещается на сайте FDA, однако веб-сайт хорош в основном для передачи информации, — а чтобы найти ее самостоятельно, надо как минимум на него зайти. Поэтому в FDA разработана Система предупредительных сообщений о контрафактных лекарствах (FDA`s Counterfeit Alert Network), которая осуществляется объединенными усилиями коалиции медицинских работников и потребительских объединений и ставит перед собой три основных цели:
1) распространять среди широкой общественности предупредительные сообщения о подтвержденных случаях выявления контрафактных лекарственных средств на территории США и принимать меры по их недопущению для использования (например отзыв с рынка);
2) вырабатывать и предоставлять образовательную информацию о роли и ответственности, которые несут пациенты, фармацевты и другие медицинские работники, оптовые компании в сфере идентификации контрафактных лекарств, отправки предупредительных сообщений о контрафактных лекарствах, предотвращения проникновения последних в систему лекарственной дистрибьюции США;
3) объединить усилия национальных организаций, групп потребителей и представителей промышленности с целью максимального широкого распространения данной информации.
Частью подписанного ими договора является подготовка и рассылка образовательных сообщений относительно контрафактных, поддельных, отозванных с рынка или любых других проблемных лекарств. В ходе такого широкого распространения по принципу снежного кома информация об опасности быстро доходит до миллионов и миллионов людей. В настоящее время действующими членами FDA`s Counterfeit Alert Network являются авторитетные общественные организации США:
- Академия семейных врачей (American Academy of Family Physicians);
- Академия среднего медицинского персонала (American Academy of Nurse Practitioners);
- Академия врачей-ассистентов (American Academy of Physician Assistants);
- Колледж клинической фармации (American College of Clinical Pharmacy);
- Врачебный колледж (American College of Physicians);
- Академия управления предоставлением фармацевтической помощи (Academy of Managed Care Pharmacy);
- Медицинская ассоциация (American Medical Association);
- Ассоциация фармацевтов (American Pharmacist Association);
- Общество эстетической пластической хирургии (American Society for Aesthetic Plastic Surgery);
- Общество фармацевтов, работающих в системе здравоохранения (American Society for Health-System Pharmacists);
- Ассоциация управления предоставлением медицинской помощи (Healthcare Distribution Management Association);
- Национальная ассоциация аптечных сетей (National Association of Chain Drug Stores);
- Национальная ассоциация педиатрического среднего медицинского персонала США (National Association of Pediatric Nurse Practitioners);
- Национальная ассоциация коммунальных фармацевтов (National Community Pharmacists Association);
- Национальная потребительская лига (National Consumer League);
- Партнерство за безопасные лекарственные средства (Partnership for Safe Medicines);
- Врачебная коалиция за инъекционную безопасность (Physicians Coalition for Injectable Safety).
В правительстве США работает специальная группа по борьбе с контрафактными лекарственными средствами (Intra-governmental counterfeit medical product working group (FDA/Commerce & White House)), которая имеет прямой контакт с Белым домом, ведет тесное сотрудничество с Интерполом. Докладчик высоко оценила и подчеркнула значение деятельности ВОЗ в борьбе с фальсификатами — прежде всего Департамента ВОЗ по обеспечению качества и безопасности лекарственных средств, лекарственной политике и стандартам (WHO, Quality Assurance and Safety: Medicines (QSM), Department of Medicines Policy and Standards; координатор ВОЗ по обеспечению качества и безопасности лекарственных средств — д-р Лембит Раго), в частности Международной рабочей группы по противодействию контрафактной медицинской продукции (WHO International Medical Products Anti-Counterfeiting Taskforce — IMPACT; руководитель — присутствующая на семинаре д-р Сабине Копп) и отдела регуляторной поддержки QSM (руководитель — присутствующий на семинаре д-р Самвел Азатян). Между FDA и ВОЗ подписаны соглашения о сотрудничестве по созданию действенного глобального потенциала по надзору и мониторингу контрафактных лекарственных средств.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим