 Із 31 січня 2023 р. всі первинні заявки на клінічні випробування в Європейському Союзі (ЄС) повинні подаватися через Інформаційну систему клінічних випробувань (Clinical Trials Information System — CTIS). Тепер CTIS є єдиною точкою входу для спонсорів і регуляторів клінічних випробувань для подання та оцінки відповідних даних. Це відбулося після однорічного перехідного періоду, протягом якого спонсори могли обирати — подати заявку відповідно до Директиви про клінічні випробування чи згідно з новим Регламентом клінічних випробувань (№ 536/2014), який набув чинності 31 січня 2022 р.
Із 31 січня 2023 р. всі первинні заявки на клінічні випробування в Європейському Союзі (ЄС) повинні подаватися через Інформаційну систему клінічних випробувань (Clinical Trials Information System — CTIS). Тепер CTIS є єдиною точкою входу для спонсорів і регуляторів клінічних випробувань для подання та оцінки відповідних даних. Це відбулося після однорічного перехідного періоду, протягом якого спонсори могли обирати — подати заявку відповідно до Директиви про клінічні випробування чи згідно з новим Регламентом клінічних випробувань (№ 536/2014), який набув чинності 31 січня 2022 р.
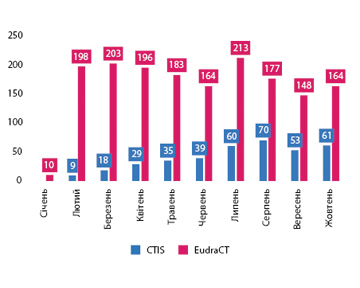
Загалом із моменту запуску системи 31 січня 2022 р. у CTIS подано 564 заявки на клінічні випробування, з яких 473 — первинні, 75 — на суттєві зміни та 16 — на додавання нової відповідальної держави-члена (рисунок). Про це йдеться в повідомленні Європейського агентства з лікарських засобів (European Medicines Agency — EMA) від 21 грудня (EMA/912178/2022).
У минулому спонсори повинні були подавати заявки на проведення клінічних випробувань окремо до національних компетентних органів і комітетів з етики в кожній країні. Реєстрація та публікація результатів також були окремими процесами. Завдяки CTIS спонсори тепер можуть подати заявку одразу в 30 країнах ЄС/Європейської економічної зони (ЄЕЗ) з однаковою документацією. Система включає загальнодоступну базу даних з можливістю пошуку для медичних працівників, пацієнтів та інших зацікавлених сторін.
Загалом Регламент передбачає трирічний перехідний період з 2022 до 2025 р. Перший рубіж досягнуто сьогодні; протягом наступних 2 років, до 31 січня 2025 р., усі поточні випробування, які були схвалені відповідно до Директиви, регулюватимуться новим Регламентом і мають бути переведені до CTIS.
Новий Регламент спрощує процеси подання заявки та нагляду за клінічними випробуваннями, а також їх публічну реєстрацію: тепер усі спонсори клінічних випробувань використовуватимуть одну систему та однакові процедури для подання заявки на дозвіл щодо проведення клінічних випробувань незалежно від того, де вони знаходяться, та з яким національним компетентним органом (NCA) або національним комітетом з етики вони мають справу.
За підтримку CTIS відповідає EMA, а впровадження Регламенту в цілому контролює Європейська комісія. Раніше повідомляли про недоліки в роботі порталу CTIS та невисоку активність на ньому заявників, що продовжували надавати перевагу подачі заявок згідно з Директивою.
За матеріалами www.ema.europa.eu

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим