?
За останнє десятиліття в результаті значних досягнень медичної науки у сфері вивчення молекулярних механізмів життєдіяльності клітини були розроблені нові високоефективні фармакологічні засоби для лікування найбільш поширених захворювань. Їх впровадження у клінічну практику стало одним із факторів, які сприяють розвитку світового фармацевтичного ринку. Так, обсяг продажу рецептурних та безрецептурних лікарських засобів у 2000 р. зріс на 10% порівняно з 1999 р. і досяг 317 млрд доларів США (IMS Health annual World Review, 2001). Що уможливило розроблення високоефективних препаратів? Насамперед нові досягнення у галузі фундаментальної біохімії мембран. На сьогодні ні в кого не викликає сумніву, що саме на рівні клітинної мембрани здійснюється контроль абсорбції фармакологічних засобів, їх розподіл у тканинах та елімінація. При пероральному прийомі молекула лікарського засобу проникає через мембрани клітин травного тракту, крові та кровоносних судин, нарешті, через мембрани клітин-мішеней, де реалізує свою фармакологічну дію.
Біологічні мембрани — це спеціальні утворення, які ізолюють вміст клітини від навколишнього середовища. У клітинах еукаріот мембрани утворюють низку важливих компартментів: ядро, мітохондрії, ендоплазматичний ретикулум, лізосоми тощо. Бар’єрна функція мембран забезпечується її гідрофобними компонентами — ліпідами та деякими білками.
Мембрани є високоактивними у метаболічному відношенні клітинними структурами. За їх участю відбуваються такі життєво важливі процеси, як транспорт сполук усередину та назовні клітини, рецепція гормонів та інших біологічно активних речовин, сигнальна трансдукція тощо. Слід зауважити, що різні типи мембран (плазматичні, мітохондріальні, ендоплазматичні, ядерні та ін.) мають різну будову, що й визначає їх функціональні властивості.
Фармакодинаміка та фармакокінетика деяких лікарських препаратів здійснюється на рівні клітинних мембран. На жаль, існуюча класифікаційна система ВООЗ — АТС не дозволяє скласти загальну картину наявності на світовому фармацевтичному ринку лікарських засобів із мембранотропною дією. Все ж аналіз продажу препаратів за терапевтичними категоріями дає інформацію про питому частку препаратів, що мають мембранотропні властивості, у загальній структурі світового фармацевтичного ринку.
ПРЕПАРАТИ-БЕСТСЕЛЕРИ 2000 РОКУ
Згідно з даними, наведеними у часописі «Scrip» (№ 2630, 30 березня 2001 р., c.18), обсяг продажу лікарських препаратів на світовому фармацевтичному ринку (60 країн) у 2000 р. (табл. 1) зріс на 10%. Найдинамічнішим фармацевтичним ринком світу залишилася Північна Америка, приватні компанії та державні структури якої спрямовують значні кошти, порівняно з іншими країнами, у дослідження та розроблення нових препаратів. Обсяг продажу лікарських препаратів у цьому регіоні збільшився за минулий рік на 14%, досягнувши 152,8 млрд доларів США, що становить майже половину світового обсягу продаж. Друге і третє місця посідають Європа та Японія, обсяг продажу лікарських засобів яких становить відповідно 75,3 і 54,5 млрд доларів США. Цікаво, що найвищі темпи зростання обсягу продажу лікарських засобів зареєстровано у Мексиці та Польщі — на 25 та 19% відповідно.
Таблиця 1
Світовий обсяг продажу лікарських засобів на 60 національних ринках світу у 2000 р.
|
Регіон |
Обсяг продажу (млрд доларів США) |
Частка світового обсягу продажу, % |
Зміна по відношенню до 1999 р., % |
| Північна Америка |
152,8 |
48,2 |
+14 |
| Європа |
75,3 |
23,7 |
+8 |
| Японія |
51,5 |
16,2 |
+3 |
| Південна Америка |
18,9 |
6,0 |
+9 |
| Азія (крім Японії), Африка та Австралія |
18,7 |
5,9 |
+10 |
| Всього |
317,2 |
100,0 |
+10 |
У минулому році спостерігався найбільший відсоток приросту (понад 20%) обсягу продажу препаратів таких терапевтичних груп, як холестеринзнижувальні, нестероїдні протизапальні, антипсихотичні та пероральні антидіабетичні засоби. Найбільшим попитом користувалися противиразкові препарати (табл. 2).
Таблиця 2
Терапевтичні класи лікарських засобів — лідери на світовому ринку в 2000 р.
|
Клас лікарських засобів |
Обсяг продажу (млрд доларів США) |
Частка світового обсягу продажу, % |
Зміна по відношенню до 1999 р., % |
| Противиразкові |
17,4 |
5,5 |
+13 |
| Холестеринзнижувальні |
15,9 |
5,0 |
+21 |
| Антидепресанти |
13,4 |
4,2 |
+18 |
| Антагоністи кальцію |
9,8 |
3,1 |
+2 |
| Нестероїдні протизапальні |
9,5 |
3,0 |
+26 |
| Інгібітори ангіотензинперетворювального фермента |
7,3 |
2,3 |
+3 |
| Цефалоспорини та їх комбінації |
6,9 |
2,2 |
–5 |
| Антипсихотичні |
6,0 |
1,9 |
+22 |
| Ненаркотичні анальгетики |
6,0 |
1,9 |
+3 |
| Пероральні антидіабетичні |
5,9 |
1,9 |
+26 |
Лідером серед препаратів-бестселерів на світовому фармацевтичному ринку є противиразковий препарат Лозек (омепразол) компанії «АстраЗенека», обсяг продажу якого за минулий рік збільшився на 9% і становив 6,1 млрд доларів США (табл. 3). На цей лікарський засіб у жовтні поточного року закінчується термін дії патенту в США та інших країнах світу. Найбільший відсоток приросту обсягу продажу (65%) порівняно з 1999 р. має препарат інгібітора циклооксигенази-2 — Целебрекс (целекоксиб) виробництва компаній «Фармація»/«Пфайзер», обсяг продажу якого у 2000 р. становив 2,4 млрд доларів США.
Таблиця 3
Препарати-бестселери на світовому фармацевтичному ринку в 2000 р.
|
Препарати |
Обсяг продажу (млрд доларів США) |
Частка світового обсягу продажу, % |
Зміна по відношенню до 1999 р., % |
| Лосек/Прилосек (омепразол) |
6,1 |
1,9 |
+9 |
| Ліпітор/Ліпримар (аторвастатин) |
5,4 |
1,7 |
+44 |
| Зокор (симвастатин) |
4,4 |
1,4 |
+15 |
| Норваск (амлодипін) |
3,3 |
1,1 |
+15 |
| Огастро/Превацид (лансопразол) |
3,1 |
1,0 |
+33 |
| Прозак (флуоксетин) |
2,9 |
0,9 |
–1 |
| Сероксат/Паксил (пароксетин) |
2,4 |
0,8 |
+20 |
| Зипрекса (оланзапін) |
2,4 |
0,8 |
+30 |
| Целебрекс (целекоксиб) |
2,4 |
0,7 |
+65 |
| Золофт (сертралін) |
2,2 |
0,7 |
+12 |
Слід зауважити, що клітинні мембрани є мішенню дії практично всіх названих препаратів-бестселерів. Крім того, кожна з представлених терапевтичних груп препаратів включає різноманітні лікарські засоби, механізм дії яких полягає у впливі на клітинні мембрани та їх компоненти. Оскільки неможливо докладно охарактеризувати препарати всіх терапевтичних груп у рамках даної публікації, доцільно розглянути окремі мембранотропні ефекти препаратів-бестселерів. Однак попередньо слід ознайомитися з сучасними уявленнями про фармакологію біологічних мембран.
СКЛАД КЛІТИННИХ МЕМБРАН
Фізико-хімічні властивості мембрани (рідинність, флексибільність, здатність до агрегації тощо) визначаються, зокрема, її фосфоліпідним складом.
Фосфоліпіди є структурними компонентами біологічних мембран (рис. 1). Один кінець їх молекули містить два ліпофільні жирно-кислотні ланцюги, другий — гідрофільну іонізовану групу (залишок фосфорної кислоти та основи). Ці молекули впорядковані у фосфоліпідний бішар (рис. 2), який має вигляд сендвіча. На рисунку круглі «головки» представляють іонізовану частину молекули, а «хвости» — ацильні залишки жирних кислот. Центральна частина мембрани містить ліпофільні молекули холестерину, який ущільнює її. Завдяки цьому феномену взаємодія між ліпофільними компонентами мембрани посилюється, мембрана ефективно утримує внутрішній вміст клітини, не даючи йому «вилитися».
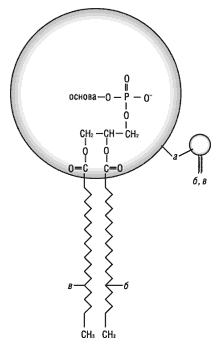
Рис. 1. Хімічна структура фосфоліпіду:
а – полярна (гідрофільна) «головка» (залишок фосфорної кислоти та основи); б, в – неполярні (ліпофільні) ланцюги жирних кислот; г – схематичне зображення молекули фосфоліпіду (цей та інші рисунки з модифікаціями взяті з сайта )
Одним із найбільш метаболічно активних фосфоліпідів є фосфатидилінозитол. Під впливом фермента фосфоліпази С від нього відщеплюється інозитолтрифосфат, який стимулює вихід кальцію в клітину із внутрішньоклітинних депо, що може спричинити скорочення гладких м’язів судин. Тому в лікуванні серцево-судинних захворювань особливого значення надають пригніченню цього шляху обміну фосфатидилінозитолу, що ефективно здійснюється антагоністами кальцію. Крім того, посилений метаболізм фосфатидилінозитолу відіграє важливу роль в патогенезі маніакальних станів. Солі літію, ефективні при біполярних розладах, пригнічують цей біохімічний процес.
Оскільки полярні (іонізовані) головки фосфоліпідів знаходяться на зовнішній та внутрішній поверхні мембранного «сендвіча», то з ними активно взаємодіють позитивно та негативно заряджені іони. Товща ліпідного матриксу мембрани пронизана білковими молекулами, які виконують у клітині різноманітні функції (див. рис. 2), зокрема рецепторні, ферментативні, канальні тощо. Деякі білки, змінюючи свою динамічну структуру під дією відповідних фармакологічно активних сполук, виконують канальну функцію, формуючи мембранні пори для іонів та малих молекул.
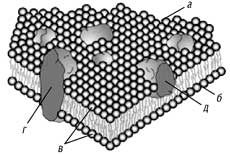
Рис. 2. Молекулярна будова плазматичної мембрани:
а – зовнішний листок плазматичної мембрани; б – внутрішній листок плазматичної мембрани; в – ліпідний бішар, утворений молекулами фосфоліпідів; г – інтегральний білок, який пронизує всю товщу мембрани; д – периферійний білок, що нековалентно зв’язаний із зовнішнім листком мембрани
Зовнішня та внутрішня гідрофільна поверхня мембрани вкрита водною кристалічною решіткою. Перш ніж молекула лікарського засобу зв’яжеться зі специфічним мембранним рецептором або пройде через мембрану, водна кристалічна решітка має бути частково зруйнована. Речовини перетинають мембранний бар’єр за допомогою активного їх транспорту всередину клітини. Цей процес здійснюється за допомогою спеціальних білків-насосів — натрієвого, кальцієвого, хлорного, протонного та ін.
У складі зовнішнього листка плазматичної мембрани знаходяться також вуглеводи, які ковалентно приєднані до білків (глікопротеїди) та ліпідів (гліколіпіди). Вважають, що основна їх функція — участь у процесах міжклітинного розпізнавання, рецепції біологічно активних молекул та забезпеченні імунологічних властивостей клітин.
ТРАНСПОРТ ПРЕПАРАТІВ ЧЕРЕЗ МЕМБРАНУ
Мембрана здійснює вибірковий транспорт лікарських засобів усередину та назовні клітини. Розрізняють пасивний та активний транспорт сполук через мембрану. Перший відбувається без затрат енергії, а здійснення другого потребує енергетичних затрат клітини. Оскільки ліпідний бішар виявляє гідрофобні властивості, він є непроникним для більшості полярних молекул. У складі мембран містяться білкові молекули, які здійснюють транспорт полярних молекул по обидва боки мембрани. Так, перенесення малих водорозчинних молекул здійснюється за допомогою спеціальних транспортних білків. Макромолекули (білки) транспортуються за допомогою ендоцитозу.
Через плазматичну мембрану шляхом пасивного транспорту всередину клітини здійснюється перенесення таких полярних речовин, як амінокислоти, цукри, нуклеотиди тощо. Оскільки вони неспроможні вільно дифундувати через мембранні структури, то їх транспорт усередину клітини здійснюється за допомогою відповідних білків.
У разі коли молекула не заряджена, напрям її дифузії визначається градієнтом концентрації (різницею концентрації по обидва боки плазматичної мембрани) — сполука переходить із зони з підвищеною концентрацією у зону з пониженою. На напрям руху заряджених речовин впливає також різниця потенціалів, яка виникає між полярними головками ліпідів та білків зовнішнього та внутрішнього листка мембрани. Отже, всі канальні протеїни та деякі білки-транспортери здійснюють перенесення полярних сполук усередину або назовні клітини за їх електрохімічним градієнтом.
У складі білків-транспортерів є певні ділянки зв’язування, специфічні для конкретної речовини, яку необхідно перенести через мембрану. Зв’язування можна блокувати за допомогою конкурентних та неконкурентних інгібіторів, що важливо з фармакологічної точки зору. Перші зв’язуються з тими самими активними центрами білка, що й речовина, а другі — в інших місцях білка, внаслідок чого відбувається зміна його конформації з наступним порушенням активності молекули-транспортера.
Часто виникає необхідність забезпечити перенесення молекул через мембрану проти їх електрохімічного градієнта (активний транспорт), що здійснюється відповідними білками-транспортерами із затратами енергії. Головним джерелом енергії в клітині є гідроліз АТФ до АДФ та фосфорної кислоти. За рахунок енергії, яка виділяється при гідролізі АТФ під впливом фермента АТФази, здійснюється активний транспорт речовин. Наприклад, такі системи активного транспорту, як Na+/K+-АТФаза, одночасно посідають АТФазну активність, завдяки чому вони можуть здійснювати транспорт катіонів натрію, калію, кальцію, магнію проти їх електрохімічного градієнта. Na+K+-АТФаза викачує іони натрію із клітини, забезпечуючи натомість надходження до неї іонів калію. Так само Ca+/Mg+-АТФаза забезпечує викачування іонів кальцію із клітини та надходження до неї іонів магнію.
ВЗАЄМОДІЯ ПРЕПАРАТІВ З МЕМБРАНАМИ
Слід зазначити, що тільки невелика кількість лікарських засобів проникає в клітину шляхом активного транспорту. Більшість з них абсорбуються, розподіляються та екскретуються за допомогою механізмів пасивного транспорту із зони високої їх концентрації в зону низької. Пасивна дифузія не потребує для свого здійснення спеціальних каналів. Натомість лікарські засоби «розчиняються» в ліпофільному мембранному матриксі й проникають через нього.
Ідеальною є комбінація гідро- та ліпофільних властивостей молекули лікарського засобу, завдяки чому ця молекула ефективно розчиняється у водному та ліпідному середовищах. Якщо препарат розчинний тільки у водному середовищі або тільки у ліпідах, він не здійснюватиме системної дії у зв’язку з поганою проникністю через мембрани.
Більшість лікарських засобів мають властивості слабких кислот або основ, несучи загальний позитивний або негативний заряд своєї молекули. Тому їх перенесення через мембрану залежить від рН мікрооточення. Незаряджені ліпофільні молекули проникають через мембрану набагато швидше, ніж заряджені гідрофільні.
Секрети різних відділів травного тракту мають широкий діапазон рН — від кислого (рН 1–3) у шлунку до лужного (рН 5–7) у верхньому відділі тонкого кишечнику та рН 8 — у товстому кишечнику. У кислому середовищі добре всмоктуються препарати з властивостями слабких кислот, наприклад ацетилсаліцилова кислота, карбоксильна група (–СОО–) якої, взаємодіючи з протоном (Н+), перетворюється на неіонізовану (–СООН) групу, що легко проникає через мембрани епітеліальних клітин шлунка.
Органічні основи (наприклад, алкалоїди, аміни) у шлунку знаходяться в іонізованому (позитивно зарядженому) стані, тому абсорбція через стінку шлунка здійснюватися не може. При лужному рН більша частина таких молекул перебуває в електрично нейтральному стані (завдяки зв’язуванню з гідроксильними ОН–-групами). У цьому стані молекули легко проникають через мембрани ентероцитів.
Здавалося б, молекули лікарського засобу, які виявляють властивості слабкої кислоти, не повинні всмоктуватися в тонкому кишечнику, оскільки в лужному середовищі вони дисоціюють, втрачаючи позитивно заряджений протон і набуваючи негативного заряду. Однак експериментальні дослідження свідчать, що навіть у цьому відділі травного тракту такі препарати (наприклад, ацетилсаліцилова кислота) добре всмоктуються. Цей парадоксальний факт має пояснення. Відомо, що ентероцити тонкого кишечнику формують спеціальні структури — ворсинки, які контактують зі значною кількістю малих кровоносних судин. Завдяки цим утворенням площа поверхні тонкого кишечнику зростає в декілька сотень раз. Фізіологічною функцією ворсинок є забезпечення належного всмоктування компонентів, які виявляють гідрофобні та гідрофільні властивості, однак не спроможні проникнути через мембрану шляхом пасивної дифузії. На рівні ворсинок здійснюється всмоктування негативно заряджених молекул препарату — велика площа сприяє сумарно істотному всмоктуванню лікарських засобів із низькою тенденцією до дифузії.
МЕМБРАННІ РЕЦЕПТОРИ ЛІКАРСЬКИХ ЗАСОБІВ
Рецептори фармакологічно активних речовин є макромолекулярними компонентами мембран. Їх взаємодія з молекулами лікарського засобу сприяє активації шляхів сигнальної трансдукції. Рецептори відіграють важливу роль у життєдіяльності людського організму, беручи участь у трансформації нейрогуморального сигналу у внутрішньоклітинні вторинні сигнали. Встановлено, що найчастіше рецепторами лікарських засобів є білкові молекули, хоча в окремих випадках цю функцію виконують нуклеїнові кислоти або вуглеводи.
Молекули деяких препаратів можуть нековалентно вбудовуватися між парами нуклеотидів, що знаходяться на протилежних ланцюгах спіралі ДНК (інтеркаляція). Як наслідок, порушується геометрія та просторова структура ДНК, що призводить до зміни активності цієї молекули.
Деякі рецептори (наприклад, для стероїдів) є розчинними білками, що містяться в цитоплазмі клітини. Ліпофільні молекули стероїдних гормонів легко дифундують через клітинну мембрану, взаємодіючи з цими рецепторами. Після цього комплекс стероїд — рецептор мігрує до ядра та взаємодіє з іншою рецепторною макромолекулою, реалізуючи специфічний фармакологічний ефект стероїдних гормонів.
Є два види пов’язаних із мембранами рецепторів — іонні канали та рецептори, пов’язані з G-білком. Наприклад, рецептором для ацетилхоліну та деяких подібних до ацетилхоліну лікарських засобів є натрієвий канал. Ацетилхолін і згадані препарати зворотно зв’язуються з канальним протеїном, спричинюючи в ньому конформаційні зміни, що сприяє відкриттю каналу та проникненню іонів натрію всередину клітини. Цей процес лежить в основі нервового збудження. Деякі лікарські засоби, взаємодіючи з білком натрієвого каналу, запобігають його відкриттю, тим самим блокуючи передачу нервового збудження.
До внутрішньої частини плазматичної мембрани клітин приєднується так званий G-білок, який забезпечує синхронізацію процесу рецепції лікарського засобу з активацією відповідних внутрішньоклітинних білків-мішеней. Як показано на рис. 3, молекула лікарського засобу (зображена трикутником) взаємодіє з рецептором на зовнішній поверхні мембрани, що призводить до конформаційних змін рецепторного білка. Завдяки цьому G-білок змінює своє просторове розташування. Останній мігрує з площини мембрани до ферментів, які перебувають у неактивному стані. Взаємодія G-білка з ферментами спричинює активацію ферментів. Норадреналін, дофамін та ліганди зв’язуються саме з рецепторами, пов’язаними з G-білком. Зауважимо, що ацетилхолін, окрім взаємодії з канальними білками, зв’язується також з рецепторами, пов’язаними з G-білком.
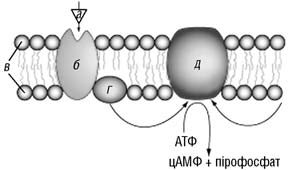
Рис. 3. Взаємодія ліганду з клітинним рецептором:
а – ліганд (наприклад, фармакологічно активна речовина); б – специфічний рецептор до ліганду; в – ліпідний бішар; г – G-білок, який після утворення комплексу ліганду з рецептором зв’язується з аденілатциклазою; д – аденілатциклаза, яка гідролізує молекулу АТФ з утворенням вторинного посередника – циклічного аденозинмонофосфату (цАМФ), що регулює активність багатьох ферментів всередині клітини
СИГНАЛЬНА ТРАНСДУКЦІЯ
Важливою функцією клітинних мембран є зв’язування біологічно активних речовин (лігандів) зі специфічними рецепторами, внаслідок чого утворюються вторинні месенджери (посередники), які перетворюють зовнішні сигнали у внутрішні (цей процес отримав назву сигнальної трансдукції), деякі з них безпосередньо впливають на функцію геному. Внутрішньоклітинна передача сигналів лежить в основі таких процесів, як скорочення м’язів, клітинний поділ, проліферація та диференціація тощо (Hagedorn H.G., Bachmeier B.E., Nerlich A.G. Synthesis and degradation of basement membranes and extracellular matrix and their regulation by TGF-beta in invasive carcinomas (Review). Int. J. Oncol. — 2001. — 18(4). — Р. 669–681).
На сьогодні відкрито цілу низку сигнальних молекул, до яких відносяться гормони, біологічно активні пептиди, нуклеотиди, стероїди, ейкозаноїди, низькомолекулярні біорегулятори — оксид азоту (NO), оксид вуглецю (CO) та ін. Клітина має специфічні рецептори до цих біологічно активних речовин. У результаті зв’язування ліганду зі специфічним рецептором утворюються вторинні месенджери, які запускають каскад біохімічних реакцій, що спричинюють експресію (активацію) певних генів.
ПРЕПАРАТИ-БЕСТСЕЛЕРИ ЯК МЕМБРАНОТРОПНІ ЗАСОБИ
Наведені у табл. 3 дані свідчать, що в 2000 р. найбільше було реалізовано лікарських засобів, які впливають на травну (омепразол та лансопразол) і серцево-судинну системи (аторвастатин, симвастатин, амлодипін), опорно-руховий апарат (целекоксиб), нервову систему (флуоксетин, пароксетин, сертралін). До препаратів, які широко застосовуються у клінічній практиці, належать інгібітори протонного насосу, інгібітори 3-гідрокси-3-метилглутарил коензиму А (ГМГ-КоА) редуктази (статини), антагоністи кальцієвих каналів, селективні інгібітори індуцибельної циклооксигенази-2, інгібітори зворотного захвату серотоніну тощо. Практично всі вони мають мембранотропну дію.
Інгібітори протонного насосу (омепразол та лансопразол), зв’язуючись з білком цієї помпи, блокують секрецію Н+ парієтальними клітинами шлунка.
Інгібітори ГМГ-КоА редуктази (аторвастатин, симвастатин та ін.), окрім вираженого холестеринзнижувального ефекту в крові, здатні покращувати ендотеліальну функцію завдяки своїм мембранотропним властивостям (van Nieuw Amerongen G.P., Vermeer M.A., Negre-Aminou P., Lankelma J., Emeis J.J., van Hinsbergh V.W. Simvastatin improves disturbed endothelial barrier function // Circulation. — 2000. — 102(23). — Р. 2803–2809). Останнім часом все більше фахівців вважають, що позитивний вплив статинів на прогноз гострого інфаркту міокарда не можна пов’язувати виключно з нормалізацією рівня холестерину в крові. Не виключено, що корекція ендотеліальної дисфункції, яка є важливим фактором патогенезу ішемічної хвороби серця, під впливом статинів може попереджувати фатальні гострі коронарні напади.
Антагоністи кальцію (наприклад, амлодипін) зв’язуються з кальцієвими каналами сарколеми гладких м’язів судин і ефективно вбудовуються в фосфоліпідний бішар клітинних мембран ендотеліоцитів та міоцитів. Висока спорідненість амлодипіну до фосфоліпідного бішару зумовлює його пролонговану дію, що дозволяє уникнути деяких несприятливих ефектів, характерних для ніфедипіну короткої дії (Tulenko T.N., Sumner A.E., Chen M., Huang Y., Laury-Kleintop L., Ferdinand F.D. The smooth muscle cell membrane during atherogenesis: a potential target for amlodipine in atheroprotection // Am. Heart. J. — 2001. — 141(2 Suppl). — Р. S1–S11; Stevenson A.S., Cartin L., Wellman T.L., Dick M.H., Nelson M.T., Lounsbury K.M. Membrane depolarization mediates phosphorylation and nuclear translocation of CREB in vascular smooth muscle cells // Exp. Cell. Res. — 2001. — 263(1). — Р. 118–130).
Деякі запальні процеси, які уражають опорно-руховий апарат, супроводжуються активацією індуцибельної циклооксигенази-2, яка в нормальних умовах перебуває в неактивному стані. Цей фермент перетворює арахідонову кислоту, яка відщепилася від фосфоліпідів мембран, у біологічно активні ейкозаноїди — простагландини та простацикліни. Деякі з них беруть участь у розвитку запального процесу та больового синдрому. В нормі під впливом фермента конститутивної циклооксигенази-1, яка, на відміну від циклооксигенази-2, постійно експресується, здійснюється синтез ейкозаноїдів, що відіграють цитопротекторну роль по відношенню, зокрема, до клітин слизової оболонки шлунка. Застосування неселективних інгібіторів циклооксигенази, окрім позитивного впливу на перебіг запального процесу, може негативно впливати на цілість клітин слизової оболонки. Тому значним досягненням сучасної фармакології є створення селективного інгібітора циклооксигенази-2 — целекоксибу. Цей препарат дозволяє досягати значного терапевтичного ефекту без пошкодження клітин травного тракту.
Депресивні стани супроводжуються порушенням серотонінергічної іннервації в ЦНС. Більш того, з дефіцитом серотоніну в мозку пов’язують суїцидальну готовність пацієнтів з депресією. Блокатори зворотного захвату 5-гідрокситриптаміну (серотоніну) — флуоксетин, пароксетин та сертралін — діють на рівні пресинаптичної мембрани серотонінергічних нервових закінчень. Зв’язуючись зі спеціальними транспортерами 5-гідрокситриптаміну, вони блокують зворотний вхід цього нейромедіатора в астроцити, що спричинює підвищення його рівня у синаптичній щілині (Inazu M. et al., 2001; Mulchahey J.J. et al., 1999).
Наведені факти свідчать, що названі вище лікарські засоби виявляють мембранотропну дію, стабілізуючи клітинні мембрани та модулюючи пов’язані з нею функції. У лабораторіях провідних фармацевтичних компаній триває розроблення нових лікарських засобів з урахуванням особливостей їх взаємодії з мембранними структурами. Такий підхід допомагає створювати препарати пролонгованої дії, які здатні поступово переходити з плазматичної мембрани всередину клітини і на стабільному рівні реалізувати свій фармакологічний ефект.
Віктор Маргітич

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим