?
28 февраля 2001 г. состоялось расширенное заседание научно-экспертного совета Государственного фармакологического центра Министерства здравоохранения Украины (ГФЦ), посвященное итогам работы за 2000 г. В заседании приняли участие министр здравоохранения Украины Виталий Москаленко, президент Академии медицинских наук Украины (АМН) Александр Возианов, директор Государственного фармакологического центра МЗ Украины Александр Стефанов.
В своем докладе А. Стефанов отметил, что в начале 2000 г. Украинское правительство оказалось под беспрецедентным прессом Европейского Союза (ЕС). Получение Украиной кредитов Всемирного банка было поставлено в зависимость от результатов аудита Национального банка, снятия льгот с «АвтоЗАЗ-ДЭУ» и гармонизации украинского законодательства с таковым стран ЕС. Официальные органы предъявили Украине ряд претензий по поводу длительности, сложности и непрозрачности процедуры регистрации (перерегистрации) лекарственных средств, проволочек с принятием решений и т.д. Кроме того, состояние нормативной базы в этой области было несовместимо с рядом положений Генерального соглашения по тарифам и торговле (ГАТТ), требованиями Мировой организации торговли (МОТ). Именно эти вопросы обсуждались на итоговом заседании Министерства здравоохранения и ГФЦ Украины.
В настоящее время система обеспечения качества лекарственных препаратов включает три этапа.
· Регистрация лекарственных средств, осуществляемая ГФЦ.
· Контроль производства лекарственных препаратов, который в настоящее время осуществляет Государственный департамент по контролю за качеством, безопасностью и производством лекарственных средств и изделий медицинского назначения (Государственный департамент).
· Государственный контроль качества лекарственных препаратов на этапе реализации, который осуществляет Государственная инспекция по контролю качества лекарственных средств (ГИКК).
Таким образом, на первом этапе осуществляется контроль за разработкой и внедрением новых препаратов, на втором — контроль за производством лекарственных средств, на третьем — за их распространением. Такая система соответствует, как отметил А. Стефанов, Конвенции ЕС РН-7/94 от 13.07.94 г., Директиве 75/319 ЕС, а также рекомендациям ВОЗ.
До последнего времени ГФЦ имел статус государственного предприятия, что согласно ст. 1 закона Украины «О предпринимательстве в Украине» предполагает работу на хозрасчетных условиях, в том числе в целях получения прибыли. В ближайшее время юридический статус ГФЦ будет пересмотрен. В ходе административной реформы он получит статус органа административно-хозяйственного управления и контроля согласно ст.1 закона Украины «О защите экономической конкуренции».
Наиболее важным результатом деятельности ГФЦ за 2000 г., отметил А. Стефанов, является подготовка принятого Кабинетом Министров Украины постановления «Об утверждении Порядка государственной регистрации (перерегистрации) лекарственного средства и размеров сбора за государственную регистрацию (перерегистрацию) лекарственного средства» от 13.09.2000 г. № 1422 («Еженедельник АПТЕКА», № 37 (258) от 25 сентября 2000 г.).
Порядок государственной регистрации в настоящее время соответствует четырем основным требованиям ГАТТ/МОТ: регистрация лекарственного средства «на заявителя»; перерегистрация лекарственного средства только в случае окончания срока действия регистрационного свидетельства или в случае серьезных изменений состава лекарственного средства; продление срока действия регистрационного свидетельства в случае, если выдача нового свидетельства задерживается по не зависящим от заявителя причинам; установление одинаковых для резидентов и нерезидентов размеров сбора за государственную регистрацию лекарственных средств. А. Стефанов отметил, что по сравнению с большинством европейских стран стоимость регистрации лекарственных средств в Украине невелика (рис. 1).
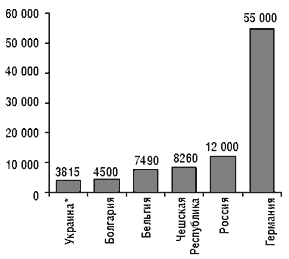
* С учетом регистрационного сбора
Рисунок 1. Стоимость регистрации лекарственного средства в различных странах (в долларах США)
В стоимость регистрации лекарственного препарата входят: стоимость государственного регистрационного сбора и стоимость проведения экспертизы в ГФЦ Украины. В настоящее время введены предельные тарифы на проведение экспертизы (см. «Еженедельник АПТЕКА» № 13 (234) от 3 апреля 2000 г.), в связи с чем стоимость ее существенно снизилась. В I квартале 2001 г. планируется внести в существующие тарифы изменения и уточнения, в которых будут учитываться особенности экспертизы различных препаратов, влияющие на ее стоимость. Стоимость государственных регистрационных сборов также существенно снизилась. Как утверждает А. Стефанов, в настоящее время стоимость регистрации лекарственного препарата в Украине практически не влияет на его рыночную цену. На сегодня в Украине зарегистрировано 7571 лекарственных препаратов (рис. 2, 3), в том числе в 2000 г. были зарегистрированы (перерегистрированы) 1334 препарата (таблица 1).
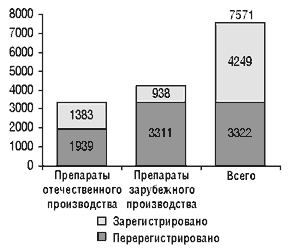
Рисунок 2. Количество зарегистрированных (перерегистрированных) лекарственных средств в Украине по состоянию на 01.01.2001 г.
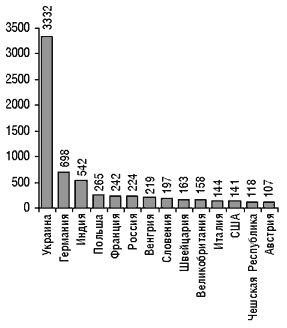
Рисунок 3. Распределение зарегистрированных в Украине лекарственных средств в зависимости от стран-производителей (первые 14 стран)
Таблица 1
Количество лекарственных средств, зарегистрированных (перерегистрированных) в Украине в 2000 г. в зависимости от стран-производителей
|
Страна |
Количество |
Страна |
Количество |
Страна |
Количество |
|
Украина |
376 |
Австрия |
17 |
Литва |
3 |
|
Индия |
170 |
Швейцария |
16 |
Греция |
3 |
|
Германия |
161 |
Словакия |
16 |
Босния и Герцеговина |
3 |
|
Словения |
56 |
Нидерланды |
16 |
Австралия |
3 |
|
Венгрия |
50 |
Югославия |
12 |
Швеция |
2 |
|
Франция |
49 |
Россия |
12 |
Хорватия |
2 |
|
Польша |
48 |
Канада |
11 |
Корея |
2 |
|
Чешская Республика |
46 |
Испания |
10 |
Ирландия |
2 |
|
Китай |
39 |
Эстония |
8 |
Норвегия |
1 |
|
Болгария |
36 |
Беларусь |
8 |
Мексика |
1 |
|
Италия |
32 |
Вьетнам |
7 |
Индонезия |
1 |
|
Великобритания |
27 |
США |
6 |
Армения |
1 |
|
Бельгия |
27 |
Израиль |
5 |
Бразилия |
1 |
|
Латвия |
20 |
Египет |
4 |
Аргентина |
1 |
|
Дания |
20 |
Финляндия |
3 |
Всего |
1334 |
Следует отметить, что стоимость регистрации должна оцениваться исходя из объема рынка, на который поступает тот или иной препарат. По оценкам Государственного департамента, объем украинского рынка лекарственных препаратов составляет около 500 млн долларов США, в то время как в стране с населением 50 млн человек он должен составлять 3 млрд долларов (см. «Еженедельник АПТЕКА», № 5 (276) от 5 февраля 2001 г.).
Необходимым условием выхода отечественных лекарственных препаратов на международный рынок является проведение клинических исследований по изучению их биоэквивалентности. До недавнего времени в Украине отсутствовала нормативная база для проведения этих исследований. В 2000 г. ГФЦ подготовил ряд документов по этому вопросу: «Инструкцию о проведении клинических испытаний лекарственных средств и экспертизы материалов клинических испытаний», «Типовое положение о комиссии по вопросам этики», которые были утверждены приказом МЗ и зарегистрированы Министерством юстиции Украины. Немедленное введение этих нормативных актов, отметил А. Стефанов, приведет к тому, что ни одно украинское предприятие не сможет зарегистрировать новые лекарственные препараты и перерегистрировать старые. Поэтому введение такого требования для всех лекарственных препаратов, которые поступают на украинский фармацевтический рынок, отсрочено, с тем чтобы отечественные предприятия могли к нему подготовиться.
Как сообщил А. Стефанов, в настоящее время в Украине действует достаточно простая и прозрачная схема регистрации лекарственных препаратов (рис. 4), которая будет еще дорабатываться и уточняться. Заместитель директора ГФЦ доктор медицинских наук Татьяна Бухтиарова отметила в своем выступлении, что будут уточнены критерии, согласно которым препарат подлежит дополнительной экспертизе. Разрабатывается механизм внесения изменений в регистрационное досье в период действия регистрации. Согласно директивным документам ЕС разработчик может вносить изменения в технологию, инструкцию по применению препарата, и эти изменения должны быть одобрены соответствующими компетентными органами. Подобные изменения делятся на две группы: изменения, которые не требуют перерегистрации препарата, и изменения, при которых она необходима. К первым относятся незначительные изменения, связанные с изменением названия препарата, незначительными изменениями его состава, наименования заявителя, например, введение или изменение вкусовых добавок. Кроме того, выявление побочных действий (эффектов) при применении препарата также может инициировать вопрос о регистрационном статусе препарата. В такой ситуации необходимо в течение 24 часов провести соответствующее расследование. По мнению Татьяны Бухтиаровой, упрощение процедуры внесения изменений в регистрационное досье, снижение стоимости экспертизы этих материалов способствовало тому, что в 2000 г. (по сравнению с 1999 г.) в 2,5 раза увеличилось количество изменений, внесенных в регистрационное досье лекарственных препаратов.
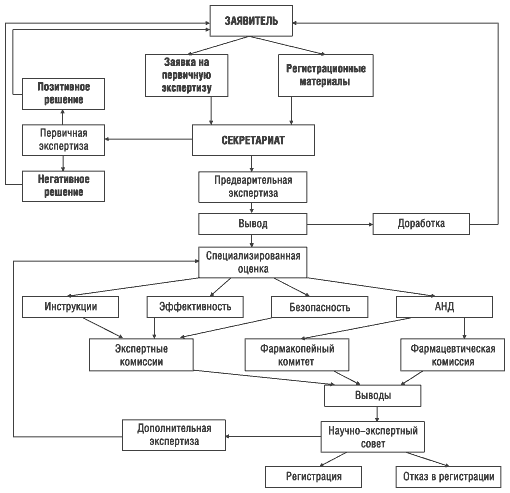
Рисунок 4. Основные этапы экспертизы лекарственных средств
В 2000 г. зарегистрировано/перерегистрировано 140 субстанций, что составляет 16,2% от общего количества субстанций, зарегистрированных (перерегистрированных) в Украине по состоянию на 01.01.2001 г., и 10,4% от общего количества зарегистрированных (перерегистрированных) в 2000 г. лекарственных средств (табл. 2).
Таблица 2
Распределение в 2000 г. лекарственных средств, зарегистрированных (перерегистрированных)
в Украине, по лекарственным формам
| ? |
Количество |
В том числе |
| Твердые лекарственные формы |
543 |
? |
| Таблетки | ? |
415 |
| Капсулы | ? |
85 |
| Драже | ? |
28 |
| Гранулы | ? |
15 |
| Жидкие лекарственные формы |
164 |
? |
| Капли | ? |
52 |
| Сиропы | ? |
28 |
| Аэрозоли | ? |
28 |
| Бальзамы | ? |
16 |
| Настойки | ? |
14 |
| Суспензии | ? |
14 |
| Масла | ? |
5 |
| Эмульсии | ? |
4 |
| Шампуни | ? |
3 |
| Мягкие лекарственные формы |
120 |
? |
| Мази | ? |
38 |
| Гели | ? |
34 |
| Кремы | ? |
25 |
| Суппозитории | ? |
23 |
| Лекарственные формы для инъекций |
173 |
? |
| Аэрозоли, спреи |
35 |
? |
| Субстанции |
140 |
? |
| Лекарственное растительное сырье |
23 |
? |
| Другие |
136 |
? |
| Всего |
1334 |
? |
Готовые лекарственные средства представлены преимущественно в твердых формах и лекарственных формах для инъекций, на которые приходится 46,4 и 14,8% всех препаратов соответственно. Анализ распределения зарегистрированных/перерегистрированных в 2000 г. лекарственных препаратов по фармакологическим группам, проведенный ГФЦ, свидетельствует о том, что 34,4% составляют лекарственные средства, влияющие на пищеварительную систему и метаболизм; 22,2% — средства, действующие на нервную систему; 18% — противомикробные и противопаразитарные препараты; 10,4% — средства, влияющие на сердечно-сосудистую систему. Среди зарегистрированных лекарственных средств преобладают препараты-генерики, причем доля монопрепаратов составляет 72,6%. Регистрируется большое количество препаратов, которые содержат одно и то же действующее вещество. Так, зарегистрировано (перерегистрировано) соответственно 6 и 14 препаратов, содержащих трамадол; 5 и 3 препарата на основе амоксициллина, 4 и 6 — на основе ацикловира; 4 и 5 монопрепаратов, содержащих ципрофлоксацин и т.д. Эти данные, по мнению А. Стефанова, свидетельствуют о дублировании лекарственных средств, регистрируемых (перерегистрируемых) в Украине. Таким образом, насыщенность рынка является в большей мере количественной, чем качественной, поскольку на украинском фармацевтическом рынке многие современные лекарственные препараты либо не представлены, либо представлены единичными препаратами.
Обязательным условием регистрации препарата является наличие инструкции по применению препарата на украинском языке. В 2000 г. на экспертизу и редактирование поступило 2100 инструкций, в 1999 г. — 337. В настоящее время только 23% зарегистрированных/перерегистрированных лекарственных препаратов (12,25% отечественных и 32% — зарубежных) снабжены украиноязычными инструкциями.
Компьютеризация и создание информационного отдела в составе ГФЦ дают возможность его руководству отследить движение регистрационных документов и их состояние в режиме реального времени. Заканчивается разработка системы информационной поддержки отслеживания оборота лекарственных средств на всех этапах «жизни» препарата. Кроме того, в Интернете открыт сайт Государственного фармакологического центра (), на котором размещены информация о работе ГФЦ, нормативные документы, другие необходимые сведения. Готовится к изданию регистр лекарственных средств Украины.
Одной из основных проблем сегодня, отметил А. Стефанов, является создание перечня жизненно необходимых лекарственных средств. Внесение лекарственного препарата в этот список открывает определенные перспективы перед предприятием — его производителем. Не меньшее значение имеет разграничение рецептурных и безрецептурных лекарственных препаратов. В настоящее время осуществляется разработка четких, прозрачных критериев, которые позволят относить лекарственные средства к той или иной группе.
Относительно новым направлением в деятельности ГФЦ, отметил А. Стефанов, является внедрение системы контроля за побочным действием лекарственных препаратов. ГФЦ подготовил «Инструкцию по осуществлению надзора за побочными реакциями/действиями лекарственных средств», которая была утверждена приказом МЗ Украины от 19.12.2000 г. № 347 и зарегистрирована Министерством юстиции. Как отметил в своем выступлении заведующий сектором координации и контроля клинических испытаний лекарственных средств, доктор медицинских наук В. Мальцев, ГФЦ должен стать центром, куда будет поступать информация о побочных действиях лекарственных препаратов как от практических врачей, так и от исследователей.
По мнению В. Мальцева, ситуация в сфере проведения клинических испытаний также изменилась к лучшему. Перечень клинических баз, на которых могут проводиться клинические испытания лекарственных средств, определяется приказом МЗ Украины от 24.12.1998 г. В ближайшее время в Перечень будут включены еще 56 клинических баз, в 2001 г. их число достигнет 220.
Как отметили многие выступающие, в Украине остаются нерешенными проблемы, связанные с регулированием оборота лекарственных средств. К их числу относятся, в частности, экспертиза и контроль рекламы. Не решена также проблема регистрации биологически активных добавок, гомеопатических препаратов, разграничения рецептурных и безрецептурных лекарственных средств, регулярного обновления перечня жизненно необходимых лекарственных средств и т.д. До сих пор не разработан механизм исключения неэффективных препаратов из регистра лекарственных средств Украины.
Тарас Махринский
Фото Евгения Кривши

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим