|
ПАТЕНТ
Главным способом, обеспечивающим эффективную защиту интеллектуальной собственности, по-прежнему во всех странах остается патент, который предполагает приоритет разработчика и защиту от копирования на территории действия патента. Патентной защите подлежат практически все аспекты, связанные с молекулярной структурой активных ингредиентов и вспомогательных компонентов, лекарственной формой, технологией выпуска, торговой маркой и т.д.
Как правило, срок действия патента в США и Европе составляет 20 лет и может быть увеличен до 25 лет в странах Евросоюза (кстати, в Украине максимальный срок действия патента также составляет 25 лет). Именно этот срок позволяет компании-разработчику получить максимальную прибыль от продаж препарата, поскольку в течение всего этого времени она является монополистом на рынке. Однако в большинстве случаев реальные сроки такой монополии не превышают 10–15 лет, поскольку пик активности по патентованию препаратов обычно приходится на конец I фазы клинических испытаний (см. «Еженедельник АПТЕКА» ).
С целью преодоления этой проблемы и увеличения сроков монопольного пребывания на рынке своих препаратов многие компании-оригинаторы используют самые разнообразные стратегии «озеленения» продукта. К ним можно отнести репозиционирование препарата, использование авторизированных генериков, смену статуса лекарственного средства с рецептурного на безрецептурный (over the counter — OTC) и др., которые подробно описаны на страницах нашего издания (см. «Еженедельник АПТЕКА» ).
ЭКСКЛЮЗИВНОСТЬ
Параллельно с патентованием во многих государствах с середины 80-х годов ХХ века принят и законодательно закреплен такой способ защиты интеллектуальной собственности, как эксклюзивность данных. Согласно классификации, принятой в международном соглашении по торговым аспектам прав на интеллектуальную собственность (Agreement on Trade-Related Aspects of Intellectual Property Rights — TRIPS), подписанном под эгидой ВТО, эксклюзивность данных можно отнести к одной из семи форм защиты интеллектуальной собственности, на которые распространяется это соглашение, — это так называемая информация, не подлежащая разглашению, включающая коммерческие тайны и данные испытаний. Указанная правовая норма обеспечивает конфиденциальность информации, предоставленной регистрирующим органам компанией-разработчиком на определенный период времени. Речь идет о любой информации, включая данные о химической структуре молекулы, а также результатах клинических испытаний, проведенных компаниями-разработчиками. Эти данные не обнародуются уполномоченными органами по отношению к третьим лицам, ссылка на них запрещена, поэтому их не могут использовать производители генерических препаратов. Эффективный период маркетинговой эксклюзивности, полученный компанией-оригинатором, как правило, является периодом эксклюзивности данных. Правовая норма эксклюзивности данных препятствует регуляторным органам оценивать профиль безопасности и эффективности генерического препарата от заявителя на период времени, начинающийся с получения разрешения на маркетинг продукта компании-оригинатора. Поскольку генерическое лекарственное средство содержит известные действующие вещества с проверенной эффективностью и безопасностью, при его разработке обычно нет необходимости в изучении препарата в моделях на животных и в трех фазах клинических исследований. Вместо этого регулирующие органы изучают документацию производителя, при необходимости проводят исследования и выдают разрешение на маркетинг, но только после того, как истечет период эксклюзивности данных.
Эксклюзивность данных никак не связана с правовыми нормами, направленными на защиту данных клинических и доклинических исследований. Даже спустя длительное время после того, как истекает период эксклюзивности данных, документация компании-оригинатора остается защищенной от копирования законами и рядом других юридических механизмов. Основная цель, которую преследует использование эксклюзивности данных, состоит в расширении рыночной монополии компании-оригинатора, не позволяя регистрирующим органам выдать разрешение на маркетинг генерического препарата.
Патентная защита и эксклюзивность данных независимы друг от друга и могут не совпадать во времени. Например, срок действия патента может истекать до получения разрешения на маркетинг препарата, после этого либо в иные сроки, в то время как период эксклюзивности данных привязан к дате получения разрешения на маркетинг.
ЭКСКЛЮЗИВНОСТЬ В США
Сроки, на которые предоставляется право эксклюзивности, в США регламентируются следующим образом:
— для препаратов, содержащих в качестве действующих веществ новый активный фармацевтический ингредиент (New Chemical Entity — NCE), который ранее не был одобрен Управлением по контролю за пищевыми продуктами и лекарственными средствами (Food and Drug Administration — FDA) в виде монокомпонента или комбинации с другим веществами, период эксклюзивности длится 5 лет;
— для препаратов для лечения редких заболеваний (Orphan Drug — ODE) срок эксклюзивности составляет 7 лет;
— кроме того, законодательством США предусмотрен 3-летний период эксклюзивности для препаратов, в состав которых входят одобренные ранее компоненты, когда заявка содержит сообщения о новых клинических исследованиях (кроме исследований биоэквивалентности), необходимых для ее одобрения. Эти данные могут относиться к доступности активных ингредиентов лекарственного средства, его дозировке, способам введения и условиям использования. Этот период не является препятствием для одобрения заявки (или приложения к ней), не нарушающей эксклюзивности относительно нового показания, включенного в нее (New Drug Application — NDA);
— еще одной особенностью законодательного регулирования защиты интеллектуальной собственности в фармацевтической отрасли США является так называемая педиатрическая эксклюзивность (Pediatric Exclusivity — PED), которая предоставляется компании-оригинатору на 6 месяцев в дополнение к уже существующим срокам патентной защиты/эксклюзивности. Условием предоставления педиатрической эксклюзивности является наличие показаний для применения препарата, зарегистрированного на основании соответствующих клинических исследований, у детей;
— наконец, в США, в отличие от стран Евросоюза, права эксклюзивности предоставляются компании, первой получившей разрешение на маркетинг генерического препарата, на 180 дней по окончании действия сроков патентной защиты и маркетинговой эксклюзивности оригинального препарата. Многие генерические компании активно борются за получение такого права, сулящего его обладателям немалые выгоды и используют для этих целей услуги различных консалтинговых организаций, регулярно «сканирующих» фармрынок США и некоторых других стран на предмет предстоящей потери эксклюзивности брэндовых лекарственных средств.
ЭКСКЛЮЗИВНОСТЬ В СТРАНАХ ЕВРОПЕЙСКОГО СОЮЗА
В настоящее время в государствах Евросоюза период эксклюзивности данных составляет 6 или 10 лет плюс время, которое требуется для регистрации генерического препарата, что обычно составляет 2–3 года.
Эксклюзивность данных была введена в 1987 г., для того чтобы обеспечить недостаточную патентную защиту продуктов в некоторых странах. Однако сейчас во всех 25 странах ЕС существует система патентной защиты, которая считается одной из самых эффективных в мире. Законодательство, регламентирующее производство и продажу фармацевтической продукции, претерпело значительные изменения в 2004 г. (Directive 2004/27/EC).
Согласно принятой ранее Директиве 2001/83/ЕС эксклюзивность данных в государствах — членах ЕС обеспечивает защиту прав интеллектуальной собственности для компаний-оригинаторов в зависимости от страны на период 6 либо 10 лет. Эксклюзивность данных на протяжении 6 лет применяется в Австрии, Дании, Финляндии, Греции, Ирландии, Португалии, Испании, Норвегии и Исландии и в 10 новых государствах — членах Евросоюза, что было закреплено при подписании их договоров о вступлении в ЕС. 10-летний период эксклюзивности данных действует в Бельгии, Германии, Франции, Италии, Люксембурге, Нидерландах, Швеции и Великобритании.
Новое фармацевтическое законодательство ЕС, принятое в 2004 (Directive 2004/27/EC) и согласованное в государствах — членах Евросоюза, регламентирует 8-летнее условие эксклюзивности данных с дополнительным 2-летним условием маркетинговой эксклюзивности. Эта эффективная 10-летняя маркетинговая эксклюзивность может быть увеличена максимум на один год, если в течение первых 8 или 10 лет владелец разрешения на маркетинг получит разрешение для одного или более терапевтических показаний, которые при предшествующей научной оценке этих разрешений привели к значимым клиническим преимуществам по сравнению с существующей терапией. Это так называемая формула 8 + 2 + 1, и к NCE она будет применена во всех процедурах и всех государствах — членах ЕС.
Практически это означает, что заявление на разрешение на маркетинг генерического лекарственного средства может быть подано в уполномоченные государственные органы лишь после 8 лет эксклюзивности данных брэндового препарата, но начало лонча генерика не может быть до истечения 10 или 11 лет (рисунок).
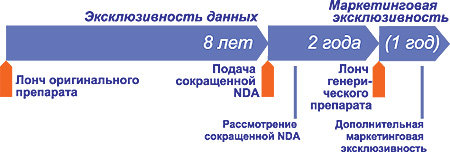
Рис. 1. Эксклюзивность данных (формула 8 + 2 + 1)
и возможность выведения на рынок генерических препаратов
Пересмотренное в 2004 г. европейское законодательство также предусматривает использование сроков эксклюзивности данных для лекарственных средств, изменяющих свой статус из рецептурных в категорию OTC-препаратов на основе новых доклинических и клинических данных. Законодательство также гарантирует период эксклюзивности данных в течение одного года в случае регистрации любых новых показаний для хорошо известных продуктов. Последнее условие не обладает свойствами кумулятивности (суммируемости), то есть новое показание может быть использовано для одного и того же продукта только однажды.
Существует оппозиция к увеличению срока эксклюзивности данных и принятому во многих государствах — членах ЕС 6-летнему сроку. Кроме того, ряд государств не согласовал новые европейские директивы со своим законодательством. Как и прогнозировали эксперты Европейской ассоциации производителей генерических лекарственных средств (European Generic mеdicines Association — EGA), новые сроки действия эксклюзивности данных в Европе вступили в действие лишь в ноябре 2005 г., в первую очередь, относительно брэндовых препаратов. Соответственно, исходя из схемы «8 + 2 + 1», лонч первых генериков в Европе, которые получат разрешение на маркетинг по новому законодательству, произойдет не раньше 2013 г. n
Алексей Макаренков

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим