Європейське агентство з лікарських засобів (The European Medicines Agency — EMA) спільно з Главами національних уповноважених регуляторних органів у сфері охорони здоров’я (Heads of Medicines Agencies — HMA) та Європейською комісією опублікували ключові принципи, в яких викладено узгоджений підхід до розробки і використання електронної інформації про лікарські засоби (ePI) у Європейському союзі (Electronic product information for human medicines in the EU: key principles. EMA/503860/2019. European Medicines Agency, 2020).
Не просто оцифровка інструкції
Електронне поширення інформації про лікарські засоби реалізують всілякі цифрові платформи, які дозволяють у режимі реального часу транслювати найсвіжіші та актуальні дані. Інформація про продукт (product information — PI) лікарського засобу включає листи-вкладиші (рackage leaflet — PL) для пацієнтів і зведені характеристики продукту (summary of product characteristics — SPC) для працівників охорони здоров’я.
Формат ePI передбачає моментальне оновлення, синхронне із затвердженням регуляторними органами змін до SmPC і PL. Загальна доступність ePI буде реалізована через різні технології та програми, включаючи сканування міток на упаковках ліків (наприклад штрих-кодів 2D). При цьому частина інформації, включеної в ePI, може бути специфічною для окремих партій (наприклад через заміну складу допоміжних речовин).
Таким чином, ePI — офіційно затверджена інформація про лікарські засоби (тобто, SmPC, PL та маркування), що відповідає єдиному електронному стандарту ЕС.4 87 ePI, адаптованому для електронної обробки, що дозволяє поширення через всесвітню павутину, електронні платформи і друк.
Принципи впровадження ePI:
|
Схвалення регулятора
Ключові принципи, розроблені на підтримку цифрової трансформації охорони здоров’я, покликані забезпечити мінливі інформаційні потреби пацієнтів і медичних працівників і усунути деякі з поточних обмежень (наприклад інформація про продукт не сумісна з іншими системами електронної охорони здоров’я, такими як електронні рецепти та електронні медичні записи).
Впровадження цифрових ініціатив на рівні ЄС потребує гнучкого узгодженого підходу, що реалізується в багатомовному середовищі за участю регуляторних органів (рисунок).
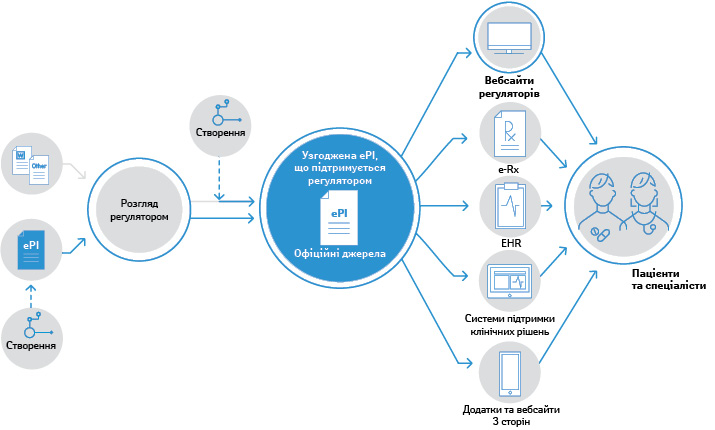
При цьому за допомогою ePI надають тільки офіційно затверджену PI. Імплементація ePI регулятором може бути реалізована 2 шляхами: або в процесі розгляду і затвердження реєстраційних матеріалів, або шляхом конвертації PI у ePI вже після видачі дозволу на маркетинг. Так, зміст ePI має бути ідентичним останній версії PI, затвердженій регулятором. Включати в ePI додаткову інформацію, в тому числі з метою реклами або промоції, заборонено. ePI завжди слід публікувати як відкриті дані, доступні для вільного використання.
Сценарії використання ePI
У процесі опрацювання концепції було розглянуто різні способи практичного застосування ePI усіма учасниками системи охорони здоров’я та запропоновано деякі перспективні напрями впровадження (таблиця).
| Учасники | Ситуації, в яких корисна ePI і спосіб її використання |
| Пацієнт
|
Нагадування про те, як приймати ліки:
Нові попередження про безпеку:
Доступ до багаторівневої інформації:
Допомога в зарубіжних поїздках:
|
Пацієнт і/або фахівець охорони здоров’я |
Легкий пошук інформації про препарати:
|
Фахівці охорони здоров’я |
Інформування про зміни в ePI:
|
МАН та регулятор |
Зміна адреси МАН:
Нове попередження про безпеку оригінального лікарського засобу:
Дефіцит ліків:
|
Можливість машинного читання + схвалення регулятора
Необхідність впровадження ePI, як випливає з проведеного ЕМА огляду (Electronic product information for medicines in the EU; EMA/901549/2018. European Medicines Agency, 2019), визнають у цілому світі. Так:
- Японія і Канада надають PI у вигляді PDF‑файлів, починають перехід до електронного формату;
- Швейцарія надає PI у форматі HTML на сайті Swissmedic трьома мовами (німецькою, французькою та італійською);
- США імплементували ePI ще в 2005 р. і на сайті DailyMed розміщують структуровані інструкції для застосування продуктів (Structured Product Labeling — SPL);
- Іспанський регулятор — єдиний, який запровадив стандартизовану ePI ліків, схвалених за національною процедурою; ePI використовують протягом усього процесу регуляторного схвалення (cima.aemps.es);
- у Франції PI дозволених ліків представлений у форматі HTML на сайті ansm.sante.fr, але не на основі структурованого шаблону ePI;
- проєкти з підготовки ePI вже реалізують у Бельгії, Німеччині, Нідерландах, Норвегії та Швеції;
- впровадженню ePI, часто у співпраці з регуляторними органами, допомагають сторонні компанії, які добре зарекомендували себе, або фармацевтичні асоціації в таких країнах, як Данія (Indlægssedler), Фінляндія (Lääkeinfo), Німеччина (Rote Liste), Ірландія (Ірландська фармацевтична асоціація охорони здоров’я — Irish Pharmaceutical Healthcare Association), Норвегія (Felleskatalogen), Швеція (Fass) і Великобританія (eMC).
Таким чином, проникнення ePI в усі сфери «фармацевтичної життєдіяльності» — це винятково питання часу.


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим