Перше, що доводиться визнавати, звертаючись до цієї теми, — знаходження тих самих або дуже схожих один на одного продуктів на різних ринках із різним статусом. Наприклад, в Італії мелатонін може входити як до складу ліків, так і ДД, тоді як в Ірландії — тільки лікарських засобів (EHPM, 2022). Більше того, навіть в одній національній юрисдикції аналогічні продукти можуть бути представлені як ліки та ДД одночасно.
Дві визначальні ознаки
Стосовно мелатоніну багато країн встановили певні межі споживання, дозволені завдяки ДД, — 0,3; 0,5; 1 або 2 мг/добу (Nilsson T., 2022). Але тією самою мірою, як склад, для категоризації продукту важлива його функція. Ці дві ознаки прийнято вважати основоположними та визначальними, що можна ілюструвати цьогорічним рішенням Європейського суду правосуддя (European Court of Justice — ECJ). Відповідний випадок стався у Німеччині, і позивач оскаржував рішення Федерального інституту ліків і медичних приладів (Bundesinstitut für Arzneimittel und Medizinprodukte — BfArM). Так, вищий федеральний орган пропонував вважати сироватку для вій, що чинить фармакологічну дію (за твердженням виробника, величина ефекту щодо довжини та густоти вій може становити до 50%), лікарським засобом. При цьому на ринку країни у такій якості перебувають очні краплі для лікування глаукоми із діючою речовиною, що значною мірою ідентична запропонованій у складі сироватки для вій. Більше того, той самий активний фармацевтичний інгредієнт в аналогічній концентрації (0,03%) є компонентом лікарського засобу для лікування гіпотрихозу вій у США. Відповідно до BfArM подовження та потовщення вій є значним впливом на фізіологічні функції. Класифікація відповідного продукту як лікарського засобу також випливає з того факту, що при його використанні неможливо виключити існування ризику для здоров’я.
Відповідаючи на запитання позивача, ECJ пояснив, що здатність змінювати фізіологічні функції та впливати на здоров’я людини не можна ототожнювати. Той факт, що продукт, ймовірно, покращить зовнішній вигляд, що може призвести до підвищення самооцінки чи добробуту, сам по собі не гарантує користі для здоров’я. Вирішальним фактором для класифікації продукту у такому випадку є наявність чи відсутність терапевтичних показань.
Продукт один — статус різний
Через подібні нетрі неоднозначних фактів доводиться продиратися при супроводі «виходу в світ» відносно нових розробок, наприклад таких, що містять канабідіол з медичних конопель. Проте навіть щодо категоризації таких тривіальних продуктів, як ті, що містять валеріану, звіробій, гінкго, женьшень або зелений чай, на теренах ЄС немає одностайності. Вони можуть знаходитися на ринках як рослинні лікарські засоби (табл. 1), ДД, КЗ або МВ (Bilia A.R., 2020).
| Регуляторний шлях | Основні вимоги | Відповідальний орган |
| Традиційне (Traditional) використання (стаття 16a(1) Директиви 2001/83/EC) |
|
Національний компетентний орган держави-члена щодо наступних процедур: національної, взаємного визнання або децентралізованої |
| Добре встановлене (Well-established) використання (стаття 10а Директиви 2001/83/ЕС) |
|
Європейське агентство з лікарських засобів (EMA), якщо застосовується централізована процедура, або національний компетентний орган держави-члена щодо інших |
| Повна чи змішана заявка (mixed application) (стаття 8(3) Директиви 2001/83/ЕС) |
|
EMA, якщо застосовується централізована процедура, або національний компетентний орган держави-члена щодо інших |
Чи впливає продукт на здоров’я такою мірою, щоб забезпечувати лікування та профілактику захворювань? Визначених кількісних меж впливу ДД на фізіологічні функції не встановлено. Проте визнано, що продукти харчування можуть певною мірою впливати на здоров’я, не маючи при цьому показань до медичного застосування. Зокрема, Регламентом Комісії (ЄС) № 432/2012 від 16 травня 2012 р. встановлено перелік дозволених тверджень щодо здоров’я у зв’язку із вживанням харчових продуктів, крім тих, що стосуються дітей. Таких, що стосуються рослинних чи інших компонентів ДД, серед них дуже мало, оскільки багато із запропонованих доказів тверджень про здоров’я визнано недостатніми, а клінічні дані, отримані у хворих, розцінено як недостатньо релевантні для здорових людей (Bilia A.R., 2020). Тож характер впливу на здоров’я, від якого залежить статус продукту на ринку, потребує ретельної оцінки у кожному конкретному випадку.
А як щодо компонентів, дозволених у складі ДД? У додатках І та ІІ Директиви «Про дієтичні добавки» (2002/46/EC), доповнених згідно з Регламентом (EC) 1925/2006, містяться переліки лише вітамінів та мінералів. В якості додатку ІІІ до цього Регламенту виступають переліки речовин, вживання яких у їжу заборонено, обмежено чи розглядається. Окремими регламентами до нього включено, наприклад, продукти з використанням рослин родів Ephedra, Yohimbe (заборонені), ботанічних видів, що містять похідні гідроксиантрацену (заборонені та розглядаються), монаколінів з червоного дріжджового рису (обмежено) — разом із пропозиціями країн-членів вони складають Реєстр ЄС щодо додавання вітамінів, мінералів і деяких інших речовин до харчових продуктів (Community Register on the addition of vitamins and minerals and of certain other substances to foods) (food.ec.europa.eu). За межами зазначених спільних правил країни-члени спираються на власні правові механізми.
Свої переліки інгредієнтів із заборонами та обмеженнями на рівні ЄС застосовують також до КЗ відповідно до Регламенту «Про косметичні продукти» (1223/2009). Європейська комісія видає керівні документи задля допомоги у диференціюванні граничних продуктів (Borderline products) — лікарських засобів/КЗ/МВ.
Нову сторінку у створенні «гібридних» продуктів відкрито із набуттям сили новим законодавством про МВ (Регламент (ЄС) 2017/745), зокрема, описані вимоги до МВ на основі фармацевтичних субстанцій (substance-based medical device) та комбінацій МВ із субстанціями. У настанові (MDCG 2022 — 5) щодо граничних продуктів згідно з Регламентом, підготовленій відповідною консультативною групою, у визначенні МВ на основі субстанцій зазначено: складається з речовин, які дозволені в медичних виробах, і не досягає своєї основної передбачуваної дії фармакологічними, метаболічними чи імунологічними механізмами.
В якості прикладів недозволених інгредієнтів названо живі мікроорганізми, тканини та клітини. При цьому визначальною для категоризації є саме основна дія продукту, яка зазвичай досягається за допомогою нефармакологічних ефектів — фізичних (механічного, бар’єрного, змащувального, осмотичного тощо) або хімічних (зміни кислотно-лужного стану, хелатування). Такі пристрої можуть бути схожі за складом на лікарський засіб і використовуватися подібним чином (прийматися внутрішньо чи наноситися на шкіру) (табл. 2).
| Два основних різновиди | |
| 1. Для застосування in vitro в прямому контакті з людськими клітинами, тканинами, органами або людськими ембріонами | 2. Призначені для внутрішнього чи зовнішнього застосування людиною |
|
|
Розробляють МВ із натуральними інгредієнтами (рослинні екстракти, компоненти мікробіоти) для комплексного лікування пацієнтів із гастроезофагеальним рефлюксом, закрепами на основі системної біології (Bilia A.R., 2021; Leone M.G., 2022).
Спільний підхід німецькомовних країн
Чи є той чи інший інгредієнт харчовим продуктом (новим) чи лікарським засобом (традиційним)? Допомогу у вирішенні цього питання надають різні європейські експертні групи за участю органів влади. Так, у Німеччині представники федеральних та земельних органів управління під егідою Федерального відомства із захисту прав споживачів і харчової безпеки (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit — BVL) вже понад 8 років розробляють підхід до уніфікованої оцінки речовин. Цю концепцію відображено в новій назві 2-го видання (2020 р.): «Списки речовин (узагальнювальне поняття, німецькою — Stoff) від федеральних і земельних урядів за участю експертів з Німеччини, Австрії та Швейцарії»* (назви країн зашифровано абревіатурою «D-A-CH»). Воно містить вичерпну інформацію про окремі інгредієнти (поки — рослини та гриби, у найближчому майбутньому — також водорості) з огляду на їх класифікацію як продуктів харчування, лікарських засобів та нових харчових продуктів. Для забезпечення єдиної основи визначення терапевтично ефективної дози враховують збірки монографій Комітету з лікарських засобів рослинного походження (Committee on Herbal Medicinal Products — HMPC), Європейської наукової спілки фітотерапії (European Scientific Cooperative on Phytotherapy — ESCOP) та Всесвітньої організації охорони здоров’я.
D-A-CH-переліки інгредієнтів
Основою для класифікації харчових продуктів (ХП), ліків або нових ХП/нових харчових інгредієнтів, а також комбінацій є відповідний алгоритм (рисунок). За його допомогою інгредієнти відносять до груп A (використання пов’язане з ризиком), B (використовуються як ХП у обмеженій кількості у зв’язку з ризиком) та C (існує наукова невизначеність).
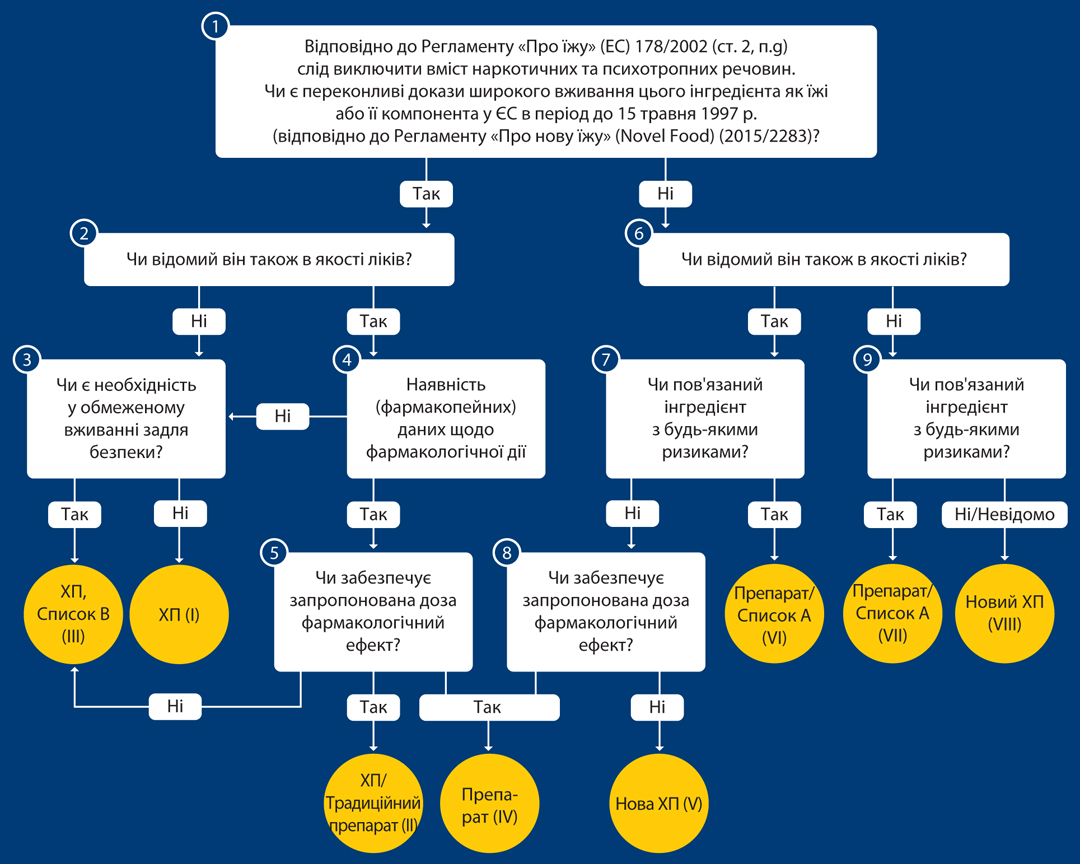
Результатом запитів відповідно до цього дерева рішень є наступна класифікація:
І. ХП (через запитання 3) — звичайні продукти, які не використовуються в медицині.
ІІІ. ХП + Список В (через запитання 3) — те саме, але з обмеженнями щодо застосування.
ІІ. ХП/рослинний препарат традиційного застосування (через запитання 5).
IV. Ліки + список В (через запитання 5) — звичайні продукти харчування, які також використовуються як ліки. Якщо істотних фармакологічних ефектів не виявлено, інгредієнт можна вважати ХП. Коли запропоновано фармакологічно ефективну дозу, — це ліки, список В.
VIII. Нові ХП (через запитання 9) — немає відомостей про використання в якості ХП чи ліків. Немає відомих ризиків, які б перешкоджали використанню інгредієнта як їжі. Подальша експертиза проводиться відповідно до положень Регламенту «Про нові харчові продукти».
IV/V. Нові ХП/ліки (через запитання 8) — речовина наразі відома лише як ліки. Однак не описано жодних ризиків, які б виключали використання її як ХП. Тому застосування можливе після експертизи відповідно до Регламенту «Про нові харчові продукти». Диференціація між ліками та новими ХП базується на фармакологічно ефективній дозі (за аналогією з IV).
VI. Лікарський засіб + Список А (через запитання 7).
VII Інгредієнт, що не є лікарським засобом, пов’язаний із ризиком при використанні (через запитання 9).
Продовження — у наступному номері «Щотижневика АПТЕКА».

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим