Що «приховує» у собі метафармінг та чому виникла потреба у ньому?
 Останні десятиліття ознаменувалися проривом у генній інженерії, що дало можливість отримати контроль над генетичними змінами. Науковці навчилися переносити гени між абсолютно неспорідненими видами, оптимізуючи сільськогосподарські характеристики або, що особливо важливо, забезпечуючи виробництво цінних фармацевтичних продуктів (Phillips T. et al., 2008).
Останні десятиліття ознаменувалися проривом у генній інженерії, що дало можливість отримати контроль над генетичними змінами. Науковці навчилися переносити гени між абсолютно неспорідненими видами, оптимізуючи сільськогосподарські характеристики або, що особливо важливо, забезпечуючи виробництво цінних фармацевтичних продуктів (Phillips T. et al., 2008).
Метафармінг — термін, який у межах сучасної медицини та фармацевтики може тлумачитися у двох значеннях: у широкому сенсі він стосується комплексної стратегії управління здоров’ям через цілеспрямований вплив на метаболізм пацієнта та його мікрофлору (Wilson et al., 2017), а у вужчому — як метаболічний фармінг (метаболічна інженерія) — використання методів синтетичної біології для перепрограмування метаболічних шляхів організмів. Через зміни генетичного коду мікроорганізмів або клітин їх стимулюють виробляти цінні сполуки, які важко синтезувати хімічно (наприклад складні вітаміни, біопаливо або прекурсори ліків) (Wilson I.D. et al., 2017; Sivamani Y. et al., 2025). У контексті метафармінгу варто говорити про молекулярний фармінг (фармацевтичне фермерство) — галузь біотехнології, що сягає своїм корінням у 1980-ті роки, коли дослідники вперше синтезували рекомбінантні людські білки, та ґрунтується на методах, аналогічних виробництву генетично модифікованих культур, — генетичній інженерії рослин, коли для синтезу низки потрібних білків (антитіл, вакцин, гормонів, ферментів тощо) використовують стабільне перенесення генів у ядро чи пластиди, транзієнтну трансформацію сільськогосподарських культур або метод клітинної суспензії (Das S. et al., 2021) (рисунок).
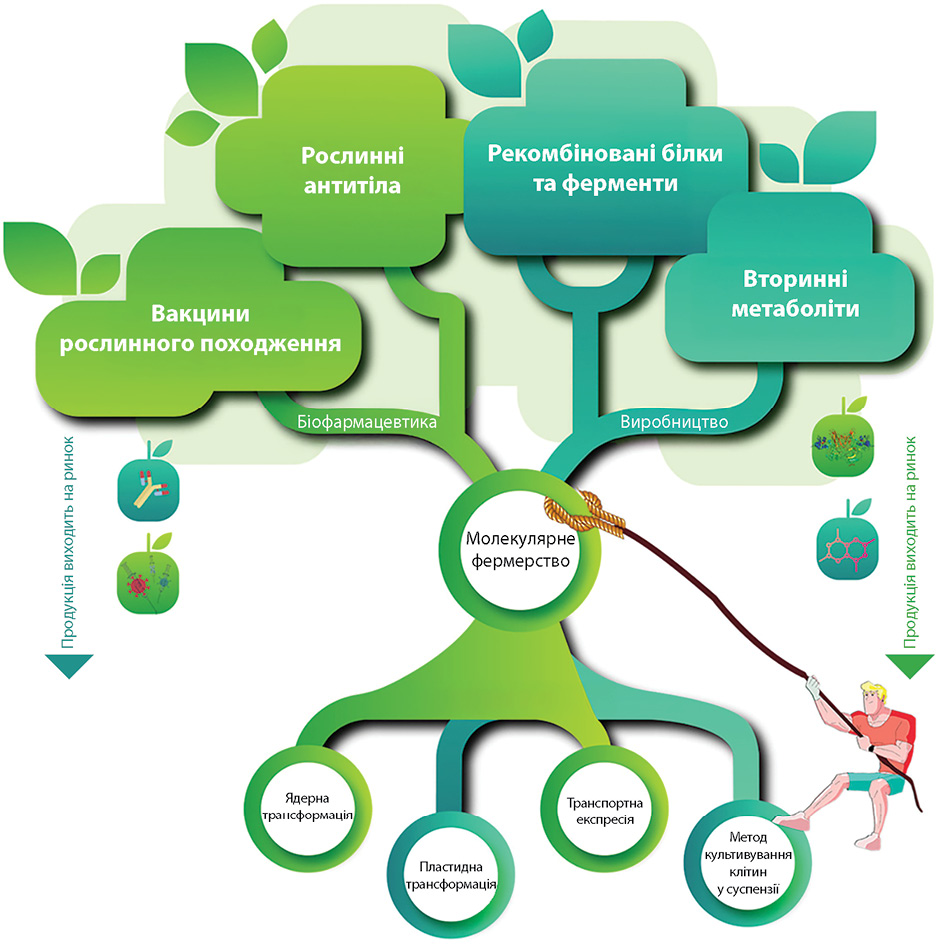
Фактично поле, теплиця чи вертикальна ферма сьогодні перетворюються на фармацевтичний завод нового покоління. І це не просто лабораторна фантазія, а реальність, яка вже оточує людину, працює і має потенціал для розв’язання низки глобальних проблем охорони здоров’я.
Потенціал сучасних біофабрик
Поступово людство переходить від полів із зерном до полів із антитілами, від теплиць з овочами — до теплиць із білками плазми крові, від фермерства — до фармацевтичного фермерства: наразі розробляється понад 500 фармацевтичних продуктів на основі широкого спектра рослинних видів, які, як виявилося, є не лише джерелом їжі та кисню, а й однією з найкращих платформ для синтезу рекомбінантних білків, які можуть використовуватися у виробництві різних типів біологічних препаратів: антитіл, вакцин, ферментів, терапевтичних білків, гормонів та цитокінів (Das S. et al., 2021; Hager K.J. et al., 2022; Zahmanova G. et al., 2023). Зокрема, людський гормон росту, отриманий із трансгенного тютюну, став першим білком рослинного походження, підготовленим для медичного застосування (Das S. et al., 2021; Klocko A.L., 2022). Серед відомих прикладів молекулярного фармінгу варто виділити білок авідин, отриманий із насіння трансгенної кукурудзи; вакцину для птиці проти хвороби Ньюкасла, фермент із суспензії клітин моркви для лікування хвороби Гоше, «золотий рис» із високим вмістом бетакаротину (до 35 мкг/г) для боротьби з дефіцитом вітаміну А, кукурудзу з термостійкою амілазою в ендоспермі тощо (Tang G. et al., 2009; Das S. et al., 2021; Klocko A.L., 2022). Рослини наразі також стали платформою для виробництва низки моноклональних антитіл (Ко К. et al., 2005), як-от експериментальний коктейль антитіл, вироблений у тютюні, для лікування хвороби Ебола (Budzianowski J., 2015; Swope K. et al., 2022). У процесі розробки й культивування людського проінсуліну — його масове виробництво в коренях та пагонах суниці (Bharathi J.K. et al., 2024).
Таким чином, оскільки багато регіонів світу історично покладаються на фітотерапію, впровадження сучасних рослинних препаратів гармонійно доповнює традиційні методи, підвищуючи довіру пацієнтів до лікування. Серед примітних особливостей молекулярного фармінгу — можливість розгортання виробництва на місцях із мінімальною інфраструктурою, що критично важливо для віддалених районів та космічних місій, і що особливо важливо, — сприятливий профіль безпеки та знижена імуногенність, що може зумовити кращу толерантність до терапії та мінімізацію побічних ефектів. На відміну від бактерій, рослини здатні синтезувати складні білки з правильним згортанням та глікозилюванням, подібним до людського. А відсутність спільних із людиною патогенів мінімізує ризики біологічного забруднення, що робить рослинні платформи майже ідеальними для швидкого реагування на пандемії. Хоча вони поступаються мікробним системам у швидкості росту, а клітинам ссавців — у точності певних модифікацій, рослини є значно дешевшими та безпечнішими (Zahmanova G. et al., 2023; Vo D.K. et al., 2025).
Їстівні вакцини в контексті метафармінгу
У вищенаведеному контексті неможливо не згадати й про імунізацію. Незважаючи на ефективність традиційних вакцин (інактивованих та живих атенуйованих), вони мають суттєві обмеження, особливо в умовах появи нових інфекційних загроз. Ключовими проблемами залишаються вартість, тривалий цикл виробництва, залежність від «холодового ланцюга» та нерівномірний розподіл ресурсів у світі. На цьому тлі молекулярний фармінг на основі рослинних платформ виглядає найбільш перспективним методом подолання глобальних прогалин в імунізації (Vo D.K. et al., 2025). Рослини слугують біотехнологічною платформою для синтезу імуногенних антигенів та вірусоподібних частинок (virus-like particles — VLP). Завдяки відсутності генетичного матеріалу VLP є потенційно безпечними компонентами вакцин і наноносіїв, що діють як потужні імуномодулятори та самоад’юванти. Вони здатні індукувати виражену імунну відповідь проти вірусних, онкологічних, алергічних та аутоімунних захворювань. Важливою віхою в цій галузі стала розробка препарату першої рослинної вакцини проти COVID-19, що підтвердила можливість надшвидкого масштабування виробництва під час пандемії. Порівняно з традиційними аналогами, рослинні вакцини мають низку переваг: низька собівартість, підвищена стабільність білків, спрощена логістика та можливість перорального введення (їстівні («зелені») вакцини), даючи змогу нівелювати глобальну нерівність в охороні здоров’я, забезпечуючи доступною імунізацією країни з обмеженими ресурсами. Для створення таких субодиничних вакцин використовують широкий спектр культур, серед яких картопля, помідори, банани, салат, кукурудза, соя, рис, бобові, цвітна капуста, шпинат, батат, арахіс, салат, кавун, морква та інші. Їстівні вакцини відкривають можливості для значного зниження захворюваності на різні хвороби та їх профілактики, серед яких кір, гепатит В, холера, діарея, ВІЛ, хвороба Альцгеймера, сказ, грип, низка аутоімунних захворювань, алергія, рак, контроль народжуваності тощо (Saxena J. et al., 2013; Zahmanova G. et al., 2023; Vo D.K. et al., 2025).
Виклики в епоху метафармінгу
Молекулярне фермерство сьогодні є яскравим свідченням наукового прогресу, що ставить людство на поріг фундаментальних трансформацій. Синергія передових технологій та дослідницького досвіду веде до майбутнього, у якому рослинні біопрепарати можуть стати незамінним інструментом глобальної медицини.
Примітно, що молекулярний фармінг докорінно змінює не лише промисловість, а й саму суть фармацевтичної професії, вимагає від сучасного фармацевта глибокого розуміння принципів фармацевтичного фермерства, адже ці знання можуть стати фундаментом для професійної стійкості на мінливому ринку, даючи змогу не лише розуміти походження складних рекомбінантних білків — від інсуліну до моноклональних антитіл, — а й професійно оцінювати їхню якість, стабільність та імуногенність залежно від обраної системи-біореактора. Особливого значення набуває управління ризиками при використанні інноваційних пероральних вакцин, де саме фармацевт має стати відповідальним за консультування пацієнтів щодо правил зберігання, специфіки дозування та взаємодії препаратів із їжею.
Попри значний терапевтичний потенціал, напрям молекулярного фармінгу стикається з низкою суттєвих перешкод, які метафорично можна назвати «ложкою дьогтю» в успішному розвитку галузі. До них належать скептичне ставлення громадськості до генно модифікованих організмів (ГМО), складні питання інтелектуальної власності, низький вихід цільового білка та жорсткі регуляторні стандарти, що обмежують комерціалізацію. Проте сподіватимемося, що завдяки постійним інноваціям у біотехнології та консолідації зусиль наукових установ і фармацевтичної індустрії ці бар’єри поступово подолають, перетворивши рослинні платформи на стійку базу для боротьби з інфекційними та хронічними захворюваннями (Dubock A., 2014; Zahmanova G. et al., 2023; Vo D.K. et al., 2025).

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим