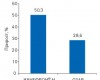
Британское правительство отказалось финансировать фармсектор
...отложив решение вопроса о дополнительном финансировании в размере 750 млн фунтов стерлингов (1,1 млрд дол. США).
КАНЕФРОН® Н — современное решение!
Зимний сезон закончился. Однако период заболеваемости — нет, ведь весной обостряются заболевания почек и мочеполовой системы. КАНЕФРОН® Н — современный инновационный фитопрепарат производства компании «Бионорика АГ» для лечения и профилактики инфекций мочевыделительных путей по фармакологическим свойствам и высокой эффективности выделяется среди других средств этой группы.
Припис від 15.05.2009 р. № 4735/08-11
ТИМЧАСОВО ЗАБОРОНЯЮ реалізацію (торгівлю) та застосування лікарського засобу АНГІ СЕПТ ДР.ТАЙСС, таблетки для смоктання зі смаком вишні, № 12, серії 010608, виробництва «Др.Тайсс Натурварен ГмбХ», Німеччина
Проект наказу МОЗ України «Про затвердження змін до наказу МОЗ України від 26.08.2005 р. № 426 «Про затвердження Порядку проведення експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію (перереєстрацію), а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення»
Метою проекту наказу МОЗ є запровадження механізму визначення належності препарату до певних категорій ЛЗ, визначення процедури його реєстрації та прийняття рішення щодо державної реєстрації ЛЗ безпосередньо МОЗ України.
«Daiichi Sankyo» в 2008 г. потерпела рекордные потери
Компания связывает это с тем, что стоимость акций индийской генерической компании «Ranbaxy», в которую «Daiichi Sankyo» инвестировала 4,6 млрд дол., приобретя 64% ее акций, снизилась более чем на две трети.
Донецкий суд возбудил дело о банкротстве крупного аптечного предприятия
Дело о банкротстве возбуждено в отношении «Областной аптечной управляющей компании», которая является материнской компанией Донецкого «Аптечного холдинга»
Припис від 15.05.2009 р. № 4756/08-11
ТИМЧАСОВО ЗАБОРОНЯЮ реалізацію (торгівлю) та застосування лікарського засобу СТРУКТУМ®, капсули по 500 мг, № 60, серії GO1048, виробництва П’єр Фабр Медикамент Продакшн, Франція
Наказ Міністерства охорони здоров’я України від 17 березня 2009 р. № 166
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ НАКАЗ від 17 березня 2009 р. № 166 Про державну реєстрацію (перереєстрацію) лікарських засобів та внесення змін у реєстраційні матеріали Відповідно до статті 9 Закону України «Про лікарські засоби», пункту 5 Порядку державної реєстрації (перереєстрації) лікарських засобів, затвердженого постановою Кабінету Міністрів України від 26.05.2005 р. № 376 на підставі результатів експертизи реєстраційних матеріалів лікарських засобів та контролю якості тих, що подані на державну реєстрацію, проведеної […]
Проект постанови КМУ «Про внесення змін до Порядку державної реєстрації (перереєстрації) лікарських засобів»
Проект постанови КМУ розроблено з метою вдосконалення системи реєстрації ЛЗ. Проектом пропонується внести зміни до відповідного Порядку, якими визначити МОЗ України органом державної реєстрації ЛЗ.
Наказ Міністерства охорони здоров’я України від 26 березня 2009 р. № 188
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ НАКАЗ від 26 березня 2009 р. № 188 Про державну реєстрацію (перереєстрацію) лікарських засобів та внесення змін у реєстраційні матеріали Відповідно до статті 9 Закону України «Про лікарські засоби», пункту 5 Порядку державної реєстрації (перереєстрації) лікарських засобів, затвердженого постановою Кабінету Міністрів України від 26.05.2005 р. № 376 на підставі результатів експертизи реєстраційних матеріалів лікарських засобів та контролю якості тих, що подані на державну […]