 На протяжении вот уже более 30 лет НФаУ возглавляет Валентин Петрович Черных — известный ученый, выдающийся химик-органик, труды которого признаны отечественным и мировым научным сообществом. В.П. Черных — доктор фармацевтических наук (1977 г.), доктор химических наук (1990 г.), профессор (1979 г.), член-корреспондент Национальной академии наук (НАН) Украины (1997 г.). Он является автором более 1170 научных трудов, среди которых результаты исследований в области органической, фармацевтической, медицинской химии, 19 монографий, 126 патентов, 340 авторских свидетельств, 7 учебников, в том числе учебника «Органическая химия» в 3 томах, в 2000 г. удостоенного Государственной премии Украины в области науки и техники (на украинском, русском и английском языках), 44 учебно-методических изданий. На разных этапах внедрения находятся разработанные под его руководством 8 инновационных лекарственных субстанций и 6 готовых лекарственных средств (Сукцифенат, Диакамф, Анальбен, Глисульфазид, Оксаглюкамин, Хиноксикаин).
На протяжении вот уже более 30 лет НФаУ возглавляет Валентин Петрович Черных — известный ученый, выдающийся химик-органик, труды которого признаны отечественным и мировым научным сообществом. В.П. Черных — доктор фармацевтических наук (1977 г.), доктор химических наук (1990 г.), профессор (1979 г.), член-корреспондент Национальной академии наук (НАН) Украины (1997 г.). Он является автором более 1170 научных трудов, среди которых результаты исследований в области органической, фармацевтической, медицинской химии, 19 монографий, 126 патентов, 340 авторских свидетельств, 7 учебников, в том числе учебника «Органическая химия» в 3 томах, в 2000 г. удостоенного Государственной премии Украины в области науки и техники (на украинском, русском и английском языках), 44 учебно-методических изданий. На разных этапах внедрения находятся разработанные под его руководством 8 инновационных лекарственных субстанций и 6 готовых лекарственных средств (Сукцифенат, Диакамф, Анальбен, Глисульфазид, Оксаглюкамин, Хиноксикаин).
За это время под руководством ректора НФаУ сформировалась мощная научная школа, усилиями которой успешно решены многие теоретические и прикладные задачи в сфере органического синтеза, физико-органической химии, фармации. Научный потенциал вуза — более 100 докторов наук и около 500 кандидатов наук, из которых 14 докторов и 42 кандидата наук подготовлены под руководством Валентина Петровича. Это позволило фармации из прикладной отрасли медицины выйти на современный научный уровень. В.П. Черных сегодня является единственным представителем прикладной фармации в Отделении химии НАН Украины. Но более значим тот факт, что в его лице практическая фармацевтическая отрасль приобрела своего делегата в высшем эшелоне отечественной фундаментальной академической науки — НАН Украины.
В начале 2012 г. В.П. Черных был номинирован на звание академика НАН Украины. Свидетельством международного признания высокого научного авторитета ректора НФаУ и его школы является значительное количество писем поддержки от ведущих специалистов в области органического синтеза из различных стран мира, в числе которых 17 академиков НАН Украины, РАН, НАН Беларуси, НАН Литвы, профессора ведущих университетов Австрии, Болгарии, Германии, Ливана, Польши, США, коллективы ученых советов НИИ НАН Украины и РАН, университетов Украины, России, Венгрии.
Представленный ректором НФаУ В.П. Черных доклад на тему «Конструирование, синтез и модификация новых гетероциклических систем с целью поиска высокоэффективных лекарственных субстанций» всецело посвящен органической химии и лекарствам — от проблем создания новых активных молекул до проблем лекарственной безопасности и лекарственной независимости Украины.
Приводить доклад в том виде, в котором он был представлен на заседании НАН Украины, и, безусловно, мог бы украсить страницы любого химического издания, мы не считаем целесообразным, но с удовольствием ознакомим читателей с теми выдержками из выступления, которые показались нашему корреспонденту наиболее информативными аудитории работников практической фармации.
Фундаментальные химические исследования: в фокусе гетероциклы
В.П. Черных (фрагменты доклада в НАН Украины):
— Особенностью органического синтеза в НФаУ является его практическая направленность, что обусловливает жесткие требования к новизне, активности и безвредности молекул (рис. 1 — прим. ред.). За последние 20 лет уровень синтетических исследований в университете достиг мирового. Доказательством тому являются публикации в ведущих химических журналах, защиты диссертационных работ на соискание ученой степени кандидата и доктора химических наук в специализированных советах ведущих университетов, коллекция новых синтезированных веществ (более 15 тыс. образцов). В активе химиков несколько десятков новых гетероциклических систем и около 40 комбинаторных библиотек веществ, фокусированных под разнообразные фармакологические задания.
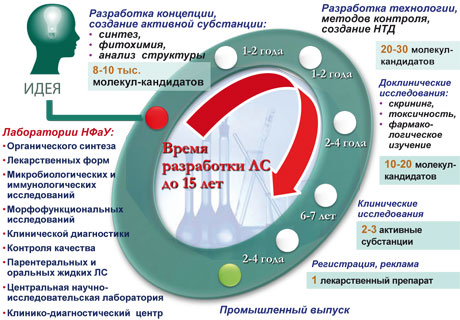
Лечение препаратами синтетического происхождения (ятрохимия) уходит корнями в начало XIX в. Как видите, история не такая уж и древняя. На начало века таких лекарств было около сотни, и практически все они были получены выделением из лекарственных растений. Первый органический синтез (Веллер, 1824–1828 гг., синтез щавелевой кислоты и синтез мочевины из изотиоцианата аммония) ознаменовал собой новую эру в истории человечества. Мир стал синтетическим: мы едим синтетическую пищу, одеваемся в синтетическую одежду, окружаем себя синтетическими вещами и лечимся синтетическими лекарствами.
Как показывает мировая практика, синтез молекул для создания новых лекарств реализуется в трех основных направлениях. Все они успешно развиваются и на кафедрах химического профиля НФаУ.
1. Синтез новых гетероциклических систем
Из всего многообразия лекарств, применяемых в медицинской практике (в Украине зарегистрировано около 15 тыс. лекарственных средств), более 90% содержат в своей структуре гетероциклическое ядро — циклическую систему из атомов углерода, азота, кислорода и других элементов.
Синтез новых гетероциклов — задача интеллектуально и технологически сложная. Неизвестные науке молекулы содержат колоссальный фармакологический потенциал. На сегодня это самый эффективный путь к лекарственным средствам нового поколения.
Основополагающим этапом на стадии планирования синтетического эксперимента является выбор базовой структуры — фрагмента молекулы, с которым мы связываем проявление тех или иных свойств, и на основании которого мы планируем проводить химическую модификацию (создание комбинаторных библиотек веществ).
Наряду с фармакофорным анализом (анализ вклада различных химических групп в степень проявления биологического действия), для теоретического обоснования выбора базовой структуры мы использовали как накопленный эмпирический опыт, так и логико-структурный анализ, математическое моделирование фармакологических свойств молекулы, скриниг in silico (компьютерный расчет взаимодействия рецепторов-мишеней с лекарственными веществами). Нельзя не учитывать и элементы случайности в открытии новых реакций и новых веществ. Здесь важно понимать, что за каждым словом из этого перечня кроется продолжительный кропотливый труд больших научных коллективов.
В качестве одного из объектов исследования были выбраны производные хиназолона. Среди веществ данной группы — ряд известных препаратов с высокой биологической активностью (метаквалон, доксазозин). Нами были изучены особенности протекания ряда взаимодействий с участием производных хиназолина, где результат реакции в большинстве случаев зависит от условий ее проведения. С использованием антраниловой кислоты получены дигидрохиназолоны и бенздиазепины, содержащие сложноэфирную группу. Доказано, что введение в структуру хиназолина карбонильной группы в качестве фармакофора приводит к повышению биологической активности и снижению токсичности. Предложен оригинальный подход к созданию новых конденсированных гетероциклических структур, позволяющий варьировать размер лактамного цикла.
Перспективными в плане практического использования являются многокомпонентные реакции, позволяющие в одну стадию на основе нескольких реагентов получать сложные гетероциклические системы. В этом отношении интересным оказалось использование ароматических изотиоцианатов в реакции с метиленактивными нитрилами в присутствии элементарной серы. В результате прохождения внутримолекулярной каскадной конденсации происходит образование новой гетероциклической системы — дигидротиазолохиназолина. При введении в данную реакцию четвертого компонента (сероуглерода) происходит циклизация аминотиазолинтиона с образованием пиримидинового цикла. В литературе имеются лишь единичные примеры четырехкомпонентных реакций, и данная реакция позволяет не только получать ранее неизвестные гетероциклические системы, но и обогащает теорию органического синтеза.
Особый интерес вызывают соединения, которые объединяют в своей структуре 2 и более фармакофора (фармакофор — фрагмент молекулы, отвечающий за проявление определенной активности), что позволяет динамично модифицировать их структуру и добиваться синергизма (усиления) биологического действия. В связи с этим нами осуществлен синтез бис-гетероциклических систем с использованием реакции Гевальда на основе таких бифункциональных реагентов, как бис-гидразиды, диамиды циануксусной кислоты и т.д. Как бис-гетероциклические системы представляют интерес и 6-гетарилтиенопиримидины с ядрами оксадиазола, пиразола и тиазола, для которых предложены оригинальные методы синтеза. Среди этих соединений выявлены вещества с высокой противовоспалительной активностью.
Большое внимание уделяется разработке технологий однореакторных (one-pot) взаимодействий — осуществлению многокомпонентных взаимодействий одномоментно и в одном реакционном сосуде. Такая методология позволяет значительно сократить время синтеза, его стадийность, уменьшить использование растворителей и повысить выход конечных продуктов реакции. Так, нам удалось разработать метод получения новых гетероциклических систем, содержащих аннелированный триазольный фрагмент, по реакции 2-аминодиазолов с альдегидами и метилкетонами.
В своих исследованиях мы не ограничиваемся только классическими методами органического синтеза. Так, была проведена серия синтетических работ с использованием микроволновой активации химических реакций. Несомненный как теоретический, так и практический интерес представляет изучение механохимической активации органических реакций. Нами показано, что механохимическая активация реагентов в шаровой планетарной мельнице приводит к их быстрому переходу из кристаллического состояния в аморфное, что существенно повышает дисперсность системы и понижает энергетический барьер реакции. Введение в технологическую схему механохимической стадии процесса в большинстве случаев позволяет повысить выход целевого продукта, сократить затраты на растворители, интенсифицировать процесс и повысить его экологическую безопасность.
2. Модификация природных соединений
Мы учимся у матушки-природы. В ходе эволюции в природе происходит синтез уникальных по своим свойствам биологически активных веществ. Их модификация с целью улучшения или кардинального изменения свойств — перспективный путь создания новых высокоэффективных лекарственных средств.
В этом плане интересным объектом является нейрогормон эпифиза — мелатонин, который выполняет функции регулятора биоритмов, старения и антиоксидантных систем. Нами решена задача синтеза новых структурных аналогов мелатонина, в частности получены спироциклические производные 2-оксиндола и 2-аминопирана, содержащие мелатониновый фармакофор. Среди полученных соединений отобраны вещества с гепатопротекторным и антиоксидантным действием. Субстанция спиразидол в настоящее время проходит углубленные доклинические исследования.
Еще один пример — кардиостероиды, которые долгое время являются одними из основных препаратов в лечении сердечной недостаточности. К сожалению, природные сердечные гликозиды не лишены недостатков, один из которых — высокая токсичность. Нами синтезирован ряд производных карденолидов с целью поиска эффективных веществ кардиотонического и антиаритмического действия с низкой токсичностью.
Несмотря на то что на сегодня механизм действия кардиостероидов на сердечную мышцу достаточно хорошо изучен, известен рецептор, на который они действуют, эффективных подходов к конструированию молекул с заданными кардиотоническими свойствами до сих пор не найдено. С использованием QSAR-методологии (изучение корреляционных взаимосвязей «структура — действие»), нами установлено, что наибольшую активность проявляют соединения, в которых положительный и отрицательный заряд расположены в виде правильного «сендвича», по типу наиболее активного 3-О-ацетил-19-альдоксимстрофантидина, что может служить ключевым критерием к дизайну новых кардиостероидов. Кроме того, выявление в последнее время противораковой активности кардиостероидов побудило нас к синтезу на их основе ряда совершенно новых оригинальных структур: кардиотонических стероидов с дополнительными лактонными циклами.
Отдельное синтетическое направление НФаУ посвящено химической модификации 2-иминокумаринов — аналогов широко известных природных соединений растительного происхождения — кумаринов (вещества антикоагулянтного, бактерицидного и противоопухолевого действия). Нами широко изучена реакционная способность 2-иминокумаринов, предложен механизм их рециклизации под действием нуклеофильных реагентов, что позволило осуществить синтез ранее недоступных 3-гетерилкумаринов с азиновыми и азольными циклами. Закономерности, установленные при изучении химии кумаринов, были с успехом перенесены на новый класс веществ — 7-азакумарины.
3. Синтез комбинаторных библиотек для поиска биологически активных соединений
В течение последних 20 лет происходит интенсивное развитие технологий органического синтеза, позволяющих осуществлять синтез комбинаторных библиотек (большого набора подобных по структуре веществ) для высокопроизводительного автоматизированного биологического скрининга (отбора, просеивания) новых физиологически активных веществ. В НФаУ комбинаторные технологии давно и успешно используются в алгоритме поиска новых лекарственных средств (рис. 2 — прим. ред.). В качестве примера можно привести ряд работ по направленному синтезу новых биологически активных соединений.
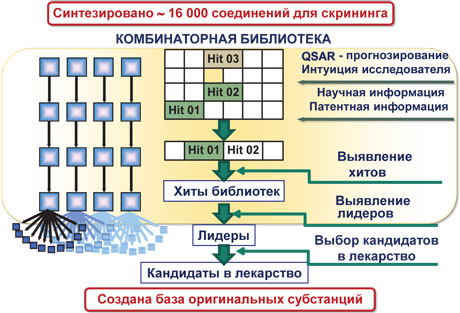
Так, для поиска новых эффективных противораковых средств с антиангиогенным действием были синтезированы комбинаторные библиотеки производных хиназолинов. Для углубленных исследований отобрано 46 молекул.
На основании новой базовой структуры бензопирано[2,3-d]пиримидина получены комбинаторные библиотеки из 270 его производных. Эти материалы были опубликованы в Journal of Combinatorial Chemistry, и данная публикация вошла в список наиболее цитируемых статей, опубликованных в 2008 г.
При создании комбинаторных библиотек метанобензоксадиазоцинов нами были найдены технологические приемы, которые позволили расширить границы применимости реакции Биджинелли.
Выбор оптимальных реакционных условий, которые обеспечивают региоселективное прохождение ряда реакций циклоприсоединения с участием азидов и метиленактивных нитрилов (клик-реакции) позволил осуществить синтез 19 комбинаторных библиотек производных 5-амино-1,2,3-триазолов.
Эффективным методом создания комбинаторных библиотек оказались и каскадные превращения («домино»-реакции). Так, оказалось, что аминогруппа 1,2,3-триазола способна к каскадным превращениям с образованием конденсированных 1,2,3-триазолов.
Если говорить о теоретических размерах комбинаторных библиотек, то они могут достигать десятков и даже сотен тысяч веществ. Однако на практике осуществлять их синтез нерационально и очень дорого. Поэтому в последнее время широко используется компьютерное моделирование для формирования фокусированных библиотек веществ с заданными свойствами. Как правило, для этого используют различные QSAR-модели, молекулярный докинг, методы картирования, регрессионные модели и т.д.
С использованием различных методик виртуального (in silico) скрининга нами определен профиль всех синтезированных комбинаторных библиотек, отобраны перспективные структуры (хиты библиотек), осуществлена дальнейшая модификация структуры для проведения биологических испытаний.
Так, среди производных ариламинопирролонов на основании результатов компьютерного прогнозирования отобран ряд веществ, среди которых новое перспективное нестероидное противовоспалительное средство — ортолон (патент Украины 2007 г.). Молекулярный докинг ортолона с циклооксигеназой-2 (ЦОГ-2) позволил выявить особенности строения молекулы 1-арил-4-(ариламино)пирролонов-2. В дальнейшем эти данные будут использованы для оптимизаций структуры и поиска наиболее эффективной субстанции в этом ряду соединений.
Еще один пример. Проблемой сахарного диабета мы занимаемся уже более 30 лет. К сожалению, заболеваемость сахарным диабетом в мире приняла характер эпидемии. В Украине данная патология диагностирована у более 1 млн человек, в Европе — у десятков миллионов. Для целенаправленного синтеза антидиабетических средств нами синтезированы комбинаторные библиотеки производных 3-бензилимидазолил-1,2,2-триметилциклопентанкарбоновой кислоты. Наши усилия оказались ненапрасными. Была найдена субстанция диакамф и на ее основе создано антидиабетическое средство, проявляющее сахароснижающее, антидиабетогенное и антиоксидантное действие (патенты Украины и Российской Федерации). Развивая эти идеи, мы синтезировали комбинаторные библиотеки солей и амидов 3-бензилимидазолил-1,2,2-триметилциклопентанкарбоновой кислоты с производными бигуанидинов. В результате получен ряд веществ с новыми видами активности: нефропротекторной, церебропротекторной, ноотропной, антидепрессивной и репаративной.
Особое внимание уделяется и разработке комбинированных препаратов. Так, нами разработано оригинальное комбинированное антидиабетическое средство на основе диакамфа и метформина для лечения проявлений метаболического синдрома. Показано, что диакамф потенцирует гиполипидемическое, антиатерогенное, антиоксидантное действие и в 5,3 раза снижает токсические свойства метформина.

В последнее время в область создания инновационных лекарственных средств ворвались нанохимия и наномедицина. В связи с этим открываются огромные перспективы. Одно из новых направлений нашей работы — исследование синергизма комбинаций нанометаллов с лекарственными субстанциями, которое проводится совместно с Институтом электросварки им. Е.О. Патона НАН Украины.
Сегодня на повестке дня изучение комбинированного препарата диакамфа с наноцинком. Диакамф стимулирует β-клетки Лангерганса поджелудочной железы и способствует их росту. Соединив диакамф с наночастицами цинка, который сам по себе усиливает инсулинообразование, мы надеемся получить многообещающее по эффективности лекарственное средство.
Следующее направление, в котором нанотехнология должна сыграть первую скрипку, — повышение биодоступности лекарственных средств и обеспечение их адресной доставки. Так, для лечения ряда заболеваний легких активную лекарственную субстанцию интегрируют в липосомы, чтобы воздействовать только на легочную ткань и избежать вредного влияния на весь организм.
Также существенно возрос интерес к использованию наноматериалов, в частности углеродных нанотрубок для фармацевтических целей. Нами совместно с американскими учеными из Рочестерского университета (США) проведены квантово-химические расчеты наноконьюгатов углеродных нанотрубок с противораковыми агентами. Показана возможность размещения биологически активных молекул в полости нанотрубки и их высвобождение под воздействием инфракрасного излучения. Определена токсичность таких нанокомплексов. Это открывает путь для создания противораковых препаратов нового поколения.
Таким образом, на сегодня в НФаУ разработан, апробирован и внедрен рабочий алгоритм создания оригинальных лекарственных средств: от синтеза новой молекулы до внедрения в производство по всем правилам фармацевтической надлежащей производственной практики (GMP). Вместо эмпирического поиска и перебора больших количеств аналогов известных биологически активных молекул выстроена стройная и эффективная система, которая позволяет решить задачи различного уровня сложности — от конструирования молекул с заданными свойствами до разработки эффективной лекарственной формы и документального сопровождения лекарственного препарата. Этот алгоритм успешно реализуется не только в Украине. Решая проблему обеспечения населения лекарственными средствами, этот опыт используют многие страны постсоветского пространства.
Создание инновационных лекарственных средств особенно актуально в связи с реализацией в Украине государственной программы импортозамещения жизненно важных лекарств. Здоровье нации — всегда на первом месте, ведь люди — наибольшая ценность державы.
Фармация как стратегическая отрасль в системе охраны здоровья работает для обеспечения населения качественными, безопасными лекарствами. И, безусловно, научная деятельность нашего коллектива направлена на перспективу, проведение инициативных разработок и исследований инновационных материалов и технологий для создания оригинальных высокоэффективных лекарственных средств.
Пресс-служба «Еженедельника АПТЕКА»

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим