25–26 квітня 2002 р. в Будинку вчених НАН України в Києві відбувся інформаційно-консультативний семінар для уповноважених осіб суб’єктів господарської діяльності, що займаються виробництвом (виготовленням), оптовою та/або роздрібною реалізацією лікарських засобів, на тему «Роль та функції Уповноважених осіб суб’єктів господарської діяльності під час виробництва (виготовлення), зберігання та/або реалізації лікарських засобів у відповідності до вимог наказів МОЗ України № 436 від 30.10.2001 р. та № 497 від 12.12.2001 р.».
Семінар було організовано ДП «Український науково-дослідний центр фармації» спільно з Державною інспекцією з контролю якості лікарських засобів МОЗ України, ДП «Державний фармакологічний центр» МОЗ України та Всеукраїнською аптечною асоціацією.
Головував на семінарі перший заступник Головного державного інспектора України з контролю якості лікарських засобів Віталій Варченко. Перед присутніми виступили заступник Головного державного інспектора України з контролю якості лікарських засобів Сергій Сур, заступник директора ДП «Державний фармакологічний центр» МОЗ України Віктор Чумак та ін.
Відтоді як було видано наказ МОЗ України № 436, згідно з яким в Україні вперше серед країн колишнього СРСР було запроваджено посаду уповноваженої особи («Щотижневик АПТЕКА», № 12 (333) від 25 березня 2002 р.), минуло небагато часу. На черговий семінар Державної інспекції з контролю якості лікарських засобів зібралися уповноважені особи з усіх регіонів України.
Серед питань, які цікавлять уповноважених осіб сьогодні, насамперед — це проблема доступу до інформації, конче потрібної для їхньої роботи. Уповноважених осіб потрібно оперативно інформувати про зміни у державному Реєстрі лікарських засобів (ЛЗ), згідно з яким можна перевірити автентичність ЛЗ, тобто визначити, чи вони не фальсифіковані. На сьогодні шляхи отримання такої інформації далекі від досконалості, що є причиною невчасного отримання приписів, листів тощо.
Яким чином можна поліпшити становище, що склалося? Учасники семінару пропонували створити спеціалізовану Інтернет-сторінку, на якій була би розміщена вся необхідна інформація. Проте виникають певні труднощі, зокрема, щодо визначення конкретних виконавців цього завдання.
З доповіддю про становище з фальсифікацією ЛЗ на ринку України та світових ринках виступила начальник відділу Державної інспекції з контролю якості лікарських засобів МОЗ України Ірина Пилипенко. Огляд світової преси переконливо свідчить про те, що ця проблема не є характерною виключно для України, проте найбільше потерпають від неї країни з перехідною економікою.
Фальсифіковані ЛЗ — лікарські препарати, які навмисно неправильно промарковані щодо ідентичності та назви виробника. Фальсифікованими можуть бути як оригінальні, так і відтворені ЛЗ; вони можуть містити інгредієнти у відповідному або невідповідному складі, можуть не містити діючих речовин або містити їх у недостатній кількості, або бути розфасованими в підробленій упаковці (наказ МОЗ України № 436).
За даними ВООЗ у 1999 р. в усьому світі із 771 зареєстрованого випадку виявлення фальсифікованих ЛЗ 325 (42%) складали підробки протималярійних препаратів та антибіотиків. У I кварталі 2002 р. в Україні виявлено 15 серій фальсифікованих ЛЗ, серед яких Кокарбоксилаза для ін’єкцій, Бісептол у таблетках та для ін’єкцій, Трихопол та сироп кореня солодки.
Структуру фальсифікації згідно з даними ВООЗ у 1999 р. подано на рисунку. Привертає увагу той факт, що до складу переважної більшості фальсифікованих ЛЗ не входять активні компоненти.
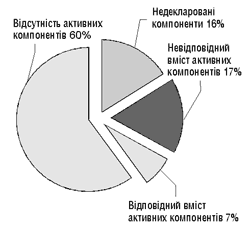 |
Рисунок. Структура фальсифікації згідно з даними ВООЗ (1999 р.)
На думку доповідачки, до основних факторів, що сприяють поширенню фальсифікованих ЛЗ, належать:
-
недосконалість законодавчої бази;
-
недостатні повноваження національних контролюючих органів;
-
невиконання вимог чинного законодавства;
-
недостатній розмір штрафних санкцій;
-
корупція та конфлікт інтересів;
-
структури продажу, що включають багатьох посередників;
-
попит, що перевищує пропозицію;
-
високі ціни на ЛЗ;
-
можливість нелегального виробництва ЛЗ у промислових умовах;
-
неефективна взаємодія між органами влади.
Для створення ефективної системи запобігання поширенню фальсифікованих ЛЗ необхідно дотримуватися таких умов:
-
вимоги законодавства, що забороняють виробництво, імпорт та продаж фальсифікованих ЛЗ;
-
ефективне функціонування уповноваженого органу з контролю якості ЛЗ;
-
взаємодія Державної інспекції з контролю якості ЛЗ з митними органами, МВС та СБУ;
-
посилення взаємодії між фармацевтичною промисловістю, імпортерами ЛЗ, представниками оптових та роздрібних ланок, а також споживачами;
-
посилення міжнародного співробітництва.
Для запобігання виробництву, імпорту та продажу фальсифікованих ЛЗ в Україні розробляється відповідна нормативно-правова база. Зокрема, було видано:
-
наказ МОЗ України від 30 жовтня 2001 р. № 436 «Про затвердження Інструкції про порядок контролю якості лікарських засобів під час оптової та роздрібної торгівлі»;
-
наказ МОЗ України від 12 грудня 2001 р. № 497 «Про затвердження Порядку заборони (зупинення) та вилучення з обігу лікарських засобів на території України».
Доповідь начальника відділу забезпечення якості робіт Державної інспекції з контролю якості ЛЗ МОЗ України М. Гудзя «Правила належної дистриб’юторської практики» була присвячена новим тенденціям розвитку фармацевтичного ринку. Настанова 42-01-2002 «Лікарські засоби. Належна практика дистрибуції», що затверджена наказом МОЗ України від 19 березня 2002 р. № 103 («Щотижневик АПТЕКА», № 13 (334) від 1 квітня 2002 р.), надає рекомендації щодо дотримання якості ЛЗ на етапі оптової та роздрібної реалізації.
Створення механізмів контролю за якістю під час оптової та роздрібної реалізації ЛЗ — одне з ключових завдань Державної інспекції з контролю якості ЛЗ МОЗ України. Ці механізми, з одного боку, мають враховувати реалії українського фармацевтичного ринку, а з іншого — сприяти поступовому впровадженню елементів системи GDP (належна дистриб’юторська практика) та GPP (належна аптечна практика).
GDP — система забезпечення якості ЛЗ під час оптової торгівлі. Основні її принципи викладені у Директиві Ради ЄС 92/25/ЕЕС від 31.03.92 р. Система якості, згідно з якою працюють дистриб’ютори, повинна гарантувати що:
-
ЛЗ, які закуповуються і реалізуються, зареєстровані згідно з вимогами законодавства;
-
умови зберігання, включаючи період транспортування, виконуються;
-
виключено перехресне забруднення ЛЗ;
-
забезпечено відповідний обіг ЛЗ під час складування;
-
ЛЗ зберігаються у відповідних приміщеннях, які охороняються.
Виступаючий також зупинився на принципах ЄС щодо організації діяльності дистриб’юторів згідно з Директивою, питаннях самоінспектування, контролю за якістю ЛЗ, питаннях повернення фальсифікованих, ушкоджених та інших ЛЗ.
На завершення Н. Гудзь звернув увагу присутніх на необхідність дотримання Настанови 42-01-2002 «Лікарські засоби. Належна практика дистрибуції», що затверджена наказом МОЗ України від 19.03.02 р. № 103 («Щотижневик АПТЕКА», № 13 (334) від 1 квітня 2002 р.). Відповідно до наказу цей документ введено в дію з 20.03.2002 р. Настанова декларує, що «належна практика дистрибуції є частиною забезпечення якості ЛЗ, а інспектування та відповідність GDP — базовим елементом системи ліцензування дистриб’юторів».
З доповіддю «Нові нормативні документи з контролю якості ЛЗ на ринку України» виступив заступник Головного Державного інспектора України з контролю якості ЛЗ С. Сур. Він, зокрема, висвітлив основні проблеми фармацевтичного ринку перехідного періоду (згідно з доповіддю експертів ВООЗ на конгресі Міжнародної фармацевтичної асоціації у Відні, 2000 р.).
Якщо порівняти заходи, які вживаються щодо фактів продажу неякісних ЛЗ у розвинених країнах Європи та в Україні, то таке порівняння буде не на користь України: до 2002 р. в Україні широко практикували тільки вилучення серій ЛЗ, тоді як у світі вживають більш жорсткі заходи.
Для поліпшення ситуації було видано наказ МОЗ України від 12.12.2001 р. № 497 «Про затвердження Порядку заборони (зупинення) та вилучення з обігу ЛЗ на території України». Видання цього наказу було спрямоване на досягнення трьох цілей:
-
встановити такі правила гри на фармацевтичному ринку, які б робили економічно невигідним недотримання вимог нормативних документів, випуск неефективних, неякісних ЛЗ;
-
створити механізм вилучення з обігу неякісних ЛЗ на території України, в тому числі в лікувальних установах;
-
боротися не тільки з наслідками, але й запобігати причинам випуску неякісних ЛЗ.
Для вилучення з обігу ЛЗ існує така процедура:
1. Державна інспекція з контролю якості ЛЗ МОЗ України оцінює наявність підстав для заборони та вилучення з обігу ЛЗ.
2. Головний державний інспектор або його заступник видає Припис про заборону та вилучення з обігу ЛЗ.
3. Всі суб’єкти господарської діяльності (в тому числі лікувально-профілактичні установи (ЛПУ) в 10-денний термін повинні вжити заходів щодо перевірки наявності та вилучення заборонених ЛЗ, зазначених у Приписі, шляхом повернення постачальнику, знищення або передачі в обмежений обіг (в ЛПУ).
4. У разі виявлення заборонених ЛЗ інформацію про вжиті заходи суб’єкт господарської діяльності надає територіальній державній інспекції за місцем розташування.
Наказ МОЗ України від 30 жовтня 2001 р. № 436 «Про затвердження Інструкції про порядок контролю якості ЛЗ під час оптової та роздрібної торгівлі» має на меті:
-
підтримання гарантованого рівня якості ЛЗ у мережі оптової та роздрібної торгівлі, щоб зареєстровані лікарські засоби реалізувалися без будь-яких змін своїх властивостей;
-
запобігання проникненню в мережу оптової та роздрібної торгівлі неякісних, фальсифікованих і незареєстрованих ЛЗ.
«Інструкція про порядок контролю якості лікарські засоби під час оптової та роздрібної торгівлі» містить такі елементи GDP:
-
наявність уповноваженої особи з необхідними повноваженнями;
-
закупівля та продаж ЛЗ тільки у суб’єктів господарської діяльності, що мають відповідні ліцензії;
-
система документування, яка дає змогу відстежувати отримання та продаж кожної серії ЛЗ;
-
повідомлення уповноваженої особи, надіслане до Державної інспекції з контролю якості ЛЗ, про виявлення неякісних, фальсифікованих та незареєстрованих ЛЗ;
-
візуальна перевірка уповноваженою особою кожної партії ЛЗ та супроводжувальних документів.
Чи здатні запропоновані заходи кардинальним чином вплинути на ситуацію, що склалася з якістю ЛЗ, покаже час. Проте вже зараз можна зазначити, що активна позиція державних регулюючих органів подає надії.
Денис Сухінін

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим