
 В ходе пленарного заседания XVII Российского национального конгресса «Человек и лекарство», проходившего 12–16 апреля 2010 г. в Москве*, выступил Владимир Петров — академик и член президиума РАМН, профессор, доктор медицинских наук, заслуженный деятель науки РФ, заслуженный врач РФ, ректор Волгоградского государственного медицинского университета (ВГМУ), заведующий кафедрой клинической фармакологии и интенсивной терапии. В своем докладе на тему «Создание новых отечественных инновационных лекарственных средств как основа лекарственной безопасности России» он решительно отбросил сомнения в необходимости конкретизации государственных гарантий в сфере лекарственного обеспечения, где, кроме сугубо медицинской составляющей, имеет большое значение сторона экономической доступности лекарственных средств (ЛС) для населения (что безусловно важно не только в условиях финансового кризиса).
В ходе пленарного заседания XVII Российского национального конгресса «Человек и лекарство», проходившего 12–16 апреля 2010 г. в Москве*, выступил Владимир Петров — академик и член президиума РАМН, профессор, доктор медицинских наук, заслуженный деятель науки РФ, заслуженный врач РФ, ректор Волгоградского государственного медицинского университета (ВГМУ), заведующий кафедрой клинической фармакологии и интенсивной терапии. В своем докладе на тему «Создание новых отечественных инновационных лекарственных средств как основа лекарственной безопасности России» он решительно отбросил сомнения в необходимости конкретизации государственных гарантий в сфере лекарственного обеспечения, где, кроме сугубо медицинской составляющей, имеет большое значение сторона экономической доступности лекарственных средств (ЛС) для населения (что безусловно важно не только в условиях финансового кризиса).
Исследовательский цикл ЛС хорошо известен всем фармакологам и фармацевтам: в основе рождения нового лекарства лежат фундаментальные исследования (подробнее см. предыдущую публикацию — прим. ред.), — и без особого внимания (финансирования) со стороны правительства, лидеров фармацевтической индустрии, различных организаций и фондов проведение этих исследований, по существу, невозможно. Для создания новых препаратов необходимо выполнение задач, вытекающих из глубокого понимания патологических процессов, — это возможно в условиях клиник, которые имеют в своих рядах не только практических врачей, занятых в непосредственном оказании медицинской помощи, но и ученых, развивающих знание о болезни. Такие знания невозможно получить без выполнения прикладных исследований в клинике, предоставляющих информацию об эффективности и безопасности лечения. Это происходит в результате проведения, анализа и осмысления клинических исследований и метаанализов: сравнивая между собой методы лечения, специалисты могут выбрать наиболее эффективные и безопасные из них, — которые и должны ложиться в основу оказания медицинской помощи и ее стандартов (в настоящее время в РФ ведется активная работа над новыми стандартами оказания лекарственной помощи).

Лекарства — как люди: они рождаются, живут, уходят со сцены. Они умирают. По завершении исследований получают новый препарат; с окончанием срока его патентной защиты на рынке появляются генерические препараты, начинающие конкурентную борьбу против оригинального средства. Дети — против отцов. Трудно было бы приветствовать подобные процессы, если бы не то, что «дети» — доступнее для широких масс населения и, соответственно, применяются шире, спасая людей и обеспечивая качество жизни пациентов. Далее на рынке появляются все новые генерики, знаменуя новый этап конкуренции — на этот раз уже между генериками: качественными и не очень. Конкуренция ведет к снижению цены, что позволяет получить надлежащее лечение всем гражданам сообщества (в том числе и в условиях обязательного медицинского страхования). А затем наступает следующий этап: анализ и разочарование. По мнению оратора, это касается практически всех ЛС. Недостаточная мощь и широта терапевтических эффектов с одной стороны и значительное количество нежелательных реакций с другой требуют создания новых лекарств. Как известно, усредненно по миру финансово-временные затраты на создание (от разработки до внедрения) оригинального препарата (одного АФИ из 8–10 тыс. молекул) исчисляются периодом в 15 лет жизни и суммой в 1 млрд дол. США. По оценкам В. Петрова, в России сегодня существуют реальные условия и возможности снизить сроки и стоимость разработки ЛС — для этого предложено предпринять ряд шагов. В стране принята Стратегия развития фармацевтической промышленности РФ на период до 2020 г. (утвержденная приказом Министерства промышленности и торговли РФ от 23.10.2009 г. № 965; — прим. ред.). Этот документ предполагает определенные объемы и источники финансирования; всего на период 2009–2020 гг. предусматривается выделение 177 620 млн рублей (в ценах февраля 2009 г.), в том числе по направлениям:
- «Повышение квалификации кадров и создание инфраструктуры» — 35 220 млн руб.;
- «Переход на GMP» — 36 000 млн руб.;
- «Разработка лекарственных средств» — 106 400 млн руб.
— Конечно, этих средств явно недостаточно, однако в рамках государственной поддержки они появились впервые, — отметил докладчик.
По принципу хронологии воплощения основные мероприятия по реализации Стратегии разделены на три группы:
- до 2013 г. — размещение на территории РФ высокотехнологичных фармацевтических производств;
- до 2017 г. — внедрение генерического импортозамещения, приобретение соответствующих лицензий и обеспечение лекарственной независимости страны;
- до 2020 г. — разработка инновационных препаратов — аналогов средств, находящихся под патентной защитой; разработка инновационных препаратов, не имеющих аналогов.
Основной целью государственной политики РФ по развитию национальной фармацевтической промышленности на период до 2020 г. является создание условий для ее перехода на инновационную модель развития, что должно привести к росту обеспеченности населения и учреждений здравоохранения ЛС отечественного производства, при общем увеличении обеспечения нуждающихся лекарствами до среднеевропейского уровня как по количественным, так и по качественным показателям. Среди ожидаемых результатов реализации Стратегии фигурируют:
- увеличение доли продукции отечественного производства в общем объеме потребления на внутреннем рынке до 50% в стоимостном выражении к 2020 г.;
- изменение номенклатуры ЛС, произведенных на территории РФ, в том числе увеличение доли инновационных препаратов в портфелях локальных производителей до 60% в стоимостном выражении;
- увеличение экспорта фармацевтической продукции в 8 раз по сравнению с 2008 г.;
- обеспечение лекарственной безопасности РФ согласно номенклатуре стратегически важных ЛС и вакцин;
- стимулирование организации производства фармацевтических субстанций на территории РФ в размере, необходимом для обеспечения выпуска 50% готовых ЛС в денежном выражении, включая не менее 85% по номенклатуре из Перечня жизненно необходимых (важнейших) лекарственных средств (ЖНВЛС)**.
Внедрение основных мероприятий Стратегии и получение ожидаемых результатов предусматривает три основных этапа:
1. Локализация производства и разработки ЛС на территории РФ;
2. Развитие фармацевтической отрасли на рынке РФ;
3. Развитие российской фармацевтической отрасли на внешних рынках.
— Возможно, кому-то это покажется «благими намерениями», — но они уже начинают реализовываться, — подчеркнул В. Петров. — В развитии современной фармацевтической отрасли преобладают две основных тенденции ее насыщения и формирования: инновационные ЛС (оригинальные разработки) и генерические препараты. Оба эти направления важны — и каждое по-своему. При этом необходимо понимать, что собственные инновационные препараты — дороги, но чужие — будут дороже. Ведь оригинальные разработки — это золотые яйца, снесенные курицей: важно только общими усилиями вырастить эту курицу и не пустить ее под нож. Между тем, генерический вектор — это известный и надежный путь экономии финансов в любом государстве мира: применение таких ЛС позволяет предоставлять надлежащую медицинскую (фармакотерапевтическую) помощь всем слоям населения.
Так есть ли собственные инновационные разработки у России? Известно, что новые препараты создаются прежде всего на основе новых молекул. Так, Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration) ежегодно регистрирует около 20 новых молекул. Последнее время в печати, средствах массовой информации и с других трибун различного ранга нередко звучит тезис о том, что в России нет ничего нового и давно уже ничего не создается. По мнению В. Петрова, основания для таких заявлений, увы, небеспочвенны — однако подобный упрек справедлив лишь отчасти. До тех пор, пока инновационная продукция не будет востребована и обеспечена платежеспособным спросом, — ее доля на рынке будет ничтожно мала. Это значит, что российские отечественные разработки по-прежнему останутся скорее исключением, чем правилом. В то же время в РФ есть как современные научно-технологические и производственные мощности, так и собственные уникальные препараты. Есть ниши, в которых российские ученые и специалисты добились значительных успехов, — например, иммунология и вирусология, до сих пор являющиеся передовыми с точки зрения как научного, так и производственного потенциала. Докладчик напомнил, как оперативно Россия смогла предложить всему миру вакцину против птичьего гриппа и даже гриппа пандемического штамма H1N1, — и эти вакцины закупаются многими странами мира, в том числе США. Но прежде всего нужно обеспечить самих себя. Докладчик также напомнил о первом российском препарате гормона роста, технология получения которого была разработана учеными Института биоорганической химии РАН им. М.М. Шемякина и Ю.А. Овчинникова; в этом же научном учреждении группой ученых под руководством академика РАН А.И. Мирошникова разработана оригинальная российская технология получения гранулоцитарного колонийстимулирующего фактора. В Уфе (на предприятии «Фармстандарт-Уфавита») производятся инсулины и препарат гормона роста (Растан), которые относятся к сфере высоких технологий и имеют хорошие перспективы не только в решении задач, стоящих перед российским здравоохранением, но и относительно экспортного потенциала. Сегодня препарат Арбидол (разработанный еще в Советском Союзе совместными усилиями ученых Всесоюзного научно-исследовательского химико-фармацевтического института, Медицинского радиологического научного центра РАМН (Обнинск) и Ленинградского НИИ эпидемиологии и микробиологии им. Л. Пастера) лидирует в продажах среди противовирусных средств и препаратов для лечения острых респираторных заболеваний, достойно конкурируя с известными зарубежными брэндами этой группы на российском и зарубежных фармацевтических рынках.
Опыт эффективного взаимодействия научного сектора и фармпроизводства есть в создаваемом Волгоградском фармакологическом кластере: результатом инновационных исследовательских проектов стало создание таких препаратов, как Аспаркам L раствор для инфузий, Аспаркам L раствор для внутривенного введения, Магний Пиридоксин (комбинация L-аспарагиназы с пиридоксином), — те препараты, которые смогут заменить собой многие зарубежные средства для лечения сердечно-сосудистой патологии, содержащие катионы Mg++ и К+. Объединение научно-исследовательского потенциала вузовской науки с мощностями российской фармацевтической компании «Материа Медика» позволило создать, испытать и вывести на рынок 9 принципиально новых, эффективных и безопасных препаратов для лечения социально значимых заболеваний, которые содержат антитела к различным рецепторам. В числе таких противовирусных средств-иммуномодуляторов, индукторов интерферона (которые зарегистрированы не как гомеопатические, а как полноценные аллопатические ЛС) Анаферон, который в ходе многоцентровых исследований продемонстрировал высокую эффективность при лечении гриппа и ОРВИ (в том числе в педиатрической практике), внесен в российский национальный Перечень ЖНВЛС. Также учеными ВГМУ разработан новый пероральный антигипергликемический препарат диабенол (производное имидазола): в свое время основные средства для разработки диабенола были получены в рамках государственных программ, а грантовые средства составили лишь небольшую часть инвестиций — в этой связи В. Петров подчеркнул значимость государственных программ, подкрепленных финансированием, как важного механизма решения социально значимых задач.
Как расширить передовые тенденции и упрочить фармакобезопасность страны? Предложения Проблемной комиссии по клинической фармакологии обмена веществ РАМН, возглавляемой докладчиком, сводятся к тому, чтобы (через вновь созданный экспертный совет) еще раз определить приоритетные направления, в частности:
- популяционная лекарственная профилактика и терапия: дешевые, эффективные, безопасные препараты для профилактики и лечения сердечно-сосудистых заболеваний, сахарного диабета, вирусных инфекций и др.).
- создание poly-pill: комбинации в одной таблетке ингибитора ангиотензинпревращающего фермента, статина и ацетилсалициловой кислоты — эти три средства необходимо соединить в одной таблетке (возможны и другие рекомендации).
Вначале необходимо провести экспертную оценку, произвести жесткую ревизию и внедрить в практику уже имеющиеся российские разработки; а затем соединить в едином научно-производственном цикле процесс исследований в российских научных центрах и производства на крупных фармацевтических предприятиях. С целью решения поставленных задач был выдвинут для рассмотрения ряд возможных (и необходимых, по мнению оратора) конкретных шагов и решений, например:
- законодательно запретить регистрацию новых генериков при наличии генерического препарата российского производства (при обязательном условии усиления контроля качества российского производителя);
- исключить из ограничительных списков зарубежные препараты при наличии российского генерика (при обязательном выполнении того же условия).
К числу основных системных проблем фармацевтической отрасли относятся:
- дисбаланс регуляторных требований к отечественным и зарубежным предприятиям-производителям;
- экономическая демотивация отечественных производителей;
- дефицит высококвалифицированных кадров для фармацевтической отрасли;
- отсутствие механизмов финансирования разработок ЛС;
- недостаточный уровень российского патентного законодательства и законоприменительной практики относительно международных стандартов;
- отсутствие обязательных для исполнения правил производства и контроля качества ЛС, идентичных международным правилам GMP (Егоров В.М., 2009).
Среди нерешенных проблем остается и то, что разработка инновационных ЛС требует прямых инвестиций в научные центры, а не опосредованно через фармпроизводство. Не вложив средств в фундаментальную науку сегодня — завтра не получить результатов прикладных исследований; не построив лаборатории, не обновив оборудование, не закупив реактивов для фундаментальных исследований — отобрать у страны завтрашние открытия и не позволить ей растить своих собственных ученых, способных развивать науку на производстве. Государство должно взять на себя часть рисков, — при этом важно вкладывать средства в коллективы, дающие конкурентоспособную научную продукцию. Россия — большая. А Москва — это еще не вся Россия: она сильна регионами с их замечательными головами. Ведь если не развивать региональные научные центры — светлые головы начинают искать другие занятия, которые смогут хоть как-то их прокормить. Не секрет, что в сложившейся мировой практике производители покупают идею — молекулу, композицию — у исследователей и лабораторий, инвестируя средства в уже отработанные перспективные проекты. Молекулы рождаются не в производстве, а в тиши научных лабораторий, оснащенных кадрами, которых нарождающиеся российские производители позволить себе не могут. Вывод — необходима поддержка научного сектора. В заключение академик В. Петров высказал глубокое убеждение в том, что фармпроизводители не должны заниматься ни клиническими, ни доклиническими исследованиями новых разработок — они должны делегировать эту часть деятельности ученым (путем аутсорсинга сертифицированным НИИ и клиникам), что укрепит научный потенциал страны, повысит качество проводимых исследований. Так — на пути от фундаментальных исследований к знаниям о патологии и далее к результатам прикладных исследований — специалисты получат желанную цель: эффективное и безопасное лекарство. Таким образом, фармацевтическая индустрия, являющаяся одним из важнейших элементов системы здравоохранения РФ, стоит на пороге коренных преобразований, связанных с формированием инновационной составляющей, развитием импортозамещения и ростом производительности труда. Конечной целью всех этих инициатив является создание устойчивой национальной индустрии, способной обеспечить население страны доступными, эффективными и безопасными лекарствами в необходимых количествах, в том числе новым поколением инновационных ЛС.
 В этом контексте немалый интерес слушателей вызвал доклад на тему «Состояние и перспективы обеспечения качества эффективности и безопасности лекарственных средств на территории Российской Федерации», с которым выступила Наталья Бунятян — заместитель генерального директора по научной работе Федерального государственного учреждения «Научный центр экспертизы средств медицинского применения» (ФГУ «НЦЭСМП») Росздравнадзора, доктор фармацевтических наук, профессор. Контроль и надзор — это важнейший инструмент обеспечения модернизации здравоохранения и социальной сферы (Тельнова Е.А., 2010). Сегодня грядут серьезные изменения в российской фармацевтической отрасли, и прежде всего, в сфере лекарственного обеспечения. 31 марта 2010 г. Совет Федерации одобрил проект федерального закона «Об обращении лекарственных средств»: после подписания законопроекта президентом документ должен вступить в силу с 1 сентября 2010 г. Докладчик привела три базовых определения, уже нашедшие отражение в законопроекте:
В этом контексте немалый интерес слушателей вызвал доклад на тему «Состояние и перспективы обеспечения качества эффективности и безопасности лекарственных средств на территории Российской Федерации», с которым выступила Наталья Бунятян — заместитель генерального директора по научной работе Федерального государственного учреждения «Научный центр экспертизы средств медицинского применения» (ФГУ «НЦЭСМП») Росздравнадзора, доктор фармацевтических наук, профессор. Контроль и надзор — это важнейший инструмент обеспечения модернизации здравоохранения и социальной сферы (Тельнова Е.А., 2010). Сегодня грядут серьезные изменения в российской фармацевтической отрасли, и прежде всего, в сфере лекарственного обеспечения. 31 марта 2010 г. Совет Федерации одобрил проект федерального закона «Об обращении лекарственных средств»: после подписания законопроекта президентом документ должен вступить в силу с 1 сентября 2010 г. Докладчик привела три базовых определения, уже нашедшие отражение в законопроекте:
- качество ЛС — соответствие ЛС требованиям федерального закона либо другой нормативной документации;
- безопасность ЛС — характеристика ЛС, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью;
- эффективность ЛС — характеристика степени положительного влияния лекарства на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности.
Согласно данным Росздравнадзора, по состоянию на 01.01.2010 г. в РФ всего зарегистрировано 18 635 наименований готовых ЛС, из них:
- отечественного производства — 12 871 (69%),
- зарубежного производства — 5764 (31%),
- оригинальных ЛС — 1383 (7,4%),
- генерических препаратов — 17 252 (92,6%).
Структура современного фармацевтического рынка РФ ощутимо отличается от рынков развитых стран в сторону преобладания брэндированных генериков — ЛС, у которых субстанция вышла из-под патентной защиты, но активно продвигаются торговые наименования. В результате (с учетом того, что в России установлен самый длительный срок патентной защиты из всех возможных — 20 лет) на практике потребитель зачастую переплачивает за морально устаревшие препараты под все новыми торговыми названиями. Сложившаяся система продвижения ЛС стимулирует производителей вкладывать большие средства прежде всего в маркетинг и рекламу, а не в разработку новых эффективных и современных препаратов (по высказыванию известного американского хирурга Уилла Роджерса, «если бы рекламодатели тратили на улучшение своей продукции те деньги, которые они тратят на рекламу, их продукция не нуждалась бы в рекламе»). При этом, реклама рецептурных препаратов для потребителя запрещена законодательством, однако существует более 1,5 тыс. отпускаемых без рецепта врача: по этому поводу (стоит ли предоставлять столь значительный ассортимент лекарств в руки провизора, а иногда, увы, и фармацевта вне врачебного контроля приема этих ЛС) перед руководителями отрасли также стоит серьезный вопрос. Значительное количество импортной продукции на фармацевтическом рынке и подавляющее превалирование его генерического сектора — это стратегические проблемы страны: ее легко обезоружить в контексте лекарственной независимости. Эти факты не свидетельствует в пользу готовности страны обеспечить полноценную защиту самого дорого богатства государства — здоровья каждого члена общества путем предоставления безопасной и эффективной фармакотерапии,— и в то же время не зависеть от зарубежных стран.
Докладчик вспомнила метафору корифея отечественной фармакологии М.Д. Машковского (1908–2002), высказанную им в одном из своих последних в жизни докладов в рамках конгресса «Человек и лекарство» (2002 г.): «Сегодня мы живем в джунглях лекарств». Ведь фармацевтическая промышленность Советского Союза практически полностью обеспечивала своих граждан собственными ЛС. И сегодня, чтобы вернуть ситуацию на круги своя (на что нацелена принятая правительством Стратегия), многое приходится начинать с нуля. Ныне Россия во многом зависит не только от импортных препаратов, но и АФИ: их объем производства в РФ сократился более чем в 20 раз. Если ранее большинство АФИ производилось в СССР (еще в 1992 г. в России производилось 272 наименования АФИ, удовлетворявших потребности производства готовых препаратов: в разных группах от 70 до 100%); значительная часть субстанций экспортировалась в страны СЭВ, — то с начала 1990-х годов около 90% из них — импортного производства, причем до 70% из них поставляется из Китая и Индии. В итоге многие отечественные предприятия превратились в фасовочные фабрики, выпускающие однотипную, устаревшую за десятилетия продукцию, зачастую с низкой рыночной стоимостью. Согласно Стратегии, стимулирование организации производства субстанций необходимо для обеспечения выпуска хотя бы половины препаратов готовых лекарственных форм (включая не менее 85% номенклатуры перечня ЖНВЛС), — в целом же, согласно долгосрочным целям, объем российского фармацевтического рынка к 2020 г. достигнет 1,5 трлн руб.
Согласно действующему законодательству все фармпредприятия России должны перейти на международные стандарты GMP к 1 января 2014 г. В течение ближайшего времени правительство РФ намерено утвердить правила GMP и сроки вступления в силу конкретных требований данных правил, включая условия аттестации уполномоченных лиц. Сроки принятия этих документов синхронизированы со сроком вступления в силу закона об обращении ЛС (1 сентября 2010 г.). При этом, по мнению руководства Минздравсоцразвития РФ, при переходе на международные стандарты GMP не следует ставить во главу угла поддержку отечественного фармпроизводителя: такой традиционный приоритет, как поддержка отечественного производства, не может быть доминирующим в силу его значительной размытости. Напротив, избраны приоритеты, которые отвечают интересам пациента и нацелены на оказание надлежащей медицинской помощи: повышение качества лекарств с достоверной оценкой их качества и безопасности. Достичь этого возможно, если обеспечить стандартность процессов производства, при котором продукт производится с одинаковыми показателями качества от серии к серии.
По информации Росздравнадзора, около 10% российских фармпредприятий уже перешли на стандарты GMP, 40% имеют отдельные цеха, работающие по системе GMP, 50% даже не начинали перехода на стандарты GMP. При этом до конца 2010 г. в каждом федеральном округе откроются современные лаборатории по контролю качества ЛС. В настоящее время такая лаборатория уже работает в Гудермесе; в июне откроется лаборатория в Хабаровске, в июле — в Ростове-на-Дону. По данным на 1 апреля 2010 г., в РФ производят ЛС 460 предприятий. Больше всего таких производств в Центральном федеральном округе, а также Приволжском и Северо-Западном федеральном округах. Из 460 предприятий 63 имеют государственную форму собственности. По данным Госкомстата РФ, объем производства фармпредприятий в РФ за 2009 г. составил 95,6 млрд руб. (в 2008 г. — 74,8 млрд руб), что свидетельствует о высоких темпах роста объема российских фармпроизводств.
Обеспечение эффективности и безопасности ЛС достигается путем оценки качества на всех этапах его жизненного цикла. Основная роль в оценке качества, эффективности и безопасности лекарства отводится АФИ (химическая модификация, размер частиц, форма кристаллов, полиморфизм и т.д.). Мониторинг качества ЛС нацелен на предотвращение попадания и своевременное изъятие из обращения фальсифицированных и недоброкачественных препаратов с учетом информационной базы данных Росздравнадзора (табл. 1).
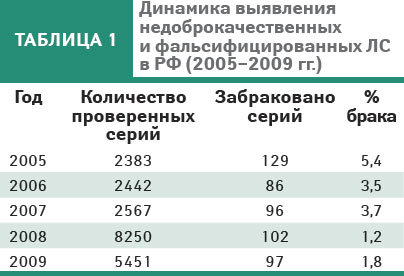 Основные принципы концепции государственного контроля качества, эффективности и безопасности ЛС были представлены и получили поддержку на заседании правительства РФ в июне 2008 г. (Курск). Основополагающим документом в проведении контроля качества ЛС является Государственная Фармакопея (ГФ):
Основные принципы концепции государственного контроля качества, эффективности и безопасности ЛС были представлены и получили поддержку на заседании правительства РФ в июне 2008 г. (Курск). Основополагающим документом в проведении контроля качества ЛС является Государственная Фармакопея (ГФ):
- в 2007 г. издана первая часть ГФ XII издания, гармонизированная с требованиями Европейской Фармакопеи и посвященная описанию методов анализа ЛС;
- в 2009 г. подготовлены и представлены для утверждения в Росздравнадзор 2-я и 3-я части ГФ ХII издания.
Система государственного контроля за качеством, эффективностью и безопасностью ЛС включает:
- фармацевтическую экспертизу — экспертиза качества ЛС на этапе регистрации;
- предварительный государственный контроль — подтверждение соответствия качества ЛС на этапе запуска в промышленное производство или перед началом импорта в РФ;
- выборочный и повторный выборочный государственный контроль — экспертиза качества ЛС на этапе обращения;
- фармаконадзор — выявление, оценка и предупреждение побочных реакций (ПР) или других возможных проблем, связанных с фармакотерапией.
В число экспертных организаций, осуществляющих государственный контроль на территории РФ входят: 84 испытательных лабораторий, аккредитованных на техническую компетентность и независимость; 22 испытательные лаборатории коммерческих и ведомственных организаций; 50 центров контроля качества субъектов РФ; 2 ФГУ Росздравнадзора и 10 филиалов ФГУ. В октябре 2007 г. на базе ФГУ «НЦЭСМП» Росздравнадзора создан Федеральный центр мониторинга безопасности лекарственных средств, которому делегированы полномочия по проведению мониторинга безопасности ЛС и экспертной оценки фактов и обстоятельств, угрожающих жизни и здоровью людей (табл. 2).
 Система основана на государственном контроле за обращением ЛС, в первую очередь, за счет создания в каждом федеральном округе лабораторий, находящихся в ведении Росздравнадзора. Подобная сеть официальных лабораторий качества медицинской продукции — Official Medicines Control Laboratories (OMCL) — основана в 1994 г. Европейским директоратом по контролю качества медицинских средств (European Directorate for the Quality of Medicines) Совета Европы. Создание региональной сети экспертных лабораторий в федеральных округах РФ по типу OMCL позволит минимизировать попадание на рынок ЛС контрафактной и недоброкачественной продукции, что положительно скажется на системе контроля качества находящихся в обращении препаратов.
Система основана на государственном контроле за обращением ЛС, в первую очередь, за счет создания в каждом федеральном округе лабораторий, находящихся в ведении Росздравнадзора. Подобная сеть официальных лабораторий качества медицинской продукции — Official Medicines Control Laboratories (OMCL) — основана в 1994 г. Европейским директоратом по контролю качества медицинских средств (European Directorate for the Quality of Medicines) Совета Европы. Создание региональной сети экспертных лабораторий в федеральных округах РФ по типу OMCL позволит минимизировать попадание на рынок ЛС контрафактной и недоброкачественной продукции, что положительно скажется на системе контроля качества находящихся в обращении препаратов.
Многие шаги на этом пути уже сделаны. Так, в 2009 г. Росздравнадзором завершен пилотный проект по внедрению метода спектрометрии в ближнем инфракрасном диапазоне (БИК-метода) в качестве неразрушающего экспресс-метода контроля и мониторинга качества ЛС; оборудованы 3 передвижные экспресс-лаборатории. Создана библиотека БИК-спектров, включающая 3300 спектров 127 наименований ЛС (к середине текущего года планируется расширить банк спектров до 600 наименований). Проведен скрининг качества ЛС в аптеках Москвы, Чеченской Республики, Ставропольского края — дальнейшая работа передвижных экспресс-лабораторий планируется во всех федеральных округах РФ с началом ввода в действие лабораторных комплексов.
_____________________
*Продолжение. Начало (часть 1) см.: «Еженедельник АПТЕКА» № 16 (737) от 26 апреля 2010 г.
**По состоянию на январь 2010 г. действует Перечень ЖНВЛС, утвержденный распоряжением Правительства РФ от 30.12.2009 г. № 2135-р. Данный Перечень сформирован с использованием международной Анатомо-терапевтической и химической классификационной системы ВОЗ (Anatomical Therapeutic Chemical (АТС) classification system) и включает 500 позиций ЛС под международными непатентованными наименованиями.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим