 25 листопада 2016 р. під егідою Європейської Бізнес Асоціації (ЄБА) відбувся одноденний семінар-практикум для дослідників та лікарів щодо організації та проведення клінічних досліджень в Україні. Захід охопив теоретичні основи та практичні аспекти організації та проведення клінічних досліджень і відбувся за участю понад 200 учасників зі всієї України, включаючи представників державних органів влади, практикуючих дослідників, лікарів, юристів, представників компаній-спонсорів, контрактно-дослідницьких організацій та логістичних партнерів. Спонсорами заходу виступили компанії, що входять до Підкомітету з клінічних досліджень ЄБА — компанії Pfizer, PSI та SMO Group.
25 листопада 2016 р. під егідою Європейської Бізнес Асоціації (ЄБА) відбувся одноденний семінар-практикум для дослідників та лікарів щодо організації та проведення клінічних досліджень в Україні. Захід охопив теоретичні основи та практичні аспекти організації та проведення клінічних досліджень і відбувся за участю понад 200 учасників зі всієї України, включаючи представників державних органів влади, практикуючих дослідників, лікарів, юристів, представників компаній-спонсорів, контрактно-дослідницьких організацій та логістичних партнерів. Спонсорами заходу виступили компанії, що входять до Підкомітету з клінічних досліджень ЄБА — компанії Pfizer, PSI та SMO Group.Відкрив семінар з вітальною промовою Олексій Міхеєв, новообраний голова Підкомітету з клінічних досліджень ЄБА.
Захід складався з 2 частин: теоретичної та практичної. У рамках першої частини «Як створити та розвинути дослідницький центр?» учасники ознайомилися з особливостями початкового етапу організації клінічних досліджень, юридичними вимогами та досвідом провідних дослідників у створенні та розвитку дослідницького центру.
Відкрила семінар Людмила Ковтун, заступник директора з клінічних питань Державного експертного центру МОЗ України, доповіддю на тему «Стан клінічних досліджень в Україні». Доповідач підкреслила критичну важливість знання нормативно-правової бази щодо проведення клінічних досліджень, як вітчизняної, так і міжнародної, наголосила на необхідності дотримання належної клінічної практики (Good Clinical Practice — GCP) з урахуванням останніх доповнень та нововведень. Окрім цього, звернула увагу на основні практичні принципи та вимоги до проведення клінічних досліджень в Україні.
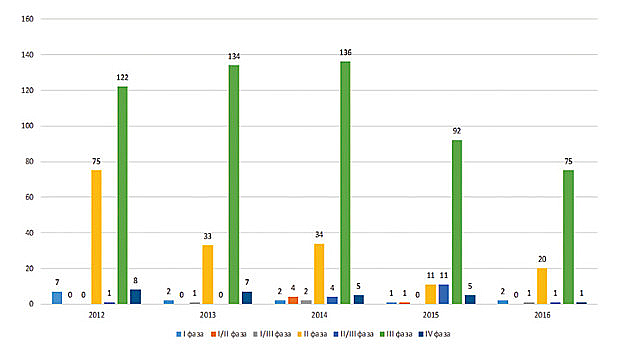
Л. Ковтун зауважила, що, як і зазвичай, найбільше досліджень припадає на ІІІ фазу. Хоча у 2016 р. майже вдвічі зросла кількість досліджень ІІ фази — з 11 (у 2015 р.) до 20 за ІІІ кв. 2016 р. (див. рисунок).
Сергій Распутняк, начальник відділу клінічного аудиту Департаменту експертизи матеріалів доклінічних та клінічних випробувань Державного експертного центру МОЗ України, продовжив семінар доповіддю на тему «Вимоги до дослідницького сайту. Основні аспекти клінічного аудиту сайту», у якій розкрив сутність та особливості клінічного аудиту, охарактеризував усі вимоги до дослідників та лікувально-профілактичних закладів. Наприклад, основні з них: мати достатню професійну підготовку, досвід лікування пацієнтів відповідного профілю, бути обізнаними з вимогами GCP, працювати в лікувально-профілактичному закладі, де планується проведення клінічних випробувань.
Борис Даневич, партнер юридичної фірми Marchenko Danevych, у доповіді «Очікування спонсора та CRO. Юридичні аспекти розвитку сайту» окреслив основні підходи, якими варто керуватися дослідникам та головним лікарям у своїй діяльності, особливо що стосується процесу укладання контрактів з лікувально-профілактичними закладами/дослідниками, особливостями розрахунків, їх документального оформлення, стабільності та прозорості в очікуваннях спонсора та CRO.

Про історію відкриття одного сайту та про те, з чого все починалося, розповів Ігор Бондаренко, завідувач кафедри онкології Дніпропетровської медичної академії, провідний дослідник. У своїй доповіді «Клінічні випробування. З любителів у професіонали» пан Ігор поділився досвідом створення веб-сайту http://www.sitetv.net та розкрив секрети успіху дослідницького центру, у якому працює.
Світлана Мороз, завідуюча психоневрологічним відділенням Дніпропетровської обласної клінічної лікарні ім. І.І. Мечникова, презентувала доповідь на тему «Контроль якості роботи дослідницького центру», основними аспектами якої були: характеристика рівнів контролю якості роботи дослідницького центру, функціональні обов’язки членів центру на різних рівнях та схеми взаємодії учасників щодо взаємного контролю.
Ірина Андреєва, регіональний менеджер клінічних досліджень Pfizer Ukraine, зупинилася на особливостях нагляду спонсора за проведенням клінічного випробування в дослідницькому центрі та пріоритетності розвитку довгострокового партнерства. Вона зосередила увагу учасників на тому, що відповідно до нових положень Керівництва з належної клінічної практики (ICH GCP Guideline Addendum E6R2) саме спонсор впроваджує систему управління якістю під час планування, проведення, спостереження, оцінки, звітності та архівування даних клінічних досліджень.
Питанню вибору місця проведення клінічного дослідження (сайту) було присвячено виступ Сергія Михайлова, директора з клінічних досліджень MSD Ukraine. Спікер зазначив, що у процесі вибору сайту має місце висока конкуренція між країнами, сайтами та дослідниками як на міжнародній арені, так і в межах України.
Незважаючи на те що в Україні налічується більше 550 місць для проведення досліджень (за даними Державного експертного центру МОЗ України), лише близько 150–170 з них регулярно залучаються до нових досліджень (за даними компаній-спонсорів). Це вказує на наявність великого потенціалу для збільшення кількості досліджень та залучення пацієнтів, а також на необхідність докладання додаткових зусиль і здійснення роботи з боку керівництва більшості сайтів та дослідників задля успішної конкуренції.
Аліса Лапіна, провідний спеціаліст клінічних досліджень PSI-Ukraine, та Дмитро Семенюта, директор департаменту клінічного менеджменту PPD-Ukraine, презентували доповідь на тему «Сайт очима CRO. Практичні аспекти співпраці». Спікери наголосили на важливості належної підготовки дослідницької команди, чіткого менеджменту та розподілу обов’язків і необхідності її постійного вдосконалення. Також вони охарактеризували сучасні підходи та майбутні виклики в тенденціях розвитку сайтів з погляду CRO. Наприклад, прогнозується, що до 2020 р. близько 72% усіх досліджень будуть реалізовуватися аутсорсинговими (контрактними) компаніями порівняно з 23% станом на 2012 р.
Завершили першу частину семінару-практикуму Віта Носуленко, менеджер з бізнес-розвитку, та Олександр Дєгтярьов, начальник відділу юридичної та кадрової роботи S.M.O.-Ukraine Agency, які виступили з доповіддю «Практичні аспекти співпраці та взаємодії логістичного провайдера та сайту». Доповідачі відзначили вагому роль логістичного партнера в клінічних дослідженнях, назвали ключові етапи участі та взаємодії логістичного провайдера, а саме: імпорт/експорт лікарських засобів, здійснення закупівлі зареєстрованих лікарських засобів та супутніх матеріалів у якості допоміжної чи супутньої терапії, зберігання відповідно до температурного режиму, додаткове маркування препаратів, документальний супровід. Також дали практичні рекомендації для успішної співпраці з командою дослідника.
Частину 2 «Практикум: Основи комунікації із представниками правоохоронних органів: реагування на запити, виклики, допити» було присвячено ефективній комунікації з представниками правоохоронних органів, наданню практичних рекомендацій та юридичних коментарів із цієї теми.
Катерина Гупало, партнер, адвокат AO Arzinger, та Катерина Шапран, адвокат AO Arzinger, презентували головні аспекти, які виникають під час комунікації з представниками правоохоронних органів щодо клінічних досліджень, зокрема порекомендували, як реагувати на запити таких органів, чи є запитувана інформація та документи конфіденційними та якої реакції органів слід очікувати у випадку відмови в наданні інформації/документів. Спікери дали ґрунтовні відповіді щодо порядку здійснення виклику у кримінальному провадженні та представили «золоті правила» поведінки під час допиту. Учасники семінару-практикуму мали можливість поставити питання щодо власної практики та отримати детальний аналіз ситуації з юридичної точки зору.
Слід зазначити, що такий семінар-практикум проводився вперше та був відкритим для практикуючих дослідників та лікарів з усіх регіонів України. Учасники висловили вдячність та наголосили на доцільності періодичного проведення подібних заходів, а також їх організації в разі можливості в інших регіонах України.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим