 Компанія IRIS-Soft, український розробник програмного забезпечення для eCTD, фармаконагляду та систем управління якістю, з початку перехідного періоду забезпечує підтримку заявників у підготовці реєстраційних досьє у новому форматі. Наші партнери вже використовують систему eCTD-RIMS для подання матеріалів у Державний експертний центр (ДЕЦ) МОЗ України, а ми надаємо їм технічну і методичну допомогу. У статті ми ділимося практичним досвідом, відповідаємо на найбільш поширені запитання та запрошуємо колег 26 вересня 2025 р. на безкоштовне онлайн-навчання, присвячене роботі з eCTD.
Компанія IRIS-Soft, український розробник програмного забезпечення для eCTD, фармаконагляду та систем управління якістю, з початку перехідного періоду забезпечує підтримку заявників у підготовці реєстраційних досьє у новому форматі. Наші партнери вже використовують систему eCTD-RIMS для подання матеріалів у Державний експертний центр (ДЕЦ) МОЗ України, а ми надаємо їм технічну і методичну допомогу. У статті ми ділимося практичним досвідом, відповідаємо на найбільш поширені запитання та запрошуємо колег 26 вересня 2025 р. на безкоштовне онлайн-навчання, присвячене роботі з eCTD. Перехід на електронний формат означає не лише виконання нових вимог, але й значне прискорення та підвищення ефективності роботи регуляторних відділів фармацевтичних компаній. Більше не потрібно готувати титульні сторінки та зміст, друкувати та копіювати багатотомні папки, підписувати й завіряти документи вручну, нумерувати сторінки, готувати «боковушки» та витрачати час на особисте відвідувати ДЕЦ для подання досьє та відповідей на зауваження. Усі ці процеси тепер переведені в «цифру»: досьє формується у програмі, підписується електронно-цифровим підписом, перевіряється за допомогою валідатора та подається через завантаження архівного файлу в кабінеті заявника. Це забезпечує дистанційність роботи, спрощує контроль версій, дає можливість швидкого пошуку за ключовими словами, автоматичного формування деяких частин досьє та його оформлення.
Перехід на електронний формат означає не лише виконання нових вимог, але й значне прискорення та підвищення ефективності роботи регуляторних відділів фармацевтичних компаній. Більше не потрібно готувати титульні сторінки та зміст, друкувати та копіювати багатотомні папки, підписувати й завіряти документи вручну, нумерувати сторінки, готувати «боковушки» та витрачати час на особисте відвідувати ДЕЦ для подання досьє та відповідей на зауваження. Усі ці процеси тепер переведені в «цифру»: досьє формується у програмі, підписується електронно-цифровим підписом, перевіряється за допомогою валідатора та подається через завантаження архівного файлу в кабінеті заявника. Це забезпечує дистанційність роботи, спрощує контроль версій, дає можливість швидкого пошуку за ключовими словами, автоматичного формування деяких частин досьє та його оформлення.
За нашими оцінками, перехід на eCTD дозволить щороку економити 3–7 міс роботи кожного менеджера з реєстрації. Це означає, що значна частина рутинних процесів буде усунена, а фахівці зможуть зосередитися на суттєвих регуляторних питаннях, підвищуючи якість та швидкість роботи.
Для ефективного використання eCTD потрібні не лише базові теоретичні знання, а й відповідне програмне забезпечення та практичні навички. Основою нового формату залишається добре знайома реєстраторам структура CTD, затверджена наказом МОЗ України від 26.08.2005 р. № 426, яка загалом не змінилася. Водночас до неї додано нові атрибути та технічні вимоги, переважно у Модулі 1. Вони визначені наказом МОЗ України від 23 квітня 2024 р. № 691 із подальшими змінами. Окрім того, в Європі, де eCTD запроваджено з 2003 р., накопичено значний досвід і напрацьовано , частина з яких буде використана і в Україні. Україна наближає вимоги до європейських, але європейське реєстраційне досьє не може бути подане в Україні «як є» та потребує локалізації та доопрацювання.
Життєвий цикл реєстраційного досьє в eCTD в будь-який країні починається з універсального унікального ідентифікатора (UUID). Для роботи з реєстраційним досьє в Україні потрібно згенерувати новий UUID. Він закріплюється за конкретним досьє на лікарський засіб і використовується протягом його життєвого циклу для всіх подальших подань: для змін, перереєстрації чи відповідей на зауваження.
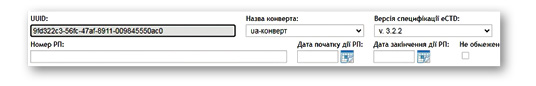
Перше подання досьє у форматі eCTD в Україні починається з послідовності (sequence) «0000», незалежно від того, з якої процедури відбувається подача — з нової реєстрації, перереєстрації, змін або базового подання. Система eCTD-RIMS від IRIS-Soft має вбудований генератор UUID, який автоматично генерує новий ідентифікатор UUID для послідовності «0000», а також дозволяє імпортувати вже існуючий ідентифікатор, що забезпечує безперервність життєвого циклу, наприклад у разі зміни заявника.
Кожна наступна подача матеріалів збільшує номер послідовності на одиницю: відповідь на перші зауваження матиме послідовність «0001», на другі — «0002» і так далі. Якщо лікарський засіб уже зареєстрований в одній країні (наприклад в ЄС) та має регуляторну історію, то при реєстрації в іншій країні нумерація послідовностей не збігатиметься — тому відстеження послідовностей здійснюється окремо для кожного ринку. Наприклад, одна й та сама зміна може мати послідовність «0045» у Німеччині та «0004» в Україні.
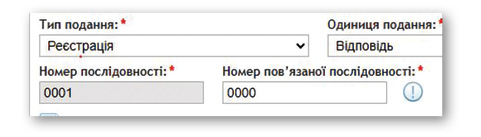
Усі подання формують історію змін досьє, яка відображається у вигляді таблиці відстеження (tracking table). Вона є додатком до супровідного листа і містить короткий опис кожної подачі та відповідні номери послідовностей. Така таблиця є інструментом прозорого контролю за всіма регуляторними діями щодо досьє.
Для підготовки реєстраційного досьє у форматі eCTD необхідно використовувати спеціальне програмне забезпечення, яке стає основним інструментом у роботі спеціаліста з реєстрації, тому воно має бути зручним, адаптованим до українських вимог, а його розробник повинен забезпечувати навчання та технічну підтримку користувачів, бажано українською мовою.
Досьє складається з файлів у форматі pdf, кожен із яких відповідає певному розділу. У межах одного розділу може бути кілька документів, наприклад у розділі 3.2.S можуть міститися матеріали від різних виробників активних фармацевтичних інгредієнтів (АФІ). Усі PDF-файли, окрім деяких адміністративних документів Модуля 1, мають бути оптимізовані за розміром і розпізнані (OCR) для можливості текстового пошуку.

Методи контролю якості, інструкція для медичного застосування, маркування та план управління ризиками разом із змінами до них, подаються у складі eCTD-документа у форматі pdf, а також у форматі .docx в окремій папці «Робочі документи».
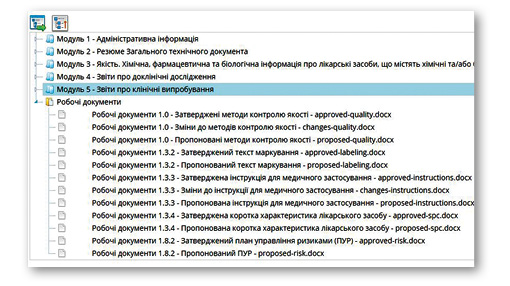
Разом із досьє обов’язково подається супровідний лист, який містить опис регуляторної дії, пов’язані послідовності, таблицю відстеження, згадану вище, перелік документів та інформацію про кількість файлів у поданні.
Адміністративні документи розділів 1.0 та 1.2 (супровідний лист, гарантійні листи, додатки 29 і 30, реєстраційна форма з додатками, CoPP, ліцензії, підтвердження відповідності вимогам належної виробничої практики (GMP) та інші) повинні бути підписані кваліфікованим електронним підписом (КЕП) із використанням ключів акредитованих центрів сертифікації відповідно до законодавства України. Такі підписи накладаються на pdf-файли за стандартом PAdES, що дозволяє зберегти їхню структуру та уникнути змін у вмісті. У системи eCTD-RIMS інтегровані бібліотеки накладання електронних підписів, які зручні у використанні та дозволяють підписати документи безпосередньо в системі.
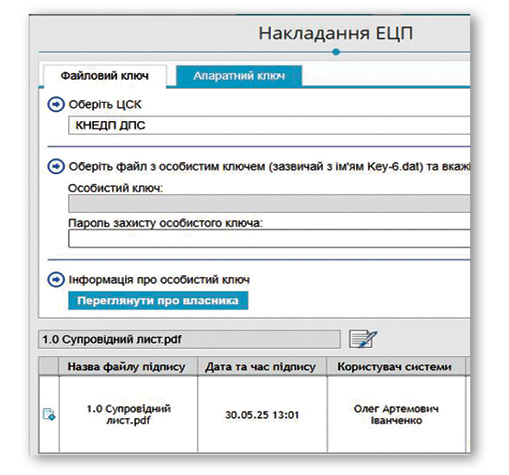
Перед фіналізацією досьє обов’язковим етапом є валідація (validation), тобто перевірка відповідності файлів технічним вимогам. Вона проводиться у самій системі eCTD-RIMS та охоплює правильність організації структури eCTD (модулі, підпапки, XML-backbone), відповідність форматів файлів (пошукові pdf із закладками без шифрування), наявність та коректність метаданих (назва продукту, тип процедури, номер послідовності, UUID, дані заявника), а також дотримання правил життєвого циклу з використанням атрибутів «new», «replace», «append» чи «delete». Додатково перевіряється відповідність вимогам до Модуля 1, визначених українською специфікацією.
Коли досьє сформоване, підписане та успішно пройшло валідацію у заявника, воно публікується. Публікація (publishing) — це технічний процес, під час якого формується «головний» магістральний XML-файл, усі матеріали пакуються в архів, і цей архів зберігається на комп’ютері фахівця з реєстрації. Саме він завантажується до кабінету заявника і вважається офіційною подачею в ДЕЦ МОЗ України. Після завантаження через кабінет заявника досьє у форматі eCTD проходить валідацію на боці ДЕЦ. У разі виявлення помилок матеріали не приймаються і потребують виправлення та повторного подання.
Програмне забезпечення eCTD-RIMS, розроблене IRIS-Soft, повністю відповідає вимогам Міжнародної ради з гармонізації технічних вимог до лікарських засобів для використання людиною (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use — ICH) та національній специфікації до Модуля 1, затвердженій наказом МОЗ України від 23.04.2024 р. № 691 зі змінами. Система вже використовується великою кількістю заявників для підготовки та подачі досьє в ДЕЦ МОЗ України. Крім базових функцій, необхідних для роботи з eCTD, вона включає низку додаткових можливостей, що спрощують роботу фахівця з реєстрації: генератор UUID, автоматичне перейменування файлів із кирилиці в латиницю, окрему папку для «Робочих документів», вбудоване накладання КЕП, валідатор, модуль швидкого оцифрування, репозиторій файлів. Система інтегрується з іншими рішеннями, зокрема з платформою для фармаконагляду DSBase. IRIS-Soft надає користувачам навчання та оперативну підтримку українською мовою, що є суттєвою перевагою у щоденній роботі.
за матеріалами, наданими компанією IRIS-Soft

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим