 2017 г. стал рекордным по количеству одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (U.S. Food and Drug Administration — FDA) генериков. В частности, одобрение получили 1027 генериков (рисунок), что на 214 больше, чем в 2016 г. Из них 843 были полностью одобрены и 184 получили предварительное одобрение, то есть они были одобрены с научной точки зрения, но пока не могут быть полностью одобрены из-за наличия патентов или эксклюзивности у оригинаторов.
2017 г. стал рекордным по количеству одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (U.S. Food and Drug Administration — FDA) генериков. В частности, одобрение получили 1027 генериков (рисунок), что на 214 больше, чем в 2016 г. Из них 843 были полностью одобрены и 184 получили предварительное одобрение, то есть они были одобрены с научной точки зрения, но пока не могут быть полностью одобрены из-за наличия патентов или эксклюзивности у оригинаторов.
Стоит отметить, что в 2017 г. был утвержден закон Generic Drug User Fee Amendments II (GDUFA II), которым разрешен непрерывный сбор платежей с производителей генериков. Предыдущий закон — GDUFA I, вступивший в силу в 2012 г., позволил нанять дополнительный персонал для Управления генерических препаратов (Office of Generic Drugs — OGD), поэтому с 2012 по 2017 г. FDA имело дополнительные ресурсы, чтобы одобрить рекордное количество генериков. Введение в действие GDUFA II поспособствует дальнейшему прогрессу в сфере выведения на рынок генериков, включая комплексные лекарственные средства, такие как некоторые ингаляционные или инъекционные препараты.
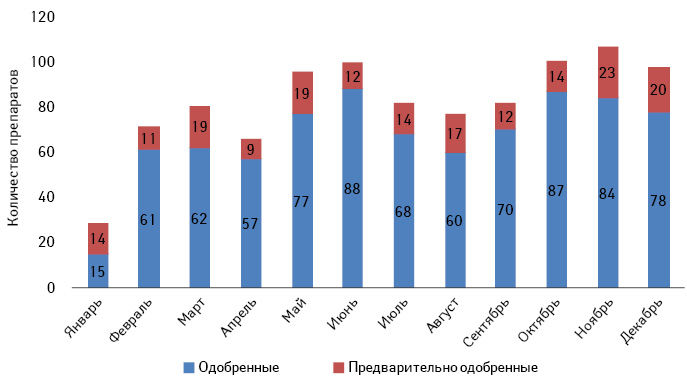
На одобренные FDA генерики приходится 89% выписанных в США рецептов. За последнее десятилетие такие генерики сэкономили пациентам более 1,67 трлн дол. Количество одобренных генериков продолжает расти от года к году, однако впервые превысило отметку в 1000 препаратов.
В 2017 г. было одобрено 80 генериков, которые стали первыми генерическими лекарственными средствами, альтернативными оригинаторам. Выход на рынок первых генериков стимулирует экономическую конкуренцию, которая помогает снизить расходы на рецептурные лекарственные средства. Снижение стоимости лекарств является приоритетом общественного здравоохранения, поэтому FDA ускоряет обзор первых генерических препаратов, чтобы «открыть» рынок для конкуренции оригинаторов и генериков. Наличие на рынке нескольких генериков одного и того же оригинатора приводит к еще более высокой конкуренции, что, в свою очередь, позволяет снизить расходы на рецептурные препараты. В 2017 г. FDA пересмотрело свою политику, чтобы определить приоритетность проведения обзора генериков вплоть до третьего такого препарата для одного и того же оригинатора, поскольку это помогает максимально экономить средства на приобретении рецептурных препаратов.
Другая инициатива FDA, призванная способствовать развитию конкуренции на рынке, сфокусирована на комплексных препаратах. Специалисты в сфере здравоохранения используют комплексные лекарственные средства для лечения широкого спектра заболеваний, от заместительной гормональной терапии для женщин в период постменопаузы до лечения сахарного диабета II типа. В 2017 г. OGD предоставил рекомендации для промышленности по разработке следующих продуктов: тиотропиум бромид в форме порошка для ингаляций (применяется для лечения хронической обструктивной болезни легких), эпинефрин в шприц-ручке (применяется для экстренного лечения анафилаксии).

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим