 Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 7 июня выдало разрешение на маркетинг первого медицинского устройства, уменьшающего выраженность боли в животе у пациентов в возрасте 11–18 лет с синдромом раздраженного кишечника (СРК) в сочетании с другими методами лечения СРК. Аналогичные версии этого устройства компании Innovative Health Solutions для других целей были одобрены FDA ранее. Так, NSS-2 BRIDGE был разрешен для маркетинга в 2017 г. в качестве вспомогательного средства для уменьшения выраженности симптомов отмены опиоидов, а самое первое электроаурикулярное устройство (Electro Auricular Device) компании Navigant Consulting было одобрено FDA в 2014 г. для использования в акупунктуре.
Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 7 июня выдало разрешение на маркетинг первого медицинского устройства, уменьшающего выраженность боли в животе у пациентов в возрасте 11–18 лет с синдромом раздраженного кишечника (СРК) в сочетании с другими методами лечения СРК. Аналогичные версии этого устройства компании Innovative Health Solutions для других целей были одобрены FDA ранее. Так, NSS-2 BRIDGE был разрешен для маркетинга в 2017 г. в качестве вспомогательного средства для уменьшения выраженности симптомов отмены опиоидов, а самое первое электроаурикулярное устройство (Electro Auricular Device) компании Navigant Consulting было одобрено FDA в 2014 г. для использования в акупунктуре.
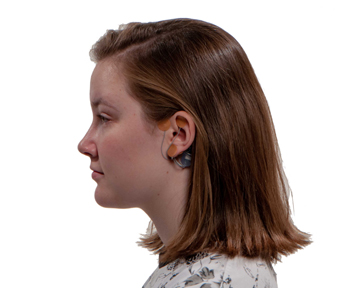
IB-Stim – устройство, отпускаемое только по рецепту, состоит из небольшого одноразового электрического стимулятора нерва, располагаемого за ухом пациента. Оно содержит чип на батарейках, излучающий низкочастотные электрические импульсы для непрерывной стимуляции ветвей определенных черепных нервов в течение 5 дней, с последующей заменой. Считается, что стимуляция нервных окончаний ушной раковины и соседних участков обеспечивает уменьшение выраженности боли. Пациенты могут использовать устройство до 3 нед подряд, чтобы уменьшить функциональную боль в животе, связанную с СРК.
СРК – это группа одновременно возникающих симптомов, включающая повторяющуюся боль в животе и изменения перистальтики кишечника, проявляющиеся поносом, запором или и тем, и другим. При СРК симптомы могут проявляться без каких-либо видимых признаков повреждения или заболевания пищеварительного тракта.
FDA рассмотрело данные опубликованного клинического исследования, в которое вошли 50 пациентов в возрасте 11−18 лет с СРК: 27 пациентов проходили лечение с помощью устройства, а 23 — получали плацебо, не прекращая своего обычного лечения для уменьшения болевых ощущений. Лечение IB-Stim привело к уменьшению выраженности боли по меньшей мере на 30% по истечению 3 нед у 52% пациентов по сравнению с 30% среди получавших плацебо. Выраженность самых сильных болевых ощущений уменьшилась по крайней мере на 30% у 59% пролеченных пациентов по сравнению с 26% среди получавших плацебо. Во время исследования 6 пациентов сообщили о легком дискомфорте в ухе, а 3 пациента — о контактной аллергии в месте использования.
Устройство противопоказано пациентам с гемофилией, псориазом и носящим кардиостимуляторы.
FDA рассмотрело IB-Stim, используя предварительный анализ рынка de novo, – регуляторный путь для устройств с низким и умеренным риском нового типа. В результате появился новый раздел нормативной классификации, благодаря которому последующие устройства того же типа с таким же предполагаемым использованием могут пройти процедуру FDA 510 (k), посредством чего могут получить разрешение на маркетинг, продемонстрировав существенную эквивалентность устройству-предикату.
По материалам www.accessdata.fda.gov; i-h-s.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим