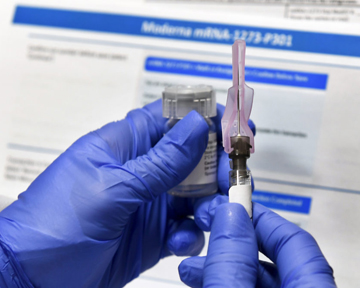
 Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 18 декабря выдало компании «ModernaTX, Inc.» разрешение на использование в чрезвычайной ситуации (emergency use authorization — EUA) второй вакцины для профилактики COVID-19 у лиц в возрасте 18 лет и старше.
Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 18 декабря выдало компании «ModernaTX, Inc.» разрешение на использование в чрезвычайной ситуации (emergency use authorization — EUA) второй вакцины для профилактики COVID-19 у лиц в возрасте 18 лет и старше.
Вакцину для профилактики COVID-19 компании «Moderna» вводят сериями из 2 доз с интервалом в 1 мес. Доступные данные о безопасности для поддержки EUA включают анализ данных 30 351 участника, включенного в текущее рандомизированное плацебо-контролируемое исследование, проводимое в США. Этих участников, 15 185 из которых получили вакцину, а 15 166 — плацебо, наблюдали в течение периода с медианой более 2 мес после приема второй дозы. Наиболее частыми побочными эффектами, которые обычно длились несколько дней, были боль в месте инъекции, усталость, головная, мышечная боль, озноб, боль в суставах, увеличение лимфатических узлов на стороне введения, тошнота и рвота, а также лихорадка. После приема второй дозы этих побочных эффектов было больше, чем после первой.
Противопоказанием к вакцинации являются известные аллергические реакции (анафилаксия) на компоненты вакцины. Предупреждают также, что у лиц с ослабленным иммунитетом, включая людей, получающих иммуносупрессивную терапию, ответ на вакцину против COVID‑19 от «Moderna» может быть сниженным. В материалах компании указано ограничение эффективности препарата: вакцина «Moderna» против COVID‑19 не может защитить всех реципиентов.
По материалам fda.gov; modernatx.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим