 Европейское агентство по лекарственным средствам (European Medicines Agency — EMA) одобрило рекомендации, разработанные Международной коалицией медицинских регуляторных органов (International Coalition of Medicines Regulatory Authorities — ICMRA) для облегчения использования систем отслеживания и контроля (track and trace) на глобальном уровне. В статье, опубликованной 6 августа, определены общие технические характеристики, позволяющие различным системам обмениваться и использовать имеющуюся информацию о лекарственных средствах и цепочках их поставок в целях охраны здоровья населения.
Европейское агентство по лекарственным средствам (European Medicines Agency — EMA) одобрило рекомендации, разработанные Международной коалицией медицинских регуляторных органов (International Coalition of Medicines Regulatory Authorities — ICMRA) для облегчения использования систем отслеживания и контроля (track and trace) на глобальном уровне. В статье, опубликованной 6 августа, определены общие технические характеристики, позволяющие различным системам обмениваться и использовать имеющуюся информацию о лекарственных средствах и цепочках их поставок в целях охраны здоровья населения.
Системы контроля считаются полезным инструментом для снижения риска нехватки и борьбы с производством и маркетингом фальсифицированных лекарств. Они обеспечивают прослеживаемость цепочки поставок лекарств в любой момент времени. Однако до сих пор системы разрабатывали и внедряли с упором на местный или региональный уровни, без учета возможности обмениваться информацией с другими системами. Особое внимание в руководстве уделено единообразию подачи информации о продуктах на упаковках. Отмечено, в частности, что идентификаторы (коды) продуктов должны быть преимущественно цифровыми. Для примера приведены варианты написания слова «продукт» на разных языках (рис. 1).

Рекомендовано также использовать четыре элемента данных на основе широко распространенных в мире стандартов: глобальный уникальный код продукта и серийный номер, срок годности и номер партии/серии, что позволяет автоматизировать бизнес-процессы, требующие ввода этой информации (рис. 2).

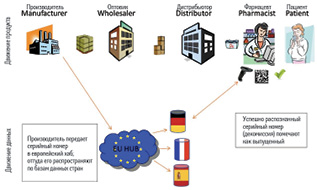
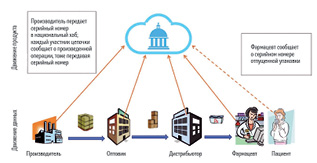
Авторы статьи описали три основных типа систем контроля: централизованная, полуцентрализованная и распределенная (Distributed). Первая из них бывает двух типов: с неполной и полной прослеживаемостью. Первый подтип используют в ЕС, при этом система получает информацию о продукте на двух этапах его жизненного цикла: при выпуске производителем и отпуске из аптеки (в том числе госпитальной) (рис. 3). Второй подтип использует загрузку серийных номеров в систему на каждом этапе обращения продукта, при этом иногда и пациент может самостоятельно произвести верификацию. Такими системами пользуются в Турции, Аргентине, Южной Корее, Саудовской Аравии и России (рис. 4).
В полуцентрализованных системах центрального хранилища данных нет, а информация о продукте передается по цепочке от одного участника к другому (Китай, США). Наконец, в распределенных информация подается по запросу, как при оформлении возвратов в США.
Международные регулирующие органы также подчеркивают, что функциональная совместимость систем контроля помогает защитить здоровье населения за счет улучшения обмена информацией в случае дефектов качества, дефицита, необходимости борьбы с фальсифицированными лекарствами и поддержки деятельности по фармаконадзору. Общее понимание этих потенциальных преимуществ функциональной совместимости является фундаментальным для содействия глобальному планированию и внедрению функционально совместимых систем.
Документ ICMRA был открыт для публичных консультаций с ноября 2020 г. по февраль 2021 г. Полученные отзывы были тщательно проанализированы с целью уточнения и окончательной доработки рекомендаций с участием Всемирной организации здравоохранения (ВОЗ), представителями международных органов регулирования лекарственных средств и экспертами из частного сектора.
По материалам www.ema.europa.eu; www.icmra.info

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим