Производитель вакцины CoronaVас — Институт Бутантан обратился в Anvisa с заявкой на включение в число разрешенных реципиентов вакцины детей, начиная с 3-летнего возраста. Соответствующий анализ рисков провели в ходе специального заседания Ученого совета (Diretoria Colegiada — Dicol) Anvisa 18 августа. На нем также рассмотрели перспективы введения бустерных доз вакцины, одобренной для использования в чрезвычайной ситуации Всемирной организацией здравоохранения (ВОЗ) и несколькими странами, включая три из шести самых густонаселенных государств мира — Бразилию, Китай и Турцию.
Профиль пользы и риска CoronaVac остается благоприятным
CoronaVac, разработанная китайской фармацевтической компанией Sinovac в партнерстве с бразильским институтом Бутантан, получила временное разрешение на использование в чрезвычайной ситуации от ANVISA 17 января. Одобрение вакцины при этом условии сохраняется до тех пор, пока длится чрезвычайная ситуация в области общественного здравоохранения, вызванная пандемией Covid-19 в Бразилии.
На заседании 17 августа Совет ANVISA пришел к выводу, что общее соотношение польза/риск вакцины CoronaVас по-прежнему благоприятно, несмотря на непредоставление институтом в установленный срок всех данных относительно иммуногенности, требуемых Агентством. Их отсутствие было частично преодолено предоставлением другой информации. Так, крайний срок для подачи результатов иммуногенности постепенно переместился с февраля на июнь, и предоставленные в таком качестве итоги исследования ІІІ фазы в Бразилии оказались не лишены недостатков: протестировано лишь небольшое количество участников, особенно в отношении нейтрализующих антител, отсутствовала валидация данных, использованы полуколичественные и качественные тесты для оценки иммунного ответа. Кроме того, анализ проведен лишь спустя небольшой срок после вакцинации, так что для заключения о длительности защиты, обеспечиваемой CoronaVac, данные об иммуногенности по-прежнему необходимы.
Подводя итоги, директор ANVISA Мейруза Фрейтас (Meiruze Freitas) отметила, что использование CoronaVас способствовало уменьшению последствий пандемии, в том числе частоты госпитализаций и летальных исходов.
Вакцинация детей и подростков CoronaVac не одобрена
Совет рассмотрел запрос о расширении использования CoronaVac в чрезвычайных ситуациях с охватом населения старше 3 лет. Соответствующий запрос об изменении возрастного диапазона показаний для вакцинации был сделан Институтом Бутантан 30 июля. Однако предоставленная информация не обеспечила возможности сделать вывод об эффективности и безопасности вакцины в этой возрастной группе, в основном из-за недостаточного количества участников.
Кроме того, неизвестны эффективность или способность к индукции иммунного ответа детей с ослабленным иммунитетом и сопутствующими заболеваниями. Неполные данные об иммуногенности оставляют также неопределенность в отношении продолжительности защиты, обеспечиваемой иммунизирующим агентом. Для расширения показаний Институт Бутантана должен собрать недостающую информацию и отправить новый запрос в Агентство.
Вакцина Pfizer — пока единственная, одобренная в Бразилии для детей в возрасте 12–18 лет. Компания Janssen получила разрешение на проведение исследований у детей до 18 лет в Бразилии.
Третьи дозы — под вопросом
Учитывая текущий сценарий развития пандемии в Бразилии, ANVISA решило рекомендовать министерству здравоохранения рассмотреть возможность введения на экспериментальной основе бустера группам населения, получившим две дозы CoronaVac, отдавая приоритет пациентам с иммунодефицитом и пожилого возраста.
Поскольку Институт Бутантан пока не предоставил оценку длительности защиты и баланса польза/риск, несмотря на истечение установленного срока (до 30 июня), Совет ограничился другими доступными данными о выраженности и продолжительности иммунного ответа и защитного эффекта.
Во-первых, данные об эффективности, на основании которых вакцина была одобрена в Бразилии, оценивают этот показатель на уровне 50,4% (95% доверительный интервал (ДИ) 35,26–61,98; р=0,0049).
Кроме того, рассмотрена эффективность вакцины после массовой иммунизации 10,2 млн человек в Чили с последующим наблюдением в течение 3 мес (Jara A. et al.). По этим данным, среди лиц, вакцинированных с февраля по май 2021 г., эффективность вакцинации оценена на уровне:
- 65,9% (95% ДИ 65,2–66,6) в отношении профилактики COVID-19;
- 87,5% (95% ДИ 86,7–88,2) — предотвращения госпитализации;
- 90,3% (95% ДИ 89,1–91,4) — госпитализации в отделения интенсивной терапии;
- 86,3% (95% ДИ 84,5–87,9) — летального исхода, связанного с COVID-19.
Эффективность по результатам двойного слепого рандомизированного плацебо-контролируемого исследования ІІІ фазы с участием 10 214 человек в возрасте 18–59 лет (набранных в период с 14 сентября 2020 г. по 5 января 2021 г. в Турции) — 83,5%, в течение среднего периода наблюдения 43 дня, сильно отличается от полученной в Бразилии (Tanriover M.D. et al., 2021). Как отмечено в презентации на заседании совета, не сообщалось об оценке корреляции титров антител с эффективностью вакцины. Также не зарегистрированы показатели иммунитета, выявленные у заболевших вакцинированных.
Что известно об изменении иммунного ответа со временем?
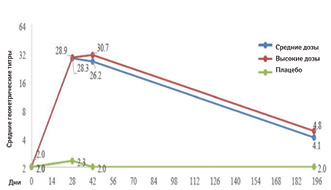
По данным, полученным у сравнительно небольшого количества участников исследований ІІ фазы, вызываемые вакцинацией титры нейтрализующих антител невысоки (таблица).
| Таблица | Данные о сероконверсии (% участников, ДИ) и титрах нейтрализующих антител в период до 6 мес после введения двух доз разной величины: высоких (1200 SU инактивированного антигена/0,5 мл) и средних (600 SU/0,5 мл) доз; в кампаниях вакцинации применяют средние дозы (доклад на совете ANVISA) |
| Момент времени | Параметр | Средние дозы (n=59) | Высокие дозы (n=58) |
| Перед вакцинацией | Сероконверсия n (%) Средние геометрические титры |
02,0 | 02,0 |
| Через 14 дней после 2-й дозы | Сероконверсия n (%) Средние геометрические титры |
53 (89,8%) 28,3 |
57 (98,3%) 28,9 |
| Через 28 дней после 2-й дозы | Сероконверсия n (%) Средние геометрические титры |
56 (95%) | 58 (100%) |
| Через 6 мес. после 2-й дозы | Сероконверсия n (%) Средние геометрические титры |
10 (17%) 4,1 |
14 (24%) 4,8 |
Титры нейтрализующих антител значительно уменьшаются к окончанию 6-го месяца наблюдения (таблица, рис. 1)
Результаты 3-дозового режима введения CoronaVac (0; 14 и 42 дня) — более обнадеживающие в отношении сохранения нейтрализующих антител (рис. 2).
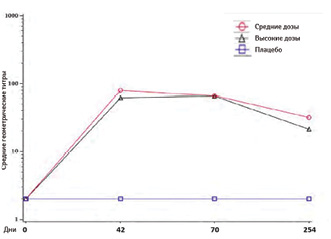
Данные об иммуногенности 3-й дозы
5–25 июля 2021 г. Sinovac опубликовала в виде препринта промежуточные результаты двойного слепого рандомизированного плацебо-контролируемого клинического исследования ІІ фазы (Pan H., 2021). Согласно его результатам, введенная через 6 мес или более после 2-й дозы вакцина CoronaVac вызвала специфический иммунный ответ в отношении SARS-CoV-2, приводящий к значительному повышению уровней антител. Это указывает на то, что схема введения двух доз генерирует хорошую иммунологическую память, позволяющую бустерной дозе быстро нарастить титры, заключили исследователи.
Исследования в особых популяциях
Вакцина вызвала хороший иммуногенный ответ у пациентов с аутоиммунными ревматическими заболеваниями, но на более низком уровне по сравнению с контрольными группами (Medeiros-Ribeiro A.C. et al., 2021).
9 июля 2021 г. Фонд Освальда Круза (Fundação Oswaldo Cruz) выпустил Техническую ноту со следующими выводами об эффективности CoronaVac в старших возрастных группах:
а) 60–79 лет — 79,6%;
б) 80 лет и старше — 68,8%.
6–8 августа 2021 г. Sinovac опубликовала еще один препринт с результатами исследования, целью которого было оценить устойчивость иммунного ответа после введения двух доз CoronaVac, а также иммуногенность и безопасность третьей дозы у здоровых взрослых в возрасте старше 60 лет (Li M. et al., 2021). Согласно полученным результатам, бустерная доза вакцины значительно усиливает иммунные ответы у лиц пожилого возраста после значительной потери антител через 6–8 мес после завершения 2-дозового режима.
Эффективность в отношении вариантов
Эффективность вакцины CoronaVac в обсервационном исследовании среди медицинских работников в Манаусе, Бразилия, у которых вариант P.1 («гамма») представлял 75% образцов SARS-CoV-2, в отношении симптоматической инфекции составляла 49,6%. Подобная эффективность также была продемонстрирована в наблюдательном исследовании, проведенном в Сан-Паулу при наличии «гамма»-варианта в 83% образцов. Эффективность оценена в 49,6% после первой дозы и 50,7% — через 2 нед после второй дозы.
Другие данные об эффективности вакцинации, а также вытекающие из них решения о введении бустерных доз, представлены в еще одной нашей публикации.
Список использованной литературы
- Jara A., Undurraga E.A., González C. et al. (2021) Effectiveness of an Inactivated SARS-CoV-2 Vaccine in Chile. NEJM. July 7. DOI: 10.1056/NEJMoa2107715
- Li M., Yang J., Wang L., et al. A booster dose is immunogenic and will be needed for older adults who have completed two doses vaccination with CoronaVac: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. medRxiv 2021.08.03.21261544; doi.org/10.1101/2021.08.03.21261544.
- Medeiros-Ribeiro A.C., Aikawa N.E., Saad C.G.S. et al. (2021). Immunogenicity and safety of the CoronaVac inactivated vaccine in patients with autoimmune rheumatic diseases: a phase 4 trial. Nat Med https://doi.org/10.1038/s41591-021-01469-5.
- Pan H., Wu Q., Zeng G. Immunogenicity and safety of a third dose, and immune persistence of CoronaVac vaccine in healthy adults aged 18–59 years: interim results from a double-blind, randomized, placebo-controlled phase 2 clinical trial. medRxiv 2021.07.23.21261026; doi: https://doi.org/10.1101/2021.07.23.21261026.
- Tanriover M.D., Doğanay H.L., Akova M., Köksal İ. et al. (2021) CoronaVac Study Group. Efficacy and safety of an inactivated whole-virion SARS-CoV-2 vaccine (CoronaVac): interim results of a double-blind, randomised, placebo-controlled, phase 3 trial in Turkey. Lancet. Jul 17;398(10296): 213–222. doi: 10.1016/S0140-6736(21)01429-X. Epub 2021 Jul 8. PMID: 34246358; PMCID: PMC8266301.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим