 Серед застосунків та цифрових інструментів для здоров’я є певна кількість програм, які встановили для себе вищу планку, клінічно оцінивши створене програмне забезпечення як засіб для лікування, запобігання або управління конкретним захворюванням. Вони відомі як цифрові ліки та цифрові засоби для догляду залежно від їх функції та структури. Слід відмітити, що, починаючи з появи напрямку «цифрового здоров’я», почали виникати різні підкатегорії продуктів, і їх виокремлення та визначення все ще перебуває в процесі термінологічного оформлення. У рамках цієї статті ми обговоримо дві такі підкатегорії. «Цифрові ліки» фокусуються на вирішенні вузької клінічної проблеми при певній нозології, використовуючи фіксований контент та маючи доведену клінічну ефективність високого рівня доказовості. Їх позитивний ефект більшою мірою є результатом взаємодії з програмним забезпеченням, ніж залучення лікарів та мотиваційних тренерів, хоча може включати спілкування з ними. Такі застосунки, як правило, дотримуються такого шляху розробки, щоб забезпечити отримання дозволу на маркетування в якості медичного пристрою від Управління з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) у США або нотифікованих органів із сертифікації продукції у ЄС, а багато із них (хоча і не всі, і не у всіх країнах) потребують призначення від постачальника медичних послуг та підлягають реімбурсації. Поряд із цими прийнято виділяти цифрові засоби для догляду, включаючи цифрові платформи, які зазвичай стосуються поширених захворювань, таких як цукровий діабет, та цифрові інструменти для догляду — обидва, як правило, адаптуються до індивідуальних потреб або персоналізовані. Подібно до цифрових ліків, цифрові засоби для догляду часто використовують з метою постачання навчального контенту, але вони також включають активну участь провайдерів сфери охорони здоров’я (медичного персоналу) або тренерів для встановлення та зміни цілей під час здійснення догляду, відстеження прогресу пацієнта щодо встановлених цілей, індивідуалізації лікування або віддаленого контролю пацієнтів та їх симптомів, використовуючи підключені пристрої та eCOA-*/ePRO-** дані, зібрані застосунком з метою впливу на здійснення догляду. І цифрові ліки, і цифрові засоби для догляду, як правило, використовуються у поєднанні з медикаментозним лікуванням та стандартом догляду при конкретному захворюванні, а також проходять клінічні дослідження.
Серед застосунків та цифрових інструментів для здоров’я є певна кількість програм, які встановили для себе вищу планку, клінічно оцінивши створене програмне забезпечення як засіб для лікування, запобігання або управління конкретним захворюванням. Вони відомі як цифрові ліки та цифрові засоби для догляду залежно від їх функції та структури. Слід відмітити, що, починаючи з появи напрямку «цифрового здоров’я», почали виникати різні підкатегорії продуктів, і їх виокремлення та визначення все ще перебуває в процесі термінологічного оформлення. У рамках цієї статті ми обговоримо дві такі підкатегорії. «Цифрові ліки» фокусуються на вирішенні вузької клінічної проблеми при певній нозології, використовуючи фіксований контент та маючи доведену клінічну ефективність високого рівня доказовості. Їх позитивний ефект більшою мірою є результатом взаємодії з програмним забезпеченням, ніж залучення лікарів та мотиваційних тренерів, хоча може включати спілкування з ними. Такі застосунки, як правило, дотримуються такого шляху розробки, щоб забезпечити отримання дозволу на маркетування в якості медичного пристрою від Управління з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) у США або нотифікованих органів із сертифікації продукції у ЄС, а багато із них (хоча і не всі, і не у всіх країнах) потребують призначення від постачальника медичних послуг та підлягають реімбурсації. Поряд із цими прийнято виділяти цифрові засоби для догляду, включаючи цифрові платформи, які зазвичай стосуються поширених захворювань, таких як цукровий діабет, та цифрові інструменти для догляду — обидва, як правило, адаптуються до індивідуальних потреб або персоналізовані. Подібно до цифрових ліків, цифрові засоби для догляду часто використовують з метою постачання навчального контенту, але вони також включають активну участь провайдерів сфери охорони здоров’я (медичного персоналу) або тренерів для встановлення та зміни цілей під час здійснення догляду, відстеження прогресу пацієнта щодо встановлених цілей, індивідуалізації лікування або віддаленого контролю пацієнтів та їх симптомів, використовуючи підключені пристрої та eCOA-*/ePRO-** дані, зібрані застосунком з метою впливу на здійснення догляду. І цифрові ліки, і цифрові засоби для догляду, як правило, використовуються у поєднанні з медикаментозним лікуванням та стандартом догляду при конкретному захворюванні, а також проходять клінічні дослідження.За даними, наведеними у звіті «Digital Health Trends 2021 Innovation, Evidence, Regulation, and Adoption» компанії «IQVIA Institute for Human Data Science», станом на 20 червня 2021 р. у базі даних цифрових рішень IQVIA, яка досліджує різні типи цифрових рішень для здоров’я, нараховувалося 259 цифрових ліків та цифрових засобів для догляду, які знаходилися на будь-якому етапі розробки. Серед них 137 цифрових ліків та 122 цифрових засоби для догляду, включно з інструментами для догляду. З них принаймні 48 цифрових ліків та 99 цифрових засобів для догляду були виведені на ринок, а решта знаходилася у розробці (рис. 1).
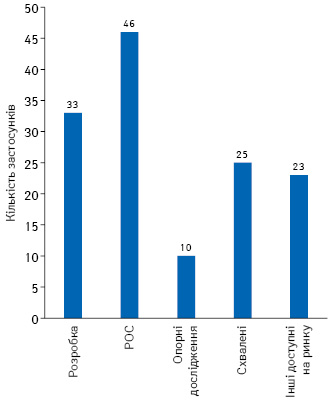
Джерело: IQVIA Digital Solution Database, червень 2021 р.; IQVIA Institute, червень 2021 р.
Серед цифрових ліків 25 отримали дозвіл на маркетування від регуляторних органів — із показаннями для застосування переважно у сфері психічного здоров’я та модифікації поведінки, включаючи посттравматичний стресовий розлад, синдром дефіциту уваги та гіперактивності, вживання наркотичних речовин/нікотину, біль, безсоння та ін. — і ще 23 стали комерційно доступними після того, як вони або були визнані звільненими від регуляторного нагляду в різних країнах як пристрої з низьким рівнем ризику, або як «оздоровчі» (wellness) застосунки, або за механізмом вибіркового застосування права (у разі FDA)***. Деякі із розробників цих звільнених від уваги з боку FDA застосунків, ймовірно, розглядатимуть питання про подальше схвалення регуляторними органами, щоб мати змогу вести мову про ефективність їх використання. Ще 89 цифрових ліків знаходяться на стадії клінічних досліджень, у ході яких збирають докази технічної та клінічної доцільності застосування, прийнятності та зручності використання шляхом проведення перевірки концепції в ході досліджень (proof of concept trials — POCs) та отримання доказів ефективності й безпеки за допомогою опорних досліджень.
Неврологічні та психіатричні показання до застосування є у фокусі уваги розробників як цифрових ліків, так і цифрових засобів для догляду, складаючи 2/3 (68%) усіх показань до застосування цифрових ліків та 41% — для цифрових засобів для догляду (рис. 2). Однак цифрові засоби догляду, які включають опцію спілкування з медичними працівниками або тренерами, більш зосереджені на ендокринології, онкології та серцево-судинних захворюваннях, які, як правило, потребують більш індивідуалізованої допомоги та моніторингу пацієнтів і можуть бути частиною реабілітаційних програм. Серед схвалених цифрових засобів для догляду в онкологічному просторі, наприклад, є програми для дистанційного моніторингу пацієнтів та управління вираженістю симптомів, які представляють собою щоденник або відстежують появу та тяжкість симптомів у хворих на рак з метою організації ефективної взаємодії з командою догляду. Ендокринологічний напрям включає низку застосунків та інструментів для догляду при цукровому діабеті та інших станах, таких як, наприклад, програми для управління/персоналізації застосування рецептурних ліків, які потребують визначеного лікарем графіку дозування та титрування ліків, щоб пацієнти з цукровим діабетом могли керувати терапією на основі розрахунків, зроблених програмою.
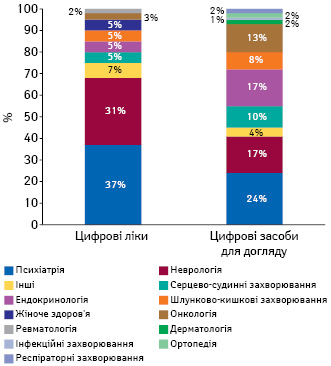
Джерело: IQVIA Digital Solution Database, червень 2021 р.; IQVIA Institute, червень 2021 р.
Наведемо декілька прикладів ефективності таких застосунків. Так, один із застосунків, що належить до підкатегорії цифрових засобів для догляду, Moovcare, продемонстрував клінічну ефективність у рандомізованому клінічному дослідженні III фази щодо продовження життя хворих на рак легені у стадії ремісії, забезпечивши збільшення загальної виживаності на 7,6 міс. Застосунок відстежує симптоми, про які пацієнти з раком легені щотижня повідомляють за допомогою мобільних опитувань, на основі отриманої інформації програма може виявити рецидив або ускладнення на ранній стадії та попередити лікаря. Це також перший цифровий додаток, який реімбурсується у Франції (1 тис. євро у розрахунку на одного пацієнта за кожні 6 міс застосування).
Серед 25 цифрових ліків з дозволом на маркетування щонайменше в одній країні 9 представлені в США, 19 — у Європі, та 1 — у Японії. Близько 20 таких застосунків зараз доступні за призначенням лікаря у деяких країнах, де вони маркетуються, разом із 6 цифровими інструментами догляду за умови їх дозволу та/або реімбурсації. Вони, як правило, відомі як цифрові терапевтичні препарати, що відпускаються за рецептом (prescription digital therapeutics — PDT), і вимога щодо призначення лікарем зазвичай характерна для програм, що мають середній та високий ризик застосування, наприклад це може стосуватися програм, що усувають або зменшують вираженість симптомів захворювання. З іншого боку, програми з низьким рівнем ризику призначені загалом для поліпшення стану здоров’я або певних функцій, можуть вважатися медичними виробами з низьким ризиком (наприклад, клас I) у деяких регіонах, таких як США та ЄС, і бути доступними без дозволу на маркетування.
Серед цифрових ліків, що відпускаються за рецептом, є 4, які отримали допуск на ринок з твердженнями про ефективність шляхом процесу схвалення за процедурою De Novo Classification**** у США: EndeavorRx для застосування у дітей з синдромом дефіциту уваги та гіперактивністю, що покращує увагу за допомогою відеоігор; NightWare для покращення якості сну при порушеннях, асоційованих з нічними кошмарами на фоні посттравматичного стресового синдрому у дорослих; Parallel, який використовує когнітивно-поведінкову терапію для дорослих з метою зменшення вираженості симптомів синдрому роздратованого кишечнику; Reset, що використовує когнітивно-поведінкову терапію та тренування для управління непередбачуваними ситуаціями з метою лікування наркоманії та покращення проходження пацієнтами програм амбулаторного лікування наркоманії.
Хоча більшість цифрових ліків є програмами або вебпрограмами, 2 зі схвалених цифрових препаратів є терапевтичними відеоіграми: EndeavorRx для лікування пацієнтів із синдромом дефіциту уваги та гіперактивністю та MindMotion GO для проведення нейрореабілітації в домашніх умовах. Такі ігри вимагають від користувача фізичних дій, які зазвичай стимулюють розумову активність, у тому числі таку, що залучає пошкоджені ділянки мозку для поліпшення пізнавальної або фізичної працездатності. Існує ще 23 гри з підкатегорій цифрових ліків та цифрових засобів для догляду, і майже всі вони використовуються для поліпшення стану при неврологічних захворюваннях (хвороби Альцгеймера та Паркінсона, реабілітація після інсульту, травми головного мозку), а деякі з них направлені на вирішення когнітивних та опорно-рухових проблем. Також збільшується кількість програм віртуальної реальності (n=18) у цих двох підкатегоріях. Вони здебільшого призначені для корекції психічних розладів, що піддаються впливу експозиційної терапії.
Цифрові ліки, супроводжуючи пацієнта вдома, можуть запропонувати доступ до допомоги та підтримки поза межами традиційних особистих взаємодій. Наприклад, цифрові ліки у вигляді програм для психічного здоров’я часто пропонують цифрову версію когнітивно-поведінкової терапії (iCBT), яка, ймовірно, зробить психологічну допомогу доступнішою та потенційно зможе охопити людей у сільській місцевості або подолає стигму, тим самим сприяючи поліпшенню стану здоров’я поза системою традиційної медичної допомоги. Більше половини або 14 із 25 схвалених/ауторизованих цифрових ліків, використовують когнітивно-поведінкову терапію для лікування пацієнтів зі станами, на які вони націлені, а також ще такі 42 цифрові препарати знаходяться в розробці (56/137, або 39% усіх цифрових ліків) та принаймні 22% (27/122) цифрових засобів для догляду, хоча іноді останні потребують супровідних сеансів психологічної терапії.
Хоча клінічні дані, отримані розробниками цифрових ліків, відрізняються, дослідження, які вони проводять, як правило, включають принаймні одне рандомізоване контрольоване клінічне випробування, а багато включають кілька. Хоча всі розробники схвалених цифрових препаратів проводили деякі інтервенційні дослідження, майже половина (n=12) проводила 2 рандомізовані контрольовані клінічні дослідження, а 5 — більше 2.
Реімбурсація цифрових ліків: кращі практики
Розробники цифрових ліків усе частіше подають заявки та отримують схвалення від регуляторних органів, що дозволяє їм претендувати на реімбурсацію та ставати все доступнішим варіантом терапії. Багато цифрових ліків пройшли шлях авторизації як медичні пристрої, для чого розробники мали надати докази ефективності, як у випадку з FDA або під час подання заявки на знак CE Mark.
У якості прикладу застосунку для здоров’я, що реімбурсується на державному рівні, можна навести Deprexis компанії Orexo, що використовується при депресії, та Vorvida, який буде актуальним у процесі відмови від зловживання алкоголем — обидва наразі схвалені в Європі та реімбурсуються в Німеччині відповідно до закону Digital Healthcare Act (Digitale-Versorgung Gesetz — DVG). Цей закон, що прискорює процес впровадження цифрових медичних додатків, набув чинності у грудні 2019 р., що дозволило лікарям призначати цифрові медичні програми, які потім можуть бути реімбурсовані медичними страховими компаніями, і перший такий додаток було додано до каталогу у вересні 2020 р. Для того, щоб вийти на ринок та мати можливість бути реімбурсованими, розробники повинні зареєструвати свій пристрій із маркуванням CE (клас I або IIA) у Федеральному інституті лікарських засобів та медичних виробів (Federal Institute for Drugs and Medical Devices), а також виконати критерії зі 122 пунктів, що стосуються безпеки використання застосунків, їх якості, функціональності, безпеки та захисту даних, а також надати клінічні докази ефективності. Якщо клінічних даних ще немає, виробник має також надати обґрунтування внеску програми у поліпшення охорони здоров’я, а потім скласти план клінічних досліджень на 12–24 міс з метою демонстрації позитивних наслідків її застосування. Хоча протягом періоду досліджень виробник встановлює ціну, після остаточного затвердження національний комітет з цін узгоджує її. Хоча 15 цифрових ліків та цифрових засобів для догляду отримали тимчасове схвалення за цією процедурою, поки що лише 5 включені до каталогу на постійній основі, оскільки надали достатньо доказів для проходження цього етапу.
У Великобританії віднесення застосунків для здоров’я до категорії, що підлягає реімбурсації, відбувається за децентралізованою процедурою. На даний час різні постачальники та типи медичних послуг можуть включати цифрові технології до списку медичних послуг, що вони надають після того, як ці застосунки отримають відповідне регуляторне схвалення (знак СЕ або маркування UKCA після 30 червня 2023 р.) та підтвердять відповідність стандартній структурі доказів Національного інституту здоров’я і якості медичної допомоги Великобританії (National Institute for Health and Care Excellence — NICE) щодо цифрових рішень для охорони здоров’я. Оцінки вартості та рішення про реімбурсацію в основному приймаються на місцевому рівні клінічними комісіями — закупівельними органами, відповідальними за введення в експлуатацію послуг первинної медичної допомоги для своєї громади. Ця децентралізація виявляється серйозною перешкодою на шляху прийняття широкого спектра клінічно ефективних цифрових рішень для охорони здоров’я. З іншого боку, саме NICE у 2016 р. оцінила вплив на населення першої національної програми цифрового догляду — Програми профілактики діабету NHS, а щодо інших сфер, наприклад таких як психічне здоров’я, невелика кількість клінічних комісій уклала контракти на проведення безкоштовних пілотних програм. Серед цифрових ліків, що отримали поширення у Великобританії, можна назвати Space from Depression від компанії SilverCloud для лікування дорослих з депресією.
за матеріалами www.iqvia.com, www.fda.gov

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим