 Заявник, виробник, власник дозволу на маркетинг (Marketing Authorisation Holder — MAH) — оператори можуть виступати у різних якостях, розділяючи та поєднуючи різні функціональні ролі. При цьому отримувати дозвіл на маркетинг продукту може одна компанія, а маркетувати — зовсім інша. У ЄС один заявник може навіть реєструвати той самий лікарський засіб на різних МАН. Ключовий момент: можна делегувати практично будь-які завдання та функції, а відповідальність — ні. Навіть якщо МАН має у різних країнах своїх представників із дозволами на виробництво та імпорт (Manufacturing and Importation Authorisation — MIA), остаточна відповідальність за забезпечення якості, фармаконагляд, перебої у постачаннях та ведення реєстраційного досьє залишається за ним. Особливо широко цю концепцію застосовують у сегменті медичних виробів: бізнес-модель «private label manufacturers — PLM/original equipment manufacturer — OEM» міцно вкорінилася на цьому ринку. При цьому OEM-виробники можуть обмежити власну діяльність розробкою та виробництвом без створення власних структур з маркетингу та взаємодії з регуляторними органами, а PLM не потрібно мати власні розробки та виробничі ноу-хау.
Заявник, виробник, власник дозволу на маркетинг (Marketing Authorisation Holder — MAH) — оператори можуть виступати у різних якостях, розділяючи та поєднуючи різні функціональні ролі. При цьому отримувати дозвіл на маркетинг продукту може одна компанія, а маркетувати — зовсім інша. У ЄС один заявник може навіть реєструвати той самий лікарський засіб на різних МАН. Ключовий момент: можна делегувати практично будь-які завдання та функції, а відповідальність — ні. Навіть якщо МАН має у різних країнах своїх представників із дозволами на виробництво та імпорт (Manufacturing and Importation Authorisation — MIA), остаточна відповідальність за забезпечення якості, фармаконагляд, перебої у постачаннях та ведення реєстраційного досьє залишається за ним. Особливо широко цю концепцію застосовують у сегменті медичних виробів: бізнес-модель «private label manufacturers — PLM/original equipment manufacturer — OEM» міцно вкорінилася на цьому ринку. При цьому OEM-виробники можуть обмежити власну діяльність розробкою та виробництвом без створення власних структур з маркетингу та взаємодії з регуляторними органами, а PLM не потрібно мати власні розробки та виробничі ноу-хау.Інформаційний бум, цифрова трансформація, посилення ролі віртуальних компаній та квазіпрепаратів (пограничних між ліками та іншими продуктами) — ці та інші зміни так швидко входять у життя Фарми, що можуть незабаром змінити її до невпізнанності. Втім, найгустіша темрява буває перед світанком, і за певної частки фантазії в ній вже можна розрізнити контури майбутніх галузевих реалій, що концентруються навколо інформаційних потоків і високоспеціалізованих партнерств.
До речі, згадані вище квазіліки (quasi-drugs) та віртуальні виробники — це цілком офіційні терміни, що застосовуються регуляторами Японії/Південної Кореї та Великобританії. Європейське агентство з лікарських засобів (European Medicines Agency — EMA) саме займається уточненням вимог до власників дозволу на маркетинг. Оскільки в цій ролі дедалі частіше виступають різні оператори ринку, крім виробників, виникла потреба у роз’ясненні та додатковому тлумаченні існуючих законодавчо-нормативних положень, які застосовуються, зокрема, щодо норм Належної виробничої практики (Good Manufacturing Practice), про що йдеться у дискусійній статті (ЕМА, 2022).
Управління інформацією та партнерська мережа
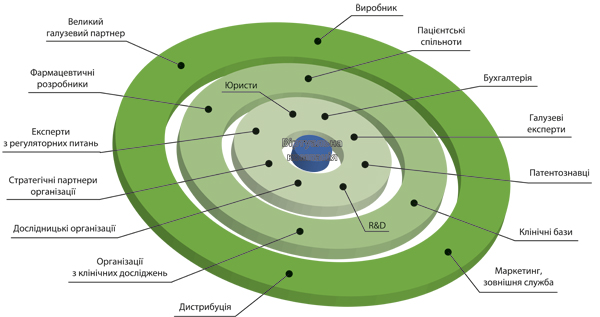
Що являє собою віртуальна компанія? Фактично — лише управлінський та фінансовий центр, тоді як більша частина, а то й вся R&D (research and development — дослідження та розробка) та виробнича діяльність віддана на аутсорсинг. Координація складної мережі віртуальних (побудованих на електронних комунікаціях) партнерств, збирання та аналіз інформації, а також управління ризиками знаходяться у віданні невеликої команди менеджерів та консультантів (зазвичай менше 10 осіб) (рисунок). Подібна «віртуальна модель» дозволяє невеликим компаніям економічно та оперативно застосовувати новаторські рішення, не беручи на себе підвищених зобов’язань.
Великі фармацевтичні компанії передають на аутсорсинг близько 45% своїх процесів, малі та середні — 70%, а нові біотехнологічні стартапи — до 90% (Fassbender M., 2019). У результаті світовий ринок аутсорсингу в медико-біологічному секторі, як очікується, досягне 91,4 млрд дол. США до 2028 р. (Grand View Research, 2021). Все ж у даного огляду немає мети розглядати питання про переваги та недоліки віртуальних організацій. Цю інформацію з відповідними прикладами можна знайти у статті, опублікованій «Drug Discovery World» (Naylor S., Pritchard K. A., 2019). Віртуальні організації згадані тут як приклад фрагментації та міграції функціональних обов’язків між учасниками ланцюжка створення цінності. Причому останнім часом цей процес все більше набуває характеру засобу економічного виживання, а не збільшення прибутку.
Ціни та супутні питання
У цьому відношенні показовий приклад канадської провінції Онтаріо, яка спочатку боролася з практикою передачі виробниками частини своїх доходів по ланцюжку обігу ліків аж до аптек, а потім скасувала свої заборони, оскільки ні про які надприбутки вже не могло бути й мови. Як і будь-який інституційний платник, уповноважені організації регулювали націнки та надавали перевагу найдешевшим пропозиціям. Виробники встановлювали завищені ціни, а самі відпускали аптекам продукцію зі знижками (Katz Group Canada Inc. v. Ontario, 2013). Із забороною знижок у 2006 р. вони почали надавати аптекам матеріальну допомогу (professional allowances) обсягом близько 800 млн дол. щороку. Звичайно, ціни при цьому не знижували, і в 2010 р. довелося запровадити заборону і такої форми «перетікання коштів». Оскільки ключовою точкою ціноутворення для громадського платника є відпускна ціна виробника, аптеки постаралися отримати контроль саме у цій критичній точці, просто розміщуючи свої замовлення у афілійованих виробників та таким чином безпосередньо беручи участь у встановленні офіційних (формулярних) цін. Даній практиці у 2010 р. також було покладено край: заборонено позначення продуктів під власною торговою маркою (private label products — СТМ) як «взаємозамінних» та включення до формуляру препаратів, доступних за громадський рахунок. Однак оскільки політика офіційного ціноутворення зазвичай призводить ціни до мінімально виправданого з економічного погляду рівня, через 10 років уже не доводилося турбуватися про отримання аптеками підвищеного прибутку — постало питання про збереження економічної спроможності останніх. Тому з 1 січня 2020 р. в Онтаріо скасовано обмеження на звичайні комерційні умови (Ordinary Commercial Term), що забороняли одержання вигоди у розмірі, що перевищує 10% формулярної ціни генерика, а з 1 липня 2020 р. — заборону на включення СТМ до переліків взаємозамінних, доступних для придбання за громадський рахунок.
У США також кілька років тому виникали обґрунтовані побоювання у зв’язку з тим, що безрецептурні продукти під СТМ аптечні мережі продають за цінами, завищеними іноді в десятки разів порівняно з аналогами, що мають той самий склад (RxInformer, 2015). Проте подібна цінова політика потребує великих рекламних зусиль, і ліки (не косметику чи медичні вироби) під СТМ тепер орієнтують переважно на низьковартісний сегмент. Це навіть загрожує тим, що виробник сам «підриватиме» основи власної прибутковості, хоча розширення присутності саме по собі є непоганим бонусом.
Так, 29 червня 2021 р. мережа «Walmart» оголосила про випуск першого в історії аналогового інсуліну під приватною торговою маркою Walmart ReliOnТМ. Нова пропозиція включає ReliOn™ NovoLog® Insulin (інсулін аспарт) виробництва Novo Nordisk у флаконах (72,88 дол.) та картриджах FlexPen® (85,88 дол.). Ці рецептурні препарати забезпечать економію у розмірі 58–75% ціни препаратів, тобто до 101 дол. за флакон або 251 дол. — за FlexPens. Ініціатива доповнює запущену «Walmart» більше 10 років тому програму рецептурних генериків, які пацієнту коштують 4 дол. Зі своїми продуктами під СТМ «Walmart» знаходиться в хорошій компанії, що включає «CVS Pharmacy», «Amazon» та інших операторів.
Обов’язки передаються, відповідальність — ні
З появою в ЄС віртуальних організацій не всі власники дозволів на маркетинг ( MAH) є виробниками або мають дозвіл на виробництво та імпорт (MIA), і організації, що маркетують, укладають контракти на багато, якщо не на всі види діяльності, пов’язані з належною виробничою практикою (GMP). Новий аналітичний документ ЕМА (2022) спрямований на уточнення та узагальнення різних обов’язків MAH, які нині існують у різних регламентах, директивах та настановах.
Загалом ці обов’язки варіюють від відповідальності за функції, передані за аутсорсингом та технічними угодами, до вимоги від МАН виконання певних завдань (наприклад оцінка результатів перевірок якості продукції, узгодження з виробниками їх внутрішніх процедур тощо). Обов’язки розподілені за різними законодавчо-нормативними документами, і їх досить багато.
При цьому, як зазначено в 16-му додатку настанови з GMP, (EudraLex — Volume 4) остаточна відповідальність за характеристики лікарського засобу протягом усього терміну придатності, його безпеку, якість та ефективність покладається на МАН (що не скасовує факту відповідальності Уповноваженої особи (QP) за забезпечення того, щоб кожна окрема партія була зроблена та перевірена на відповідність:
- чинному законодавству держави-члена, в якій проведена сертифікація щодо GMP,
- вимогам дозволів на маркетинг (MA) та
- нормам GMP.
Дія нормативних вимог щодо GMP ЄС поширюється на:
- будь-яких виробників та відповідні майданчики, де займаються виробництвом та пов’язаною з ним діяльністю, включаючи контрактні випробувальні підприємства, що контролюють випуск серій або перевіряють стабільність;
- до всіх MAH, незалежно від процедури авторизації або реєстрації, включаючи традиційні, рослинні/гомеопатичні лікарські засоби;
- діяльність з виконання антифальсифікатної Директиви 2011/62/EC та пов’язаних з нею актів (у тому числі Регламенту 2016/161).
Також звертають увагу, що хоча деякі види діяльності можуть бути делеговані виробнику або іншій стороні від імені МАН, за ним зберігається вся повнота відповідальності. Аналогічно, обов’язки МАН щодо GMP можуть бути делеговані МАН своєму представнику (якщо є) у державі-члені, відповідальності МАН це ніяк не стосується (докладніше про місцевого виробника — див. частина 18a статті 1 Директиви 2001/83/ЕС та статтю 58(1) у Регламенті (ЄС) 2019/6).
Настанова з GMP також не передбачає скорочення обов’язків МАН (або делегування відповідальності) у ситуаціях, коли він та виробник належать до однієї й тієї ж групи, але відповідні компанії є різними юридичними особами. Так, багато МАН є частиною великих та складних організацій, які використовують загальні фармацевтичні системи якості. Хоча завдання МАН можуть бути делеговані іншим учасникам, відповідальність за них не може бути передана. Немає жодної різниці в обов’язках порівняно з тим, коли МАН та виробник є окремими та незв’язаними компаніями.
Коло питань, якими займається МАН, може вимагати прийняття на себе деяких обов’язків, що виникають у зв’язку з нормами належної практики дистрибуції (Good Distribution practice — GDP). МАН дійсно необхідно розуміти типи інтерфейсів, які можуть знадобитися для взаємодії з оптовиками. Наприклад, діюча настанова GDP ЄС щодо лікарських засобів людини потребує, щоб фармацевтичні оптовики передавали MAH певну інформацію, наприклад про фальсифіковану продукцію та дефекти якості (див. настанову (2013 р.), розділи 6.2 та 6.4). У результаті вважається, що МАН повинні мати у своєму розпорядженні системи для прийому та реагування на таку інформацію в міру її надходження від оптовиків.
OEM/PLM медичних виробів як бізнес-модель
26 травня 2021 р. у Європейському Союзі набув чинності Регламент (ЄС) 2017/745 про медичні вироби. Прийнятий у квітні 2017 р., він змінює європейську правову базу для медичних виробів та запроваджує нові основні та допоміжні обов’язки для EMA та національних компетентних органів при оцінці певних категорій продуктів, а також постмаркетингового нагляду за безпекою. Ще один новий Регламент (ЄС) — 2017/746 встановлює правила для діагностичних медичних виробів (diagnostic medical devices — IVD).
Регламент (ЄС) 2017/745 прямо передбачає, що всеосяжні зобов’язання виробника, докладно описані у ст. 10, також застосовуються до інших економічних операторів, якщо вони випускають вироби на ринок від свого імені. Причому це стосується не тільки дистриб’юторів, а й імпортерів та представників ЄС, які виступають у ролі квазівиробників, що часто буває з неєвропейськими, особливо азіатськими компаніями. З іншого боку, у ст. 16 (1а) пояснюється, що зобов’язання виробника не переходять до інших операторів, якщо він зазначений як такий на упаковці продукту та уклав угоду з імпортером або дистриб’ютором про те, що він (виробник) відповідає за дотримання нормативних вимог.
Таким чином, маркування власної торгової марки без прийняття на себе відповідальності виробника вимагає угоди між дистриб’ютором/імпортером/представником ЄС та постачальником (первинним виробником). В іншому випадку, особливо якщо постачальник не вказаний як виробник у будь-якій письмовій угоді, але дистриб’ютор/імпортер/представник ЄС поширює продукт під своєю торговою маркою, останній несе відповідальність як виробник і також має бути ідентифікований як такий у продукті. Однак якщо імпортер/уповноважений представник/дистриб’ютор ЄС змінює призначення або іншим чином модифікує пристрій, то навіть не розміщуючи пристрій на ринку під своїм ім’ям він все одно несе зобов’язання виробника.
Ці нові вимоги кидають виклик як первинному виробнику, так і квазівиробнику (Klaus B., Egerer R., 2020). Так, перший тепер зобов’язаний надати другому всю інформацію, необхідну для підготовки технічної документації. Маються на увазі вся технічна документація та записи із системи менеджменту якості, а також інформація про постачальників та аутсорсингові процеси. Це означає, що власне ноу-хау первинного виробника може бути передане квазівиробнику. Це також стосується модифікацій, оскільки виробник, у тому числі квазівиробники, сам несе відповідальність за підтримання технічної документації в актуальному стані. У наступній публікації ми докладніше розглянемо питання регуляторного супроводу сучасних міксів виробник/МАН, продукт/дозвіл на маркетинг.
Список використаної літератури
- Fassbender M. (2019) CRO earnings roundup: Big pharma picking up biotech slack? Оutsourcing Рharma. August 9. http://www.outsourcing-pharma.com/Article/2019/08/09/CRO-market-update-Big-pharma-picking-up-biotech-slack?utm_source=copyright&utm_medium=OnSite&utm_campaign=copyright.
- Grand View Research (2021) Biotechnology & Pharmaceutical Services Outsourcing Market Size Worth $91.4 Billion By 2028. PR Newswire. February 21. http://www.prnewswire.com/news-releases/biotechnology-pharmaceutical-services-outsourcing-market-size-worth-91-4-billion-by-2028-grand-view-research-inc-301225601.html.
- Katz Group (2013) Canada Inc. v. Ontario (Health and Long‑Term Care). SCC 64 (CanLII), [2013] 3 SCR 810. canlii.ca/t/g1z1v>.
- Ministry of Health Drugs and Devices Division (2019) Notice: Amendments to Ontario Regulation 201/96 made under the Ontario Drug Benefit Act and Regulation 935 made under the Drug Interchangeability and Dispensing Fee Act to reduce restrictions on Private Label Products and Ordinary Commercial Term benefits. December 16. http://www.health.gov.on.ca/en/pro/programs/ drugs/opdp_eo/notices/exec_office_20191216_3.pdf
- Klaus B., Egerer R. (2020) Amendments to medical device law: implications and need for action in private label constellations. http://www.roedl.com/insights/life-sciences-law/privat-label-medical-device-law-products-requirements-implications Naylor S., Pritchard K.A. (2019) The Reality of Virtual Pharmaceutical Companies. Drug Discovery World. August 6. http://www.ddw-online.com/the-reality-of-virtual-pharmaceutical-companies-1320-201908/.
- Reflection paper on Good Manufacturing Practice and Marketing Authorisation Holders (2022) European Medicines Agency. 10 January. EMA/419571/2021. Human Medicines, Pharmacovigilance and Committees Division. Version 2. http://www.ema.europa.eu/en/documents/scientific-guideline/reflection- paper-good-manufacturing-practice-marketing-authorisation-holders_en.pdf.
- RxInformer (2015) PRIVATE-LABEL TOPICALS: OVER-THE-COUNTER ANALGESICS GO UNDERCOVER AS PRICEY PRESCRIPTIONS, Spring. rxinformer.healthesystems.com/article.php?id=73.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим