Глобальний контекст: загалом 4,95 млн випадків смерті на рік пов’язано зі стійкими бактеріями. З них принаймні 1,27 млн безпосередньо зумовлені стійкістю до АМП (Antimicrobial Resistance Collaborators — ARC, 2022). Наскільки велика загроза антибіотикорезистентності та як вона порівнюється із летальними випадками з інших причин (рис. 1)?
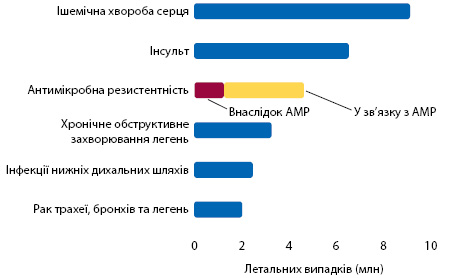
| Підвищений ризик стосується дітей молодшого віку: у 2019 р. кожна п’ята смерть внаслідок АМП зафіксована у віці молодше 5 років | Серед 6 патогенів (E. coli, Staphylococcus aureus, K. pneumoniae, S. pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa), з якими пов’язано більше випадків смерті від АМП, тільки на один — S. pneumoniae, спрямована програма суспільної охорони здоров’я — вакцинація | У країнах Східної Європи відзначають високий (поступається тільки Африці та Південній Азії) рівень смертності, пов’язаної з АМП. Найбільша кількість випадків припадає на E. coli — поширену причину інфекцій сечовивідних шляхів, та K. pneumoniae |
| Стійкість до фторхінолонів і β-лактамних антибіотиків (карбапенемів, цефалоспоринів і пеніцилінів) є причиною понад 70% випадків смерті, пов’язаних із АМП |
Національні стандарти щодо адміністрування призначення і використання АМП (Antimicrobial Stewardship) має майже кожна друга країна світу, зокрема, у Європі — понад 80%. Відповідні програми використовують, зокрема, дві третини лікарень у Північній Америці та Європі (Howard P. et al., 2015). Певний інтерес викликає опис перешкод до запровадження адміністрування АМП, отриманий за результатами опитування медиків різних частин світу (рис. 2).

Деякі поширені методи адміністрування АМП, які сприяють оптимальному їх застосуванню в закладах охорони здоров’я, описано у практичному посібнику (WHO Regional Office for Europe, 2021). Хоча докази на підтримку цих втручань отримані в основному з досліджень, проведених у країнах з високим рівнем доходу, видання висвітлює способи адаптації цих втручань до умов з обмеженими ресурсами. Спеціальний інструментарій для країн з низьким або нижче середнього рівнем доходів представлено в іншій розробці ВООЗ (World Health Organization, 2019).
З «історіями успіху» імплементації адміністрування АМП у різних країнах знайомить Європейське товариство клінічної мікробіології та інфекційних хвороб (European Society of Clinical Microbiology and Infectious Diseases) (Huttner B. et al., 2014). При цьому Швеція названа однією з перших країн, яка прийняла універсальну національну стратегію адміністрування АМП у всіх сферах (включаючи ветеринарний сектор). Шведська стратегічна програма проти антибіотикорезистентності (Samverkan mot antibiotikaresistens — Strama), започаткована як неофіційна мережа в 1995 р., офіційно оформлена в якості незалежного урядового органу у 2006 р. Фінансування її діяльності здійснюється як на національному (близько 2 млн євро на рік), так і місцевому рівнях (3–5 млн євро) (Mölstad S. et al., 2017). Адаптацією загальних ініціатив займаються регіональні міжпрофесійні групи, налагоджено багаторівневу систему моніторингу АМП та лікарських призначень.
Висновки експертів за результатами співробітництва із міжпрофесійними групами Strama (Mölstad S. et al., 2017):
1) національні рекомендації з лікування повинні включати діагностичні критерії для кожного стану; аналіз ризиків і переваг АМП як для пацієнта, так і для суспільства; рекомендації щодо того, коли слід повторно оцінювати лікування пацієнта;
2) щоб полегшити впровадження національних рекомендацій у сфері первинної медико-санітарної допомоги, їх необхідно трансформувати у прості алгоритми, наприклад, чіткі поради медичним працівникам щодо того, коли слід та не слід призначати АМП;
3) важливо контролювати призначення АМП лікарями як у первинній медичній допомозі, так і в лікарнях; це допоможе стимулювати дискусії про шляхи вдосконалення практики призначення;
4) потрібне постійне фінансування для тісної співпраці експертів із практикуючими лікарями, включно з аудитом і зворотним зв’язком для досягнення кращого дотримання рекомендацій;
5) необхідні відповідний статус і фінансова підтримка з боку уряду.
Визначною особливістю Strama також вважають зусилля з оцінки потенційних негативних наслідків скорочення застосування АМП у суспільстві — аспекту, яким часто нехтують (Huttner B. et al., 2014). Доведення того, що зниження частоти призначень не пов’язане зі зростанням розвитку ускладнень, таких як мастоїдит та пневмонія, є надзвичайно цінною інформацією для інших країн.
Клінічні рекомендації Strama мають зручну (від простого до складного) та практичну структуру (для первинної допомоги, стаціонарів, стоматології та загальні). В останній групі, наприклад, знаходимо лаконічне оформлення особливостей застосування антибіотиків при різних станах (табл. 1) залежно від етіології захворювання, прийому їжі, наявності алергічних реакцій тощо.
| Принцип дозування | Назви груп |
| ІМТ | Еритроміцин, лінезолід, колістин, тайгециклін |
| СМТ | Аміноглікозиди, пеніциліни, цефалоспорини, триметоприм-сульфаметоксазол, поліміксин В, даптоміцин |
| ФМТ | Ванкоміцин (але у нижчій, ніж звичайно, дозі) |
Тривала праця на теренах адміністрування АМП приносить результати: у Швеції рівень призначень АМП (12,4 DDD (встановлена добова доза) на 100 жителів на добу) — один із найнижчих у Європі і продовжує знижуватися, на відміну, наприклад, від Греції, де цей показник — майже утричі вищий (34,1) та ще й продовжує зростати (Robertson J. et al., 2021).
Покращання споживання АМП було б неможливим, аби відповідні заходи не були поширені на сектор первинної медичної допомоги. Адже на нього припадає близько 90% обсягів їх застосування у країнах ЄС (http://www.ecdc.europa.eu). Як зазначили автори тематичного огляду, «втручання, які є найбільш успішними для зменшення неправильного призначення антибіотиків, як правило, багатогранні та поєднують освіту лікаря, пацієнта та громадськості» (табл. 2) (Dyar O.J. et al., 2016).
| Спрямовані на фахівців охорони здоров’я | Спрямовані на модифікацію системи | ||
| Опис | Рівень доказовості | Опис | Рівень доказовості |
| Навчання Покращання комунікаційних навичок |
Низький
Середній |
Обмеження безрецептурного відпуску | Н/в |
| Клінічні настанови | Низький | Поділ упаковок при відпуску | н/в |
| Система підтримки клінічних рішень | Низький | Обмеження доступної номенклатури або підвищення цін | н/в |
| Відтерміноване лікування | Низький | Відокремлення призначення та відпуску | н/в |
| Навчальні матеріали для пацієнтів | Низький | Система заохочень лікарів | н/в |
| Визначення чутливості мікрофлори | н/в | Винагорода праці залежно від результатів | н/в |
| Тестування в місцях надання допомоги | Середній | Публічна оцінка якості медичної допомоги | н/в |
| Аудит та зворотний зв’язок | н/в | Обмеження рекламування | н/в |
| Обмеження призначень | Низький | Визначення непрацездатності окремо від діагностики та лікування | н/в |
Серед перспективних заходів автори огляду відзначають системи підтримки клінічних рішень. Зокрема, як у Великобританії, де відповідний функціонал інтегрований в електронну систему медичних записів. Можливості тестування зростають, але поки недостатньо адекватно задовольняють потреби. Європейський проєкт, який фінансується Innovative Medicines Initiative (IMI), має на меті консенсусний перелік показників якості, що оцінюють застосування антибіотиків в амбулаторних умовах (проєкт DRIVE-AB). Заходи з обмеження призначень використовують, наприклад, у Словенії: лікарі первинної медичної допомоги сплачують штраф, якщо за результатами аудиту Інституту страхування охорони здоров’я (Zavod za zdravstveno zavarovanje Slovenije) буде виявлено призначення АМП, що не відповідає діючим рекомендаціям (Fürst J. et al., 2015).
Фармацевти як лікарняних, так і громадських аптек є ключовими учасниками регіональних міжпрофесійних груп, подібно до згаданих вище шведських, допомагаючи лікарям та пацієнтам зробити правильний вибір у різноманітних клінічних ситуаціях.
Так, в аптеках забезпечується зручний доступ до кваліфікованого медичного працівника без попереднього запису. Фармацевти регулярно консультують щодо незначних захворювань, таких як інфекція сечовивідних шляхів та біль у горлі, і відіграють важливу роль у навчанні пацієнтів. У Великобританії фармацевти можуть призначати деякі АМП відповідно до спеціальних інструкцій. У Франції можуть визначати активність бета-гемолітичного стрептококу за допомогою швидких тестів, щоб уникнути зайвих призначень АМП. У США в деяких штатах діють угоди про співпрацю (Collaborative Practice Agreements — CPA) між лікарями та фармацевтами щодо делегування повноважень ініціювати, змінювати або скасовувати призначення в суворо контрольованих умовах (Klepser M.E. et al., 2015). Дані ініціативи показують, наскільки тісна співпраця між лікарями та фармацевтами в амбулаторних умовах може сприяти створенню ефективних програм антибіотикотерапії. У наступних публікаціях будуть розглянуті ініціативи Чехії, Словаччини, Словенії та Польщі, а також досвід вітчизняних клінічних фармацевтів, що почали працювати у відділах з інфекційного контролю закладів охорони здоров’я.
Список використаної літератури
- Antimicrobial Resistance Collaborators (2022) Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet, Feb 12; 399(10325): 629–655. doi: 10.1016/S0140-6736(21)02724-0. Epub 2022 Jan 19. Erratum in: Lancet. 2022 Oct 1; 400(10358): 1102.
- Cassini A., Högberg L.D., Plachouras D. et al. of AMR Collaborative Group (2019) Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect. Dis., Jan; 19(1): 56–66.
- GBD 2019 Diseases and Injuries Collaborators (2019) Global burden of 369 diseases and injuries, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. The Lancet, 17 October.
- Howard P., Pulcini C., Levy Hara G. et al. (2015) ESCMID Study Group for Antimicrobial Policies (ESGAP); ISC Group on Antimicrobial Stewardship. An international cross-sectional survey of antimicrobial stewardship programmes in hospitals. J. Antimicrob. Chemother., Apr; 70(4): 1245–55.
- Antimicrobial stewardship interventions: a practical guide (2021) Copenhagen: WHO Regional Office for Europe. Licence: CC BY-NC-SA 3.0 IGO.
- Antimicrobial stewardship programmes in health-care facilities in low- and middle-income countries (2019) A practical toolkit. Geneva: World Health Organization. Licence: CC BY-NC-SA 3.0 IGO.
- Huttner B., Harbarth S., Nathwani D.; ESCMID Study Group for Antibiotic Policies (ESGAP) (2014) Success stories of implementation of antimicrobial stewardship: a narrative review. Clin. Microbiol. Infect., Oct; 20(10): 954–62.
- Mölstad S., Löfmark S., Carlin K. et al. (2017) Lessons learnt during 20 years of the Swedish strategic programme against antibiotic resistance. Bull World Health Organ., Nov 1; 95(11): 764–773.
- Robertson J., Vlahović-Palčevski V., Iwamoto K. et al.; ESAC-Net Study Group; WHO Europe AMC Network Study Group (2021) Variations in the Consumption of Antimicrobial Medicines in the European Region, 2014-2018: Findings and Implications from ESAC-Net and WHO Europe. Front. Pharmacol., Jun 17; 12: 639207.
- Dyar O.J., Beović B., Vlahović-Palčevski V. et al.; on behalf of ESGAP (the ESCMID [European Society of Clinical Microbiology and Infectious Diseases] Study Group for Antibiotic Policies) (2016) How can we improve antibiotic prescribing in primary care? Expert Rev. Anti Infect. Ther.; 14(4): 403–13.
- Drekonja D.M., Filice G.A., Greer N. et al. (2015) Antimicrobial stewardship in outpatient settings: a systematic review. Infect Control Hosp. Epidemiol., 36: 142–152.
- Fürst J., Čižman M., Mrak J. et al. (2015) The influence of a sustained multifaceted approach to improve antibiotic prescribing in Slovenia during the past decade: findings and implications. Expert Rev. Anti Infect. Ther., Feb; 13(2): 279–89. doi: 10.1586/14787210.2015.990381. Epub 2014 Dec 13. PMID: 25495147.
- Klepser M.E., Adams A.J., Klepser D.G. (2015) Antimicrobial stewardship in outpatient settings: leveraging innovative physician-pharmacist collaborations to reduce antibiotic resistance. Health Secur. May–Jun; 13(3): 166–73.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим