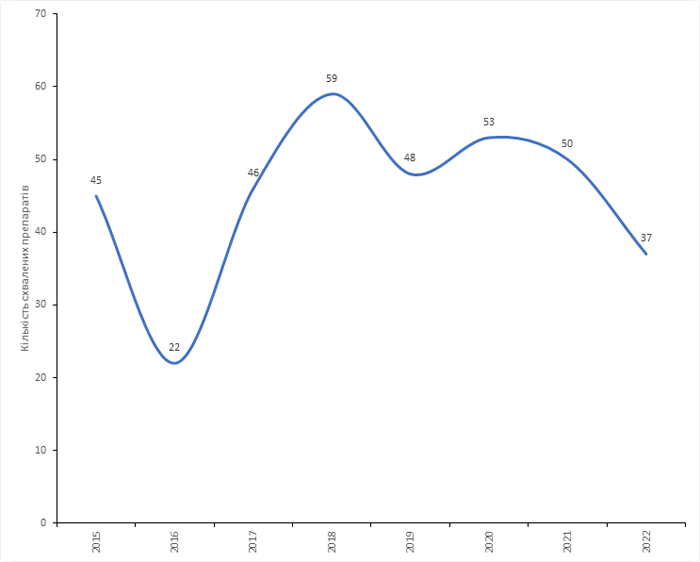
За підсумками 2022 р., Центр з оцінки та досліджень лікарських засобів (Center for Drug Evaluation and Research — CDER) у складі Управління з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) надав дозвіл на маркетинг 37 нових препаратів. Це нетипово для американського регулятора, який протягом останніх 5 років схвалював в середньому 51 препарат на рік. Востаннє подібне просідання у кількості наданих дозволів відзначали у 2016 р. (рис. 1).
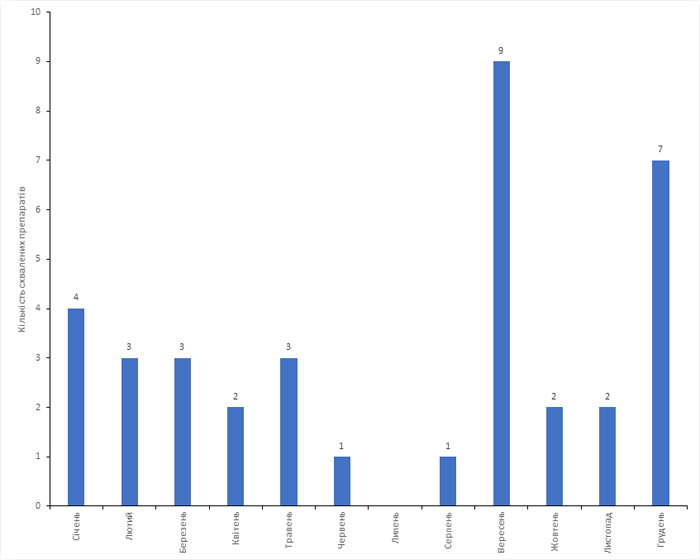
За I півріччя 2022 р. CDER схвалено 16 препаратів. З середини червня до середини серпня — жодного. Найбільш багатими на позитивні рішення стали вересень та грудень (рис. 2).
За кількістю лончів лідирують Bristol Myers Squibb (3) та Bluebird Bio (2).
Одним із найочікуваніших лончів стало схвалення препарату для контролю рівня глюкози в крові у дорослих з цукровим діабетом II типу Mounjaro (тирзепатид; Eli Lilly and Co). Лікарський засіб активує рецептори GLP-1 і GIP. Його вводять один раз на тиждень шляхом підшкірної ін’єкції. Дозу (5, 10 або 15 мг) коригують залежно від переносимості та досягнення цільового рівня глюкози в крові.
Схвалення отримав перший препарат для відтермінування розвитку цукрового діабету I типу Tzield (теплізумаб-mzwv; Provention Bio). Препарат вводять шляхом внутрішньовенної інфузії один раз на добу протягом 14 днів поспіль. Потенціал препарату затримувати клінічну діагностику цукрового діабету I типу може забезпечити пацієнтів від місяців до років без тягаря хвороби.
У 2022 р. CDER схвалено перший препарат для лікування дефіциту кислотної сфінгомієлінази. Це рідкісне захворювання, що може призводити до затримки психічного розвитку та смерті в ранньому дитячому віці — Xenpozyme (оліпудаза альфа; Genzyme). А також новий препарат від ВІЛ Sunlenca (ленакапавір; Gilead Sciences). Він відкриває новий клас антиретровірусних препаратів (інгібіторів капсиду) для лікування пацієнтів з ВІЛ, у яких закінчилися варіанти лікування (через резистентність, непереносимість або з міркувань безпеки).
За матеріалами www.fda.gov

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим