Анализ общего объема закупок Головного союза государственных больничных касс (GKV-Spitzenverband, далее — GKV) свидетельствует, что из каждого евро, потраченного на лекарственные средства, производитель получает только 50 центов. Вторая половина включает НДС (19%), разные скидки, оптовые и розничные наценки (InsightHealth; http://www.vfa.de ). Кстати, Германия — одна из немногих стран ЕС, взимающих с лекарств полную ставку НДС (выше она только в Исландии, Норвегии и Болгарии — соответственно, 25,5; 25 и 20%).
Курочка, несущая золотые яйца
Особая роль в «распределении труда» на фармацевтическом рынке принадлежит инновационным компаниям — двигателю не только прогресса, но и экономики. Они инвестируют в исследования и разработки (Research & Development — R&D) не менее 5 млрд евро ежегодно (5,5 млрд в 2015 г.) и выводят на рынок не менее 30 лекарственных средств с новыми действующими веществами (31 — в 2017 г.), отмечает Ассоциация исследовательских фармацевтических компаний Германии (Verband forschender Arzneimittelhersteller — VfA).
В 2015 г. инновационные компании, где каждый пятый сотрудник — исследователь, 13,2% объема продаж вложили в R&D (следом в рейтинге — аэрокосмическая промышленность с 8,6%) ( http://www.vfa.de ). Компания «Boehringer Ingelheim», к примеру, вообще каждый 5-й евро инвестирует в R&D, и ее годовой вклад в ВВП страны только в 2 раза меньше, чем у всего профессионального немецкого футбола (3,8 vs 7,9 млрд евро в 2014 г.) ( http://www.pharma-fakten.de ). Из всего мирового бюджета фармацевтических R&D на Германию приходится 6% (США — 43%, Япония — 11%) (рис. 1).
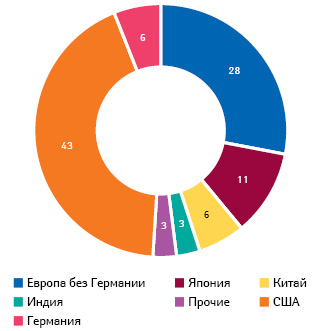
Да и в целом немецкая фармотрасль по объему выпускаемой продукции (в денежном выражении) занимает 2-е место в Европе после Швейцарии (EFPIA, 2015). При этом большая часть дохода фармотрасли генерируется за рубежом: в 2016 г. объем экспорта лекарственных средств составил 66,8% общего объема продаж в денежном выражении. И это, по большей части, оригинальные лекарственные средства, так как в обеспечении генерическими страны стараются полагаться на себя.
Поскольку инновационная направленность деятельности немецкой фармотрасли нуждается в поддержке, при выведении препарата на рынок применяют свободное ценообразование (уникальная для Европы практика), в то время как препараты, имеющие аналоги, поделены на кластеры с установленными референтными ценами (Festbetrag, «Еженедельник АПТЕКА», № 49 (1170) от 17 декабря 2018 г.). Однако с 2007–2008 гг. по инициативе страховых компаний стали разрабатывать методологию оценки стоимости/эффективности новых препаратов для установления возмещаемого уровня. В 2011 г. вступил в силу Закон о реорганизации фармацевтического рынка (Arzneimittelmarkt Neuordnungsgesetz — AMNOG). Положения нового закона применяют ко всем новым патентованным лекарственным средствам (за исключением орфанных, если GKV тратит на них менее 50 млн евро в год). От процедуры могут быть освобождены также препараты, аккумулирующие за год менее 1 млн евро затрат). Пока порог не преодолен, Федеральный объединенный комитет (Gemeinsamer Bundesausschuss — G-BA) предварительно оценивает степень терапевтической пользы, чтобы иметь дополнительный аргумент в переговорном процессе о закупочных ценах.
Festbetrag означает один из многих
Если препарат не относится к орфанным, производитель, свободно устанавливая его цену, к моменту лонча должен подать в G-BA досье с аргументами для обоснования «дополнительной терапевтической пользы» по отношению к уже одобренному препарату сравнения (действующий стандарт терапии) нового лекарственного средства (согласно SGB V):
- с новыми активными ингредиентами или новой комбинацией ранее существовавших;
- выходящих на рынок с новыми показаниями или с расширением существующих показаний в отношении нового круга пациентов или в связи со сменой терапевтического предназначения (для профилактики, лечения или диагностики);
- по просьбе фармацевтической компании, однако появление новых научных данных не накладывает на G-BA обязательств проводить новую оценку.
G-BA должен дать оценку новому препарату в срок до 3 мес, привлекая при необходимости Институт качества и экономической эффективности в здравоохранении (Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen — IQWiG) или третью сторону. Результат оценки публикуют и ждут реакции заинтересованных сторон. Производитель в установленные законом сроки также может подать дополнительные материалы.
В течение следующих 3 мес G-BA принимает обязательную резолюцию с указанием выраженности дополнительной пользы, численности пациентов, которым показано данное лечение, а также предполагаемого в связи с этим уровня затрат для SHI. Если препарат предоставляет дополнительное терапевтическое преимущество, производитель и GKV согласовывают цену в течение следующих 6 мес. Если стороны не достигают соглашения по указанному вопросу, ее устанавливают путем арбитража.
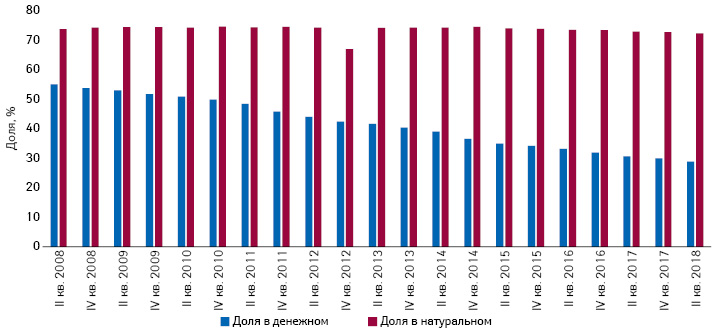
При отсутствии дополнительных терапевтических преимуществ по сравнению со стандартной терапией G-BA включает препарат в кластер для референтного ценообразования (Festbetrag). В 2018 г. в расходах GKV-SV на готовые лекарственные средства доля препаратов, объединенных в группы с референтными ценами (Festbetrag), составляет 71% в натуральном и 29% в денежном выражении (рис. 2). Если это невозможно по какой-либо причине, цену согласовывают точно также, как и в случае с препаратами, имеющими дополнительную терапевтическую пользу. При этом стоимость годичного курса лечения новым препаратом не должна превышать таковую для лекарственных средств, применявшихся ранее с той же целью.
Таким образом, в Германии в процесс оценки новых препаратов вовлечены две организации. Во-первых, G-BA со следующими полномочиями:
- решения относительно возмещения стоимости услуг здравоохранения;
- подготовка клинических руководств;
- определение показаний, при применении в соответствии с которыми будут возмещать стоимость безрецептурных препаратов;
- определение препаратов с недостающими доказательствами эффективности;
- исключение препаратов из числа возмещаемых;
- определение ценовых кластеров.
Во-вторых, созданный в 2004 г. Институт оценки качества медицинской помощи (Institute for Quality and Efficiency in Health Care-Home — IQWIG), — независимая организация, оценивающая качество и эффективность медицинских технологий и продуктов. С 2007 г. ее миссия включает также оценку стоимости/эффективности. IQWiG обычно проводит экспертизу по требованию G-BA, однако в роли заказчика могут выступать также представители пациентов. IQWiG, в штате которого состоит 140 сотрудников (половина — научные кадры), не разрабатывает руководства по клинической практике и не разрешает возмещение, но предоставляет доказательства для информированного принятия решений.
Выделяют 6 градаций наличия/отсутствия дополнительной терапевтической пользы:
- значительная, в случае достижения устойчивого и крупного улучшения в результатах лечения, не достигавшегося ранее при помощи препарата сравнения, в виде выздоровления, существенного удлинения продолжительности жизни, длительного отсутствия тяжелых симптомов или продолжительного избегания тяжелых осложнений;
- умеренная, выражающаяся, в частности, в уменьшении выраженности тяжелых симптомов, умеренного увеличения продолжительности жизни, «ослаблении» болезни по данным самоотчета пациента или относительном избегании тяжелых и других осложнений;
- минимальная, если наблюдают умеренное или незначительное улучшение, в частности, уменьшение выраженности нетяжелых симптомов или относительное избегание побочных эффектов;
- дополнительная польза не подлежит учету, поскольку имеющиеся научные данные не позволяют оценить ее количественно;
- отсутствие доказанной дополнительной пользы;
- польза меньше, чем у препарата сравнения.
Наличие пользы оправдывает двойную цену
Если новый препарат имеет дополнительную терапевтическую пользу, GKV-SV и фармацевтическая компания должны согласовать цену возмещения, основываясь на оценке G-BA и принимая во внимание годичную стоимость терапии другим сравнимым лекарственным средством и цены (производителя) в других европейских странах, о которых сообщает компания. О согласованной возмещаемой цене GKV обязана уведомить зонтичную организацию частных страховщиков. Согласованные цены применяют со 2-го года, то есть с 13-го месяца после выведения препарата на рынок. Обе стороны соглашения могут от него отказаться, но не ранее чем через 1 год после его заключения.
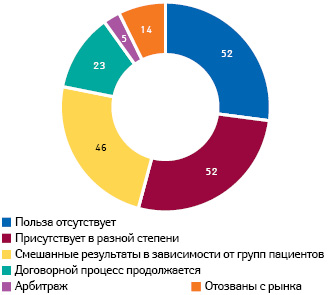
С января 2011 по май 2018 г. G-BА выполнил 307 оценок дополнительной терапевтической пользы лекарственных средств и опубликовал соответствующие резолюции. К 15 августа 2017 г. процесс согласования цен возмещения завершен относительно 150 лекарственных средств на основании следующих заключений G-BA: об отсутствии дополнительной пользы и о ее наличии (по 52 заключения), смешанные результаты, отличающиеся в разных группах пациентов (46 препаратов). Относительно 23 препаратов согласование цены еще не завершено, 5 — идет процесс арбитража и 14 отозваны с рынка еще до завершения процесса согласования (рис. 3). Препараты со смешанными результатами показали отсутствие дополнительной пользы в 69% подгрупп пациентов, минимальную пользу — в 12% подгрупп, умеренную — в 14% и значительную — менее чем в 1% подгрупп; а в 4% пользу невозможно выразить количественно (von Stackelberg et al., 2017). Среди орфанных препаратов польза не поддавалась исчислению в 57% подгрупп пациентов.
Невозможность количественного определения пользы в ряде случаев стала следствием принципиального нежелания фармацевтических компаний подавать полное досье из опасений ухудшить свои переговорные позиции при согласовании цены. Санкции за такое недобросовестное сотрудничество действуют с мая 2017 г., когда Законом о повышении надежности лекарственного обеспечения (Gesetz zur Stärkung der Arzneimittelversorgung — AMVSG) предусмотрено разграничение между случаями с невозможностью количественной оценки дополнительной пользы. В тех случаях, когда ответственность за это лежит на производителе, вовремя не подавшем полное досье, цену на препарат устанавливают на уровне, обоснованно более низком, чем у препарата сравнения. Опубликованные решения ( www.g-ba.de/informationen/nutzenbewertung ) относятся в основном к препаратам (преобладают биотехнологические), которых нет на рынке Украины. Среди остальных можно отметить, к примеру, не показавшие дополнительных преимуществ как в виде моно-, так и комбинированной терапии саксаглиптин, ситаглиптин и видаглиптин; указаны только некоторые комбинации для применения у отдельных групп пациентов, для которых в дальнейшем может быть установлена некоторая польза. В то же время комбинация ледипасвира и софосбувира в большей части групп (3 из 4) показала значительную дополнительную пользу; а софосбувира с велтапасвиром, а также с воксилапревиром в большей части групп — нет. Напротив, у тикагрелора — значительное дополнительное преимущество по сравнению с клопидогрелем/ацетилсалициловой кислотой.
В недавнем исследовании всех цен, согласованных G-BA в период 2011–2016 гг., установлено, что у препаратов с дополнительной пользой согласованная цена в среднем на 230% выше по сравнению с препаратом сравнения (Lauenroth & Stargardt, 2017). Наибольшая разница в цене у препаратов, продемонстрировавших пользу в отношении смертности (620%), уменьшения выраженности симптомов (170%) и частоты развития осложнений (93%). Препараты, не продемонстрировавшие дополнительной пользы, не получили более выгодных по сравнению с компараторами цен.
Средняя ежегодная стоимость лечения запатентованными лекарственными средствами — около 2500 евро*. Но это еще не такая большая сумма по сравнению со стоимостью лечения препаратами, выведенными на рынок в 2017 г. (всего — 34 препарата). Годичный курс терапии 24 новыми лекарственными средствами обходится более чем в 20 тыс. евро; 13 из них — более чем в 60 тыс. евро; 7 — более 100 тыс. евро. При этом, отмечает Ульрих Швабе (Ulrich Schwabe), многолетний автор «Arzneiverordnungs-Report», далеко не во всех случаях прослеживается четкая связь между ценой и добавленной пользой, и AMNOG, похоже, не в состоянии справиться с высокими издержками в связи с использованием запатентованных лекарств (там же).
Таким образом, одна из главных черт зрелого фармацевтического рынка — значительная, в десятки раз, разница в стоимости генерических и запатентованных лекарственных средств, реинвестируемая в исследования и разработки.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим