Вступне слово
Відкрив 14-й Європейський конгрес ISPOR «Раціональні рішення в охороні здоров’я в часи економічних викликів» президент ISPOR на 2001–2012 рр. Марк Скулпер (M. Sculpher), професор Центру економіки здоров’я Йоркського університету (Велика Британія). Він окреслив перспективи розвитку наукових, освітніх і практичних напрямів діяльності ISPOR та 52 регіональних відділів цієї організації. Участь у форумі взяли більше 3000 учасників.
Перша пленарна сесія конгресу була присвячена темі «За і проти централізованого європейського агентства з ціноутворення та відшкодування вартості лікарських засобів». Про доцільність та переваги централізованого підходу визначення розміру відшкодування витрат на лікарські засоби йшла мова в доповіді професора Ганса-Георга Айхлера (Hans-Georg Eichler), експерта з Європейського агентства лікарських засобів (European Medicines Agency — ЕМА).
Однією з глобальних цілей Європейського союзу (ЄС), створеного в 1993 р., є інтеграція процесів, спільних для всіх його країн-членів. Так, ЕМА є відповідальним за процес видачі дозволу на маркетинг медичних технологій (лікарських засобів) у країнах ЄС. Дозвіл, який видає ЕМА, є дійсним у 27 країнах ЄС. Багато процесів з оцінки нових лікарських засобів, медичних приладів та діагностичних процедур схожі в багатьох країнах ЄС, так само, як соціальна, економічна та політична база систем охорони здоров’я. Проте на даний час централізованої процедури оцінки медичних технологій, ціноутворення та відшкодування вартості ліків в ЄС не існує. Головними перешкодами при створенні єдиного підходу та єдиного агентства з оцінки медичних технологій є відмінності у рекомендованих до застосування методах, виконавцях економічних досліджень (виробник чи третя сторона), наявності ресурсів, а також більша довіра до локальних даних серед осіб, що приймають рішення щодо відшкодування вартості ліків.
Доповідач навів приклад відмінності у прийнятих рішеннях щодо компенсації вартості при однакових доказових даних на препарат пазопаніб у різних країнах ЄС. У той час, як Іспанія, Німеччина, Нідерланди, Португалія, Словаччина та Швеція повністю відшкодовують витрати на лікування пазопанібом, п’ять країн ЄС (Австрія, Данія, Франція, Норвегія, Польща) не внесли цей препарат до позитивного переліку або відшкодовують його закупівлю лише на індивідуальній основі. Інші країни (Бельгія, Чехія, Великобританія, Фінляндія) відшкодовують витрати на цей препарат із певними обмеженнями або частково. Суттєва відмінність у компенсації витрат на препарат свідчить про необхідність координації процесів прийняття рішень. Першим кроком до цього має стати гармонізація методології оцінки порівняльної терапевтичної цінності та економічної ефективності, насамперед, лікарських засобів. Наступним кроком має бути повна гармонізація усіх процедур з оцінки медичних технологій для найбільш витратних із них.

Альтернативну думку щодо створення єдиної процедури внесення лікарських засобів до позитивних чи негативних переліків у країнах ЄС представив директор офісу з економіки охорони здоров’я Великобританії Адріан Тоусе (A. Towse). При проведенні економічної оцінки використовують показники порівняльної ефективності та порівняльних затрат медичних технологій. Обидва ці параметри можуть значно відрізнятися в різних країнах ЄС. Показник порівняльної ефективності препаратів може змінюватись через різні цільові популяції пацієнтів, методики аналізу, альтернативні стратегії лікування. Узагальнення та гармонізація методів із визначення показника відносної ефективності є першим необхідним кроком, що дозволить уникнути повторення даних, покращити якість оцінок у деяких країнах, зберегти час та фінансові ресурси.
Суттєвими є відмінності в ціноутворенні на лікарські засоби в країнах ЄС. Найбільш ефективним методом ціноутворення, що дозволяє забезпечити найкращий доступ пацієнтів до ліків, є «бажання платити», що суттєво відрізняється залежно від соціально-економічної позиції країни. Усереднення ціни препарату в ЄС буде перешкоджати як доступу пацієнтів до лікування, так і розвитку інновацій на фармацевтичному ринку. Враховуючи неможливість встановлення єдиної цінової політики в регіоні, оптимальним є визначення єдиного кваліфікованого агентства з виявлення відносної ефективності медичних технологій, але визначення показника «витрати-ефективність» має проводитися в кожній із 27 країн — членів ЄС індивідуально.
Необхідності та перспективі використання реальних прагматичних даних для прийняття рішень в охороні здоров’я було присвячено другу пленарну сесію. У ході цієї сесії в дискусії взяли участь Леслі Левін (L. Levin), голова медичної ради з якості в охороні здоров’я штату Онтаріо, Канада; Патрік Кеоган (Р. Keohane), віце-президент «Астра-Зенека», Швеція; Енріке Бернал-Делгадо (Е. Bernal-Delgado), голова Інституту Арагони з досліджень в охороні здоров’я. Незалежно від системи охорони здоров’я платники різних країн приходять до єдиної думки щодо необхідності врахування таких аспектів, як відносна клінічна, економічна ефективність, доступність, оптимізація бюджету, порівняльна раціоналізація та потреби пацієнта при забезпеченні реімбурсації медичної технології. Використання реальних даних дозволить визначити забезпеченість медичними технологіями в різних населених пунктах, нераціональне використання технологій та можливість до покращення медичних послуг.
Оскільки прагматичні клінічні дослідження порівнюють терапевтичні опції, що застосовуються в дійсній клінічній практиці, такі аналізи краще задовольняють потреби пацієнтів, клініцистів та політиків. Складність організації та проведення таких досліджень, що пов’язана з необхідністю мотивації залучення до співпраці практикуючих лікарів та пацієнтів, обмежує на даний час широке застосування аналізів реальних даних.
На третьому пленарному засіданні обговорювалося питання неоднорідності (гетерогеності) при визначенні ефективності витрат на медичні втручання. Свої доповіді представили Карл Клекстон (K.C. Claxton), професор та головний дослідник Йоркського університету, Андреас Гербер (A. Gerber), голова відділу економіки в охороні здоров’я Інституту якості й ефективності охорони здоров’я в Німеччині (IQWiG) та Грег Россі (G. Rossi), віце-президент «AstraZeneca».
Явище гетерогенності для популяції – це її розподіл на субпопуляції не за основною ознакою (наявність чи відсутність захворювання, що є об’єктом втручання), а за додатковими ознаками – маркерами (вік, стать, приналежність до певної групи ризику, супутні захворювання, генетичні особливості тощо), наявність яких може суттєво впливати на результат (кореляція має бути доведена). У практиці це означає, що доведена загальна клінічна чи економічна ефективність застосування тієї чи іншої медичної технології для популяції в рандомізованому клінічному дослідженні не дає змоги гарантувати досягнення відповідного рівня ефективності після застосування даної медичної технології для різних субпопуляцій у реальній практиці.
Наприклад, результати дослідження RITA-3, у якому порівнювали економічну ефективність інвазивної та консервативної стратегії лікування пацієнтів із гострим коронарним синдромом без підйому сегмента ST, свідчать, що інвазивна стратегія є економічно ефективною тільки в підгрупі пацієнтів групи високого ризику. Також яскравим прикладом є результати дослідження BRIM3, у яке включали пацієнтів із метастатичною меланомою та позитивною реакцією тесту на наявність мутації гена BRAF V600 (біомаркер). У групі пацієнтів, що отримували селективний інгібітор BRAF V600, досягнуто значного поліпшення показників виживання порівняно зі стандартною терапією.
Для вирішення проблеми забезпечення представників різних субпопуляцій ефективними медичними технологіями рекомендують проводити пост-хок-аналізи результатів уже проведених досліджень, клінічні дослідження з подвійною рандомізацією (Double Randomized Clinical Trials) для виявлення факту і ступеня залежності між маркером та терапевтичним результатом (рисунок).
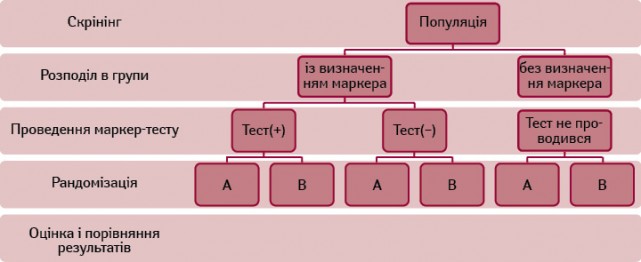
Також на сесії обговорювалося питання гетерогенності даних доказової медицини у вигляді метааналізів, що пропонують інформацію високого ступеня узагальненості. До складу метааналізів входять результати досліджень, які відрізняються за кількісним і якісним складом популяції, дозами, схемами основного та супутнього лікування, тривалістю спостереження за станом хворих, методами статистичного аналізу та оцінки результатів, тому перед здійсненням екстраполяції результатів метааналізів на реальну популяцію, щодо якої приймається рішення, необхідно ретельно оцінювати ступінь гетерогенності та впливу тих чи інших чинників на часткові результати (у межах окремого дослідження, субпопуляції, схеми лікування, режиму дозування тощо), із яких складається сукупне (середнє) значення показника ефективності (відносної ефективності )в метааналізі.
Форум Українського відділу ISPOR
Уперше в рамках програми 14-го конгресу відбувся форум Українського відділу ISPOR (Ukranian Society for Pharmacoeconomics and Outcomes Research – USPOR), у якому взяли участь представники охорони здоров’я та вищих навчальних закладів Києва (професор А. Степаненко, О. Мендрік, В. Толубаєв), Львова (професор О. Заліська, кандидат фармацевтичних наук Ю. Майнич), Тернополя (кандидат фармацевтичних наук, доцент М. Лелека), Харкова (професор Л. Яковлєва, доктор фармацевтичних наук, доцент О. Міщенко, кандидат фармацевтичних наук, доцент О. Герасимова) та виконавчий асистент Надія Малдонадо, США, яка представляла керівництво ISPOR.
На форумі з доповідями виступили професор Львівського національного медичного університету імені Данила Галицького Ольга Заліська, голова Українського відділу ISPOR. Вона озвучила історичні аспекти міжнародної співпраці з ISPOR, започаткованої в 2001 р. Львівським національним медичним університетом імені Данила Галицького. Також було створено систему неперервної освіти провізорів із фармакоекономіки на до- та післядипломному етапах та розглянуто напрями використання фармакоекономічних результатів при впровадженні формулярної системи в Україні.
Професор Лариса Яковлєва, завідувач кафедри фармакоекономіки Національного фармацевтичного університету (Харків), розповіла про напрями діяльності кафедри фармакоекономіки й підготовки студентів за спеціальністю «Клінічна фармація» з питань фармакоекономічного аналізу.
Професор Алла Степаненко, радник міністра охорони здоров’я, перший заступник голови Центрального формулярного комітету МОЗ України, представила етапи створення й впровадження стандартів та клінічних протоколів надання медичної допомоги, які завдяки політиці МОЗ України гармонізовані з вимогами ЄС та висвітлила питання створення Державного формуляра лікарських засобів, впровадження формулярної системи в охороні здоров’я України.
В’ячеслав Толубаєв, голова Українського студентського відділу ISPOR, звернув увагу на напрями залучення студентів до міжнародної співпраці в галузі фармакоекономічних досліджень.
Слід зазначити, що Український студентський відділ ISPOR — єдине студентське фармакоекономічне товариство, яке діє на території східноєвропейських країн. Тому особливо приємно, що в програму стендових презентацій 14-го Євроконгресу ISPOR було включено три студентські доповіді від аспірантів Львівського національного медичного університету імені Данила Галицького про результати фармакоекономічних досліджень в Україні, зокрема, дві праці В. Толубаєва на теми «Оцінка витрат на лікарські засоби для лікування хронічних обструктивних захворювань легень за даними призначень лікарів», «Аналіз прямих і непрямих витрат на лікування хронічних обструктивних захворювань легень за даними пілотного дослідження», та О. Мендрік на тему «Витрати на лікування множинної мієломи в Україні».
Під час форуму Українського відділу ISPOR прозвучали доповіді О. Міщенко, доцента Національного фармацевтичного університету (Харків) про підготовку кадрів, що вивчають методи фармакоекономіки, та В. Бочарової, магістра кафедри соціальної фармації, про фармакоекономічні методи аналізу при лікуванні системних дерматологічних захворювань.
Особливо цікавим виявився спільний форум України, Росії та Білорусі, який вперше відбувся в рамках 14-го Конгресу, на тему «Інструменти оцінки медичних технологій в охороні здоров’я: досвід Росії, України та Білорусі», проведений англійською мовою. У форумі взяли участь Мерилін Дікс (Marylin Dix Smith), виконавчий директор ISPOR, США, яка є засновником та ідейним натхненником ISPOR, та Надія Малдонадо, виконавчий асистент цієї організації.
Учасниками форуму стали члени регіональних відділів ISPOR Росії (професор В. Омеляновський, голова НТА-відділу), України (професор О. Заліська, голова) та Білорусі (доктор В. Матвеєв, голова). У цих країнах немає офіційних установ, агентств з оцінки медичних технологій, проте певні інструменти оцінки медичних технологій використовуються при реалізації страхового чи формулярного забезпечення населення лікарськими засобами. Були представлені дві доповіді від Російської Федерації про напрями страхового забезпечення хворих та відбору ліків до позитивного переліку. Про використання методів оцінки медичних технологій в Україні на прикладі реалізації Державних програм в онкології та діабетології фахово представила Олена Мендрік, яка проводить фармакоекономічні дослідження.
Друга доповідь В. Толубаєва була присвячена питанню фармацевтичної допомоги пільговим категоріям населення, особам, які постраждали від аварії на ЧАЕС, та ветеранам війни на прикладі формулярного забезпечення лікарськими засобами в Київській області. Від Білорусі було представлено доповідь про напрями соцільної допомоги населенню та етапи створення Переліку основних і життєво необхідних лікарських засобів. Обмін досвідом та ідеями під час форуму слов’янських країн був корисним і запам’ятався позитивними емоціями.
Насиченими за обміном думками були форуми інших східноєвропейських країн (Польща, Угорщина, Чехія, Словенія), які також мають обмежені бюджети на галузь охорони здоров’я. Тому й не дивно, що їх учасники активно обговорювали питання що краще — поліпшувати якість управлінських рішень щодо фінансування програм в охороні здоров’я чи просто посилювати заходи щодо стримування витрат на фармацевтичну допомогу. Реалізація програм на основі доказової медицини і фармакоекономіки є більш складною, проте має значні вигоди в довгостроковій перспективі щодо збільшення тривалості життя, підвищення його якості та зниження захворюваності, смертності населення.
Традиційно проводилися стендові сесії, на яких вчені з різних країн ділилися результатами фармакоекономічних досліджень, проведених там. Від України в програму стендових сесій було включено ще чотири роботи науковців Львівського національного медичного університету імені Данила Галицького (О. Заліська, Ю. Майнич) та Національного фармацевтичного університету (О. Яковлєва, Н. Бездітко, О. Міщенко, О. Герасимова).
Також інформаційно насиченим було засідання керівників, членів агентств, організацій з оцінки медичних технологій, участь у якому взяли від України професор А. Степаненко та професор О. Заліська. На цій нараді було детально представлено досвід Британії та напрями діяльності Національного інституту з визначення клінічних переваг (NICE) Німеччини, де діє Інститут з оцінки якості та ефективності в охороні здоров’я (IQWIG), який займається питаннями впровадження інтегрованих даних доказової медицини і фармакоекономічного аналізу в реальну практику, при перегляді формуляра чи позитивного списку ліків. Було прийнято рішення щодо вироблення інтегрованих рекомендацій із багатофакторного аналізу доказових та реальних даних ефективності та економічної ефективності медичних технологій.
У рамках 14-го конгресу ISPOR «Оцінка медичних технологій — нарада круглого столу» обговорювалися питання впровадження оцінки медичних технологій на національному рівні, досягнення та виклики часу, існуючі перешкоди. Головував на засіданні Андерс Ламарк Туссе (Anders Lamark Tysse), відповідальний за політику відділу систем охорони здоров’я спільного Директорату з питань здоров’я та питань споживачів Європейської Комісії.

На засіданні виступили представники багатьох європейських країн: Австрії, Хорватії, Фінляндії, Нідерландів, Ірландії, Сербії, Словакії, Словенії, Греції, Італії, а також Росії та Казахстану. Від України доповідь «Оцінка медичних технологій в Україні» представила професор А. Степаненко. У доповіді були озвучені результати напрацювань Державного експертного центру МОЗ України (директор В.Є. Бліхар), на базі якого створено Центральний формулярний комітет МОЗ України (голова А.М. Морозов), де безпосередньо були отримані перші результати застосування принципів оцінки медичних технологій для формування Державного формуляра лікарських засобів (алгоритм відбору лікарських засобів до Державного формуляра лікарських засобів на основі аналізу третинних джерел доказової інформації – клінічних настанов, вторинних та первинних джерел інформації (пошук необхідної інформації в таких ресурсах, як HANARI, Medline, PubMed), подальша оцінка отриманих даних за стандартними листами оцінки SIGN, експертиза та прийняття обґрунтованого рішення).
Окремі елементи оцінки медичних технологій в Україні використовуються для розробки медичних стандартів та клінічних протоколів медичної допомоги на принципах доказової медицини за уніфікованою методикою, а саме оцінка третинних джерел доказової інформації (клінічних настанов) за допомогою інструменту експертизи і атестації клінічних настанов для уніфікованої оцінки їх якості (Appraisal of Guidelines Research and Evaluation — AGREE).
У перспективі розвитку оцінки медичних технологій в Україні має поглиблюватися та розвиватися порівняльний аналіз альтернативних методів лікування в контексті медичних ризиків та користі, економічних, соціальних та етичних складових. Ця доповідь надзвичайно зацікавила представників різних країн світу.
Усім учасникам конгресу запам’яталася тепла атмосфера наукових дискусій. Також незабутнє враження справило знайомство з Мадридом. Це місто митців, художників, творіння яких зберігаються у всесвітньо відомих музеях Прадо й Тіссен. Місто вразило величавими королівськими палацами, надзвичайно широкими площами й вулицями, де панують спокій і чистота, а привітні та щирі іспанці завше радо допомагають пізнати свою культурну спадщину, яку бережуть і примножують.
Хочеться вірити, що робота та обмін науковими, освітніми й практичними здобутками в галузі оцінки медичних технологій та фармакоекономіки під час 14-го Конгресу ISPOR були корисними та сприятимуть реалізації принципів оцінки медичних технологій, поліпшенню якості медичної й фармацевтичної допомоги в кожній країні.
Ю.В. Майнич, М.В. Лелека;
фото авторів

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим