|
|
Как отметил Ю. Подпружников, выступая перед собравшимися, сертификация на соответствие требованиям GMP и GDP — составная реформирования сферы обращения лекарственных средств в Украине. Для этого совершенствуются соответствующие нормативно-правовое поле, нормативно-техническая база, а также создан орган инспектирования — Инспекторат GMP.
Признание сертификата GMP состоит в процедуре подтверждения Государственной службой соответствия сертифицированного иностранного производства лекарственных средств действующим в Украине правилам GMP. Эта процедура предусматривает, что иностранный производитель, который желает, чтобы его сертификат GMP был признан в Украине, подает в Государственную службу комплект документов, отвечающий требованиям инспекторатов GMP европейских стран. В этот комплект документов входит общий перечень номенклатуры продукции; досье производственного участка, копия сертификата соответствия требованиям GMP определенного производственного участка, выданного соответствующим государственным органом страны, где расположено производство; отчет последней проверки производственного участка государственным органом страны, где расположено производство; при наличии — копии сертификатов производственного участка, которые указаны в заявлении и выданы государственными органами других стран. Указанные документы подлежат экспертизе, а затем проводится инспектирование предприятия.
Процедура признания сертификата может осуществляться и без проведения инспектирования, если сертифицированное производство расположено на территории страны — члена международной системы сотрудничества фармацевтических инспекций (PIC/S). По словам Ю. Подпружникова, планируется, что эта норма также будет касаться стран ІСН, то есть Европейского Союза, США и Японии. Если же предприятие расположено на территории стран, которые не входят в PIC/S, то для признания сертификата предприятие подлежит инспектированию украинским Инспекторатом GMP.
Таким образом, после введения в действие постановления производитель, который получил подтверждение сертификата, освобождается от посерийного лабораторного контроля. Продукция производителя, который не получил такого признания или не имеет сертификата GMP, будет подлежать полному посерийному лабораторному контролю в соответствующих аккредитованных лабораториях по всем показателям качества, указанным в нормативно-аналитической документации.
Подробно остановившись на положениях проекта Порядка государственного контроля качества лекарственных средств в случае их ввоза в Украину, С. Сур отметил, что целью Порядка является предотвращение реализации в Украине незарегистрированных, субстандартных и фальсифицированных лекарственных средств (с учетом требований Программы борьбы с производством и распространением фальсифицированных лекарственных средств на 2003–2008 гг., утвержденной постановлением Кабинета Министров Украины от 17.07.03 г. № 1075). Среди особенностей Порядка он выделил дифференцированный подход к контролю импортных лекарственных средств в зависимости от наличия сертификата GMP, выданного или признанного Государственной службой.
|
В Порядке предложен следующий механизм: органы государственного контроля лекарственных средств в определенный срок получают от субъекта хозяйствования сообщение о ввозе лекарственных средств в Украину и осуществляют государственный контроль их качества, четко определив параметры такого контроля и сроки его проведения. После завершения контроля груз находится не на таможенном складе, а на складе субъекта хозяйствования, который обеспечивает надлежащие условия хранения лекарственных средств и, если необходимо, осуществляет отбор проб для проведения их лабораторного анализа. По словам С. Сура, Порядок планируется ввести в действие с 1 ноября 2005 г.
Для начала процедуры, предусмотренной Порядком, в течение 3 рабочих дней после окончания таможенного оформления груза субъект хозяйствования подает в орган государственного контроля по месту проведения хозяйственной деятельности заявление установленного образца о выдаче заключения о качестве лекарственного средства, ввезенного на территорию Украины.
В пакет документов, которые сопровождают заявление, входят копия лицензии на проведение соответствующего вида хозяйственной деятельности; перечень ввезенных лекарственных средств; сертификат качества на каждую серию лекарственного средства; копия сертификата соответствия требованиям GMP, признанного Госслужбой (при наличии); копия инвойса с отметкой таможенного органа.
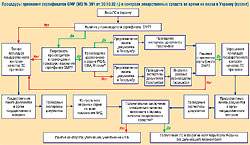 |
Государственный контроль качества ввезенных в Украину лекарственных средств включает экспертизу документов, представленных субъектом хозяйствования. В случаях, предусмотренных Порядком, осуществляются отбор образцов лекарственного средства, организация и проведение лабораторного анализа их качества на соответствие требованиям АНД. Процедура контроля завершается оформлением и выдачей заключения о качестве ввезенного в Украину лекарственного средства.
Независимо от наличия подтвержденного Госслужбой сертификата GMP, лабораторному анализу на соответствие требованиям АНД подлежат образцы таких лекарственных средств: с поврежденной упаковкой; относительно которых нарушены условия транспортирования или хранения; несоответствующих установленным требованиям по результатам визуального контроля; имеющих признаки фальсификации, выявленные во время визуального контроля или о которых сообщали органы государственного контроля. Кроме того, лабораторный анализ проводится в случае, если оборот других серий лекарственного средства был запрещен в установленном порядке органами государственного контроля, а также в соответствии с решениями или распоряжениями органов государственного контроля.
Наличие положительного заключения о качестве ввезенного в Украину лекарственного средства открывает путь к его свободному обороту на всей территории Украины. Напротив, отрицательный вывод является основанием для проведения дальнейших действий в соответствии с условиями внешнеэкономических контрактов и/или нормативно-правовых актов (изъятие из обращения, утилизация, уничтожение и т. п.). При этом органы государственного контроля выдают предписание или принимают решение о временном прекращении оборота, изъятии лекарственного средства из оборота и предпринимают дальнейшие действия в соответствии с действующим законодательством.
По итогам встречи Комитет по вопросам здравоохранения ЕБА подготовил свои комментарии и предложения по поводу Порядка.
Воспринимая позитивно предлагаемые властями меры по созданию препятствий для поступления в страну препаратов низкого качества из стран, не входящих в PIC/S, Комитет выразил определенные опасения в связи с возможным ростом цен на импортные препараты за счет необходимости отвлечения оборотных средств оптовых компаний на финансирование стоимости товаров, находящихся под контролем или в карантине в течение почти 1 месяца. Доработка Порядка позволит исключить вопросы возможной дискриминации продукции иностранных производителей в сравнении с препаратами украинского производства и устранить регуляторные несогласованности между Украиной и ЕС в части процедуры признания сертификатов GMP.
Отдавая должное стремлению правительства Украины к защите украинского фармацевтического рынка от низкокачественной продукции и внедрению эффективных мер с целью решения этого вопроса путем повышения стандартов и гармонизации с мировой практикой, Комитет предложил:
— для производителей, расположенных в странах PIC/S, США и Японии, включая собственные производственные мощности транснациональных компаний, расположенные вне стран PIC/S, определить единую упрощенную процедуру признания сертификатов GMP, основываясь на заявлении производителя, сертификате соответствия GMP (Certificate of Compliance of a Manufacturer of Pharmaceutical Products), выданного уполномоченным органом страны-производителя и информационного файла места производства на английском языке;
— при импорте продукции из стран PIC/S, США и Японии определить в качестве обязательного 3-дневный срок (после прохождения таможенного оформления фармацевтической продукции) для направления субъектом хозяйственной деятельности заявления в орган государственного контроля для выдачи заключения, а 5-дневный срок в качестве обязательного для выдачи уполномоченными органами фармацевтического контроля положительного заключения или обоснованного назначения лабораторных тестов за счет заявителя, но при условии обеспечения всеми материалами, реактивами и оснащения со стороны органов государственного контроля и выполнения анализов в десятидневный срок;
— отменить необходимость предоставления в уполномоченный орган государственного контроля качества лекарств коммерческой информации, в частности инвойсов, поскольку такой контроль находится вне компетенции этого органа;
— отложить введение в действие обсуждаемого порядка до 01 января 2006 г.
Комитет уверен в конструктивном подходе властей к этим предложениям, будущем взаимоприемлемом решении и быстром внедрении согласованного Порядка с целью защиты рынка и здоровья потребителей. n
|
СПРАВКА |
|
|
Николай Холоденко,
фото Игоря Кривинского



Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим