РОЗПОРЯДЖЕННЯ
від 14.10.2014 р. № 19432–1.3/2.1/17–14
У відповідності до Конституції України, ст. 15, ст. 22, ст. 55 Закону України «Основи законодавства України про охорону здоров’я», ст. 15, ст. 21 Закону України «Про лікарські засоби», Положення про Державну службу України з лікарських засобів, затвердженого Указом Президента України від 08.04.2011 № 440, п.п. 3.2., 3.2.2. «Порядку встановлення заборони (тимчасової заборони) та поновлення обігу лікарських засобів на території України», затвердженого наказом МОЗ України від 22.11.2011 за № 809 (зі змінами), зареєстрованого Міністерством юстиції України від 30.01.2012 за № 126/20439, та на підставі підтвердження ПАТ «Вітаміни» факту фальсифікації лікарського засобу КАРСИЛ®, таблетки, вкриті оболонкою, по 22,5 мг № 80, серії 2031013, з маркуванням виробника АТ «Софарма», Болгарія; АТ «Болгарська роза — Севтополыс», Болгарія, (за інформацією АТ «Софарма», Болгарія), ЗАБОРОНЯЮ реалізацію, зберігання та застосування лікарського засобу КАРСИЛ®, таблетки, вкриті оболонкою, по 22,5 мг № 80, серії 2031013, з маркуванням виробника АТ «Софарма», Болгарія; АТ «Болгарська роза — Севтополыс», Болгарія, який має ознаки фальсифікації:
«Маркування»:
- на боковому ребрі пачки, де наведена інформація щодо виробників, виявлена наступна орфографічна помилка у слові «Севастополыс» (в оригінальному зразку — «Севастополіс»);
- в наведенні інформації щодо лікарського засобу за допомогою шрифту Брайля, а саме: у слові «Карсил®» — літера «Л» та у слові «Таблетка» літера «Т» — не відповідають алфавіту, а саме:
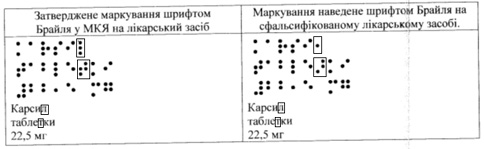 Суб’єктам господарювання, які здійснюють реалізацію, зберігання та застосування лікарських засобів, невідкладно після одержання даного розпорядження перевірити наявність лікарського засобу КАРСИЛ®, таблетки, вкриті оболонкою, по 22,5 мг № 80, серії 2031013, з маркуванням виробника АТ «Софарма», Болгарія; АТ «Болгарська роза — Севтополыс», Болгарія, з вищезазначеними ознаками фальсифікації і вжити заходи щодо його вилучення з обігу шляхом знищення.
Суб’єктам господарювання, які здійснюють реалізацію, зберігання та застосування лікарських засобів, невідкладно після одержання даного розпорядження перевірити наявність лікарського засобу КАРСИЛ®, таблетки, вкриті оболонкою, по 22,5 мг № 80, серії 2031013, з маркуванням виробника АТ «Софарма», Болгарія; АТ «Болгарська роза — Севтополыс», Болгарія, з вищезазначеними ознаками фальсифікації і вжити заходи щодо його вилучення з обігу шляхом знищення.
Суб’єкту господарювання, при наявності вказаного лікарського засобу, повідомити територіальний орган Держлікслужби України за місцем розташування про вжиті заходи щодо виконання даного розпорядження. У разі знищення відходів лікарського засобу, в двотижневий строк направити до територіального органу Держлікслужби України за місцем розташування копію акта про знищення відходів лікарського засобу. При наступних поставках лікарського засобу суб’єкт господарювання повинен вжити заходів щодо запобігання придбанню, реалізації та застосуванню лікарського засобу, наведеного в даному розпорядженні.
Контроль за виконанням даного розпорядження здійснюють територіальні органи Держлікслужби України за місцем розташування.
Невиконання даного розпорядження тягне за собою відповідальність згідно чинного законодавства України.
| Заступник Голови |
А.Д. Захараш |

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим