

Науково-освітній департамент «Щотижневика АПТЕКА» продовжує публікацію авторського циклу статей професорів Національного фармацевтичного університету Івана Матвійовича Перцева та Олени Анатоліївни Рубан , присвяченого допоміжним речовинам та їх значенню у виробництві ліків (початок див. «Щотижневик АПТЕКА» № 2 (973) від 19.01.2015 р.).
Бурхливий розвиток наук, що мають відношення до фармації, дозволив фармакотехнологам у співпраці з іншими фахівцями створювати ліки принципово нового типу, які мають спрямовану лікувальну дію та задані кінетичні властивості. Ці ліки, на відміну від традиційних, характеризуються: пролонгованою дією; контрольованим вивільненням активних речовин; цільовим транспортуванням до органа-мішені. Ліки нового покоління прийнято називати терапевтичними системами, які повністю або частково відповідають вищеназваним характеристикам.
Терапевтична система (ТС) — це особлива форма доставляння ліків у організм, яка не розпадається відразу після її введення, а функціонує протягом певного періоду, необхідного для лікувальної дії, забезпечуючи тривале вивільнення активної речовини з певною швидкістю надходження в організм. Зазвичай це пристрої, що містять активну речовину, властивості або елемент, що контролюють її вивільнення за певною терапевтичною програмою, та платформу, на якій розміщена система. ТС, що забезпечують цілеспрямований транспорт активних фармацевтичних інгредієнтів (АФІ), складаються з трьох основних компонентів: носій (біосумісний природний або синтетичний полімер), активна речовина, приєднана до носія або додана до нього, та специфічна речовина (речовини), що забезпечує власне процес спрямованого транспортування, специфічного «впізнавання» та зв’язування АФІ з рецептором.
ТС, що забезпечують цілеспрямоване доставляння АФІ до органа-мішені, повинні відповідати певним вимогам: а) носій має бути біологічно інертним (переважно з полімерного матеріалу, що руйнується в організмі); б) активні речовини повинні мати субмікроскопічні розміри, добру проникну здатність та органоспецифічність; в) мати високу ємність щодо різних за фізико-хімічними властивостями активних речовин; г) забезпечувати захист активних речовин від руйнування, добре зберігатися тривалий час; ґ) акумулювати АФІ в місці їх дії та вивільняти в терапевтичних дозах; д) застосовуватися без порушення стерильності; е) не обумовлювати токсичності та алергенності; є) процес їх виробництва має бути простим у технологічному плані.
Слід зазначити, що нині немає ТС, які б відповідали всім зазначеним вимогам, а перелік останніх викликає як труднощі виробництва, так і складність оптимального добору допоміжних речовин.
Для створення ТС з цілеспрямованою доставкою активних речовин до клітин-мішеней використовують великий асортимент допоміжних речовин: а) етери целюлози (дозволяють створювати багатошарові композиції з різною здатністю до деградації); б) суміші пропілцелюлози й етилцелюлози в різних співвідношеннях (для мікрокапсул); в) полі-L-лактиди з різною молекулярною масою (для отримання оральних мікропелет); г) співполімери молочної та гліколевої кислот (для одержання біодеградованих пористих мікросфер для парентерального введення); ґ) водорозчинні полімерні носії на основі N-(2-гідроксипропіл)-метакриламіду (для вибіркового транспорту активних речовин тощо).
ТС використовують як для місцевого, так і для системного лікування. Вони мають як певні переваги перед традиційними ліками (забезпечують швидке досягнення й тривале підтримання на одному рівні концентрації активних речовин у плазмі крові та сталість лікувальної дії; дозволяють знизити курсову дозу активних речовин, усунути їх подразливу дію на шлунково-кишковий тракт (ШКТ), зменшити кількість проявів побічних ефектів; забезпечують безперервну пролонговану дію від кількох діб до кількох років), так і недоліки (можлива біологічна несумісність або токсичність імплантату; виникнення нових продуктів при біодеструктивному руйнуванні полімеру та болісні відчуття, спричинені наявністю імплантату; висока вартість, зумовлена вартістю вихідних матеріалів та складністю проведення технологічних процесів; необхідність застосування спеціальних заходів з уникнення витікання АФІ при введенні ТС; необхідність хірургічного втручання при введенні та видаленні системи тощо).
ТС класифікують: 1. З урахуванням механізму вивільнення активної речовини: а) на фізичні (дифузійні, осмотичні, гідростатичні) — мембранні й матричні, виконані зі стабільних і деградуючих полімерів; б) хімічні — ґрунтуються на хімічному розкладанні (біодеструкції) полімеру в організмі; в) самопрограмовані системи — вивільнення АФІ відбувається за ендосигналом (використання магнітних, ультразвукових та комп’ютерних технологій). 2. З урахуванням шляху введення: a) пероральні ТС з контрольованим вивільненням АФІ (осмотичні системи для вивільнення активних речовин у ШКТ, колоїдні системи, системи зі зворотним зв’язком, з пульсаційним поданням активних речовин або з миттєвим їх розчиненням); захисного типу (сублінгвальні та букальні таблетки, адгезивні пластирі); б) трансдермальні системи (нашкірні смужки з вивільненням активних речовин упродовж 1–7 днів, системи нашкірні «Azone», системи з пульсаційною подачею активної речовини: мазі, креми, лосьйони, аерозолі, пластирі); в) офтальмологічні (системи з уведенням активної речовини під віко, пролонговані очні краплі, плівки); г) вагінальні (супозиторії, таблетки); ґ) стоматологічні (пролонговані плівки); д) системи різного типу (системи, які імплантують; зовнішні осмотичні насоси; осмотичні мінінасоси для ректального введення; системи для введення ліків через ніс; монолітні матричні системи на гідрофільних та гідрофобних композиціях; багатофазні ліпосомальні системи та ін.).
У свою чергу матричні (монолітні) ТС поділяють на неруйнівні та біодеструктивні. Неруйнівні ТС — розчини або суспензії активної речовини в полімері. Їх виробляють у вигляді кульок, стрижнів і пластин, які вводять у природні та патологічні порожнини організму або імплантують під шкіру. Вивільнення активних речовин з таких систем відбувається за рахунок дифузії з полімерної матриці. Біодеструктивні ТС являють собою розчини або суспензії активної речовини у розчинному полімері, які при контакті з рідким середовищем організму поступово переходять у розчинний стан і не потребують видалення з організму. Носії монолітних біодеструктивних ТС — співполімери з певним значенням гідрофільно-ліпофільного балансу (ГЛБ), який визначає кінетику розчинення полімеру і тим самим — вивільнення активної речовини за рахунок ферментативної деструкції (гідролізу), дисоціації полімер-полімерних компонентів, розчинення або неспецифічного гідролізу в тканинних рідинах (саморуйнування). Для створення таких біодеградуючих полімерів використовують: а) високомолекулярні сполуки тваринного і рослинного походження (желатин, колаген, хітин, пектин, трагакант, карагенін, агар, камеді та ін.); б) модифікації крохмалю (ацетаткрохмаль, оксіетилкрохмаль, оксипропілкрохмаль, гідроксіетилкрохмаль та ін.); в) похідні целюлози (метилцелюлоза, карбоксиметилцелюлоза, оксипропілцелюлоза та ін.); г) похідні акрилової кислоти та її солі (етилакрилат, акриламід, поліакриламід, полігідроксіакрилати та ін.); ґ) полівінілові похідні (полівініловий спирт, полівінілпіролідон та їх співполімери); д) полімери поліетиленгліколю та його похідні.
Слід наголосити, що здатність до біодеградації в організмі людини синтетичних полімерів (поліетиленгліколь, полівініловий спирт, акриламід, полігідроксіакрилати, похідні α-оксикислот та ін.) повністю не досліджена. Недостатньо вивчені імуногенність і пірогенність природних полімерів (ДНК, декстран), які використовують як носії протипухлинних препаратів. Більшою мірою досліджені гідроксіетилкрохмаль та білки з низькою імуногенністю (фібриноген, сироватковий альбумін) і деякі антитіла. Їх загальний недолік — структура та властивості цих продуктів біосинтезу не піддаються необхідним для фармакологічних цілей змінам. Тому основним напрямком розроблення носіїв АФІ у майбутньому можуть стати синтетичні біодеградуючі полімери. Найперспективнішими щодо цього є носії на основі поліамінокислот, зокрема, на основі похідних поліглутамінової кислоти. Як полімерні мембрани також використовують полівініловий спирт, розчинний у гарячій воді, співполімер етилену і вінілацетату, полівінілпіролідон, етилцелюлозу та ін.
На сьогодні існують три групи систем цілеспрямованого транспорту: мікрокапсули і мікросфери (ТС першого покоління); ліпосоми, наносфери і нанокапсули (ТС другого покоління); колоїдні носії з моноклональними антитілами як векторами з молекулярною підкладкою та інші (ТС третього покоління). У мембранних (резервуарних) системах, якими є мікрокапсули , ядро активної речовини оточують полімерною плівковою оболонкою-мембраною. У деяких випадках полімерна мембрана може бути однією зі стінок резервуарної системи. Контрольованого вивільнення АФІ досягають добиранням відповідного складу мембрани (для кожної конкретної речовини), враховуючи її проникність, розміри, однорідність і звивистість пор, гідрофільність чи ліофільність мембрани та інші параметри. Основна перевага подібних систем — легкість досягнення постійної швидкості вивільнення АФІ. Як матричний матеріал для виготовлення мікрокапсул використовують зазвичай природні й синтетичні високомолекулярні речовини, надаючи перевагу синтетичним і природним біодеградуючим матеріалам (лактоза, альбумін, фібриноген та ін.). Перспективним у медичній практиці є застосування нанокапсул — різновиду мікрокапсул із частинками, які відповідають розмірам формених елементів крові. Наночастинки одержують полімеризацією міцел, найчастіше — солюбілізацією АФІ, при якій вони включаються в міцели. Нині розроблено методи одержання наночастинок із фенобарбіталом, діазепамом, преднізолоном, натрію саліцилатом, метотрексатом, доксорубіцином, простагландинами та іншими активними речовинами. Досить інтенсивно розробляється методика отримання магнітокерованих систем (в тому числі у НФаУ) , яка базується на тому, що разом з активною речовиною в капсулу вводять мікрочастинки з магнітними властивостями (частинки заліза, хрому, марганцю, кремнію), якими можна керувати ззовні за допомогою магніту (рис. 1).
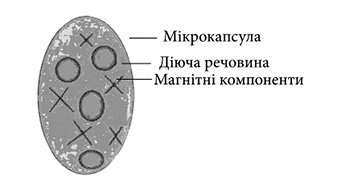

б
Мікрокапсула (а), керована магнітом (б)
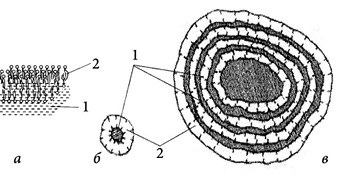
Останнім часом популярними стають ліпосомальні носії АФІ у ТС . Ліпосоми — мікроскопічні штучно одержані замкнені сферичні частинки, утворені бімолекулярними ліпідними шарами, найчастіше — фосфоліпідами, у просторі між якими містяться активні речовини (ферменти, гормони, вітаміни, антибіотики, імуномодулятори і цитостатики) (рис. 2). Ліпосоми легко проникають крізь клітинні оболонки і тим самим забезпечують більш ефективне транспортування АФІ. Вони активно поглинаються клітинами ретикулоендотеліальної системи (РЕС), яка виконує в організмі захисну функцію. Це дає можливість використовувати ліпосоми з АФІ для лікування захворювань, збудники яких знаходяться в клітинах РЕС. На жаль, їх ефективність як носія АФІ може різко знижуватися за рахунок поглинання мікрофагами.
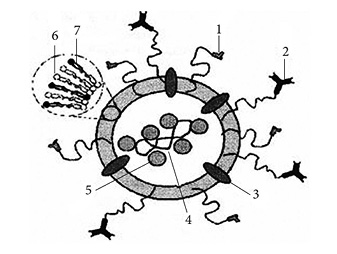
На сьогодні відомі способи, які дозволяють підвищувати стійкість та ефективність ліпосом шляхом більш оптимальної конструкції та підвищення адресної доставки (рис. 3). Наприклад, модифікують поверхню ліпосом полімером з гнучким гідрофільним ланцюгом (поліетиленгліколь) і отримують стерично стабілізовані ліпосоми (1), які менше взаємодіють з клітинами РЕС; вводять імуноглобуліни для надання ліпосомам молекулярного адресата (2) або білок, наприклад, гемаглютинін, який зумовлює більш легке злиття ліпосом з клітинною оболонкою (3). При створенні фармацевтичної системи з використанням ліпосом до їх складу можуть вводити різні активні речовини, наприклад, ДНК (4); позитивно заряджені ліпідні частинки для їх компактизації (5); мембраноутворювальні (6) та дестабілізуючі мембрану ліпіди (7). Прикладом ліпосомальних ТС з адресною доставкою можуть бути доксорубіцин, вінкристин, анаміцин, третіоїн та ін. Властивості ліпосом як носіїв специфічні й зумовлені їх універсальністю: можна варіювати склад, розміри, вводити до них речовини з різною фармакологічною дією та властивостями (генетичний матеріал, джерело енергії та ін.). Ліпосоми мають невеликий розмір, їх можна вводити в біосистеми внутрішньосудинно. «Адресна взаємодія» з клітинними оболонками значно зростає при введенні в ліпосоми гліколіпідів, антитіл (до антигенів пухлинних клітин), фосфоліпідів, виділених з певних клітин органів.
Для забезпечення оптимального режиму лікування багатьох захворювань ШКТ, у тому числі й хронічних, при яких необхідно підтримувати постійну концентрацію активних речовин у плазмі крові, створено декілька типів пероральних ТС з використанням осмотичних насосів (міні-осмотичний насос, елементарний осмотичний насос, двотактний осмотичний насос). Із названих ТС найперспективнішою є осмотична система «Орос» (рис. 4), що являє собою перфоровану таблетку, вкриту оболонкою (типу ацетату целюлози). Вона складається з осмотичного ядра, напівпроникної мембрани з отвором у ній, яка й контролює швидкість вивільнення АФІ. ТС є стійкою до дії вмісту ШКТ, забезпечує постійний об’єм розчинника, який проникає всередину клітини, та механічно витримує тиск зсередини. Розчинення АФІ, який знаходиться в ядрі, обумовлює осмотичний тиск, під дією якого насичений розчин АФІ викидається через невеликий отвір у мембрані.
Слід зазначити, що не всі активні речовини за своїми фізико-хімічними властивостями, наприклад, розчинністю, можуть бути використані в осмотичних ТС. У деяких випадках підбирають осмотично активну допоміжну речовину (частіше — натрію хлорид або манітол), яку змішують з вмістом ядра таблетки у певному співвідношенні, або використовують двокамерну осмотичну систему, яка складається з ядра й резервуара, відділеного від нього за допомогою непроникної еластичної мембрани. Важливим критерієм осмотичних пероральних ТС є вибір полімерної напівпроникної мембрани, у цій якості найчастіше використовують ацетат целюлози. Проникність мембрани регулюють за допомогою пластифікаторів або інших допоміжних речовин гідрофільної природи.
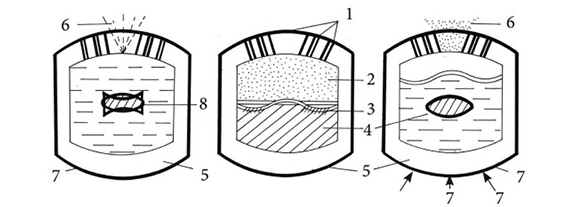
Нині увагу дослідників привертає трансдермальний шлях введення активних речовин для проведення системної терапії. Трансдермальні ТС дозволяють швидко створювати необхідну терапевтичну концентрацію АФІ у крові, а у разі прояву побічних дій — припинити їх застосування. Підвищення або зниження доз активних речовин досягається шляхом накладання або видалення додаткових смужок ТТС. Цей вид ТС можна розглядати як одну з найбільш простих і безпечних систем. В основу існуючих класифікацій ТТС покладені різні принципи. За технологічним принципом (з урахуванням контрольованого процесу вивільнення АФІ) їх умовно можна розділити на такі 4 групи: 1. Системи резервуарного типу на базі напівпроникних мембран («Катапрес», «Естрадерм», «Трансдерм-Нітро», «Трансдерм-Скоп»), де резервуар для активних речовин розташований за типом «сендвічу» — між непроникними для речовин шарами й полімерною мембраною, що регулює швидкість їх вивільнення (рис. 5). Тверда АФІ гомогенно диспергована у твердій полімерній матриці (наприклад поліізобутиленовій), суспендована у в’язкому рідкому середовищі (силіконовій рідині) у вигляді пастоподібної суспензії або розчинена у розчиннику (етанолі) у вигляді прозорого розчину. Мембрана може бути виготовлена з мікропористого або непористого полімеру чи співполімеру (наприклад, з етиленвінілацетату) зі специфічною проникністю для активних речовин. 2. Полідисперсні системи на базі насичених активними речовинами адгезивів («Депоніт», «Мінітран», «Нітро-Дур», «Франдол»), в яких резервуар для активної речовини є гомогенною дисперсією твердої речовини в гідрофільній або ліпофільній полімерній матриці з певною площею поверхні. 3. Дисперсні системи на базі полімерних некогезійних матриць, які забезпечують задану швидкість дифузії («Нітро-Дур» і ТТС, що вивільняють нітрогліцерин) і змінюють рівень завантаження активних речовин за рахунок створення градієнта їх концентрації в резервуарі, розташованому паралельно до поверхні дифузійного пластиру. 4. Полідисперсні системи мікрорезервуарного типу («Нітродиск», що вивільняє нітрогліцерин, і трансдермальна контрацептивна система, що містить прогестин і естроген) можна розглядати як гібрид резервуарної й матричної систем або дисперсію мікрорезервуарів у ліпофільному полімері. Для перелічених вище груп ТТС характерна різна тривалість дії (від декількох годин до тижня).
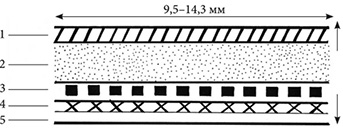
За фармакокінетичним принципом (з урахуванням процесу контрольованого проникнення АФІ з ТТС) їх зазвичай поділяють на системи з контрольованою дифузією з полімерної матриці; системи з контрольованим градієнтом АФІ в резервуарі; системи з контрольованою роздрібненістю мікрорезервуарів. Природа допоміжних речовин, використаних у технології ТТС, має певний вплив на швидкість і повноту вивільнення АФІ. Для прискорення абсорбції крізь шкіру і підвищення розчинності малорозчинних речовин використовують активатори абсорбції (диметилсульфоксид, монометиловий етер етиленгліколю, гліцерилмоноолеат, метилпіролідон, полівінілпіролідон, формамід та ін.). На сьогодні як прискорювач усмоктування запропоновано додецилазациклогептан, хоча механізм його дії залишається нез’ясованим.
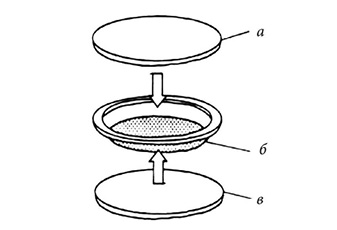
Прикладом офтальмологічних ТС є система «Окусерт» («Алза», США), що містить пілокарпін (рис. 6). ТС містить 2 етиленвінілацетатні мембрани (а, в), які регулюють швидкість вивільнення активної речовини, та терапевтичний шар (овальна пластина б), який одержують розчиненням пілокарпіну гідрохлориду в гелі альгінової кислоти.
Як носії у фармацевтичних системах широко використовуються полімерні плівки, які є відносно новою лікарською формою і являють собою суцільні тонкі шари речовини в полімері. Для одержання плівок використовують полімери лінійної будови, макромолекули яких являють собою сукупність однакових (або різних, але таких, що правильно чергуються) ланок мономера, хімічно зв’язаних у довгі ланцюги, наприклад, етери целюлози, полівінілпіролідон, полівініловий спирт та ін. До складу робочого розчину, що йде на виготовлення плівки, крім плівкоутворювального полімеру, також входять розчинник (для розчинення полімеру), пластифікатор і АФІ. Прикладами полімерних плівок є очні плівки з пілокарпіном, сульфапіридазином натрію тощо, защічні плівки з нітрогліцерином, валідолом та ін., де біорозчинними полімерами, що мають широке клінічне застосування, є потрійний полімер акриламіду, вінілпіролідону й етилакрилату, на основі якого розроблені очні полімерні плівки з активними речовинами різної фармакологічної дії. Гідрогелеві ТС отримують з різноманітних полімерів як природного (колаген, полісахариди, альгінати та ін.), так і синтетичного походження (зшиті акрилати, полівінілпіролідон, полівініловий спирт та ін.). Терапевтичні гелеві системи можуть застосовувати в ненабряклому вигляді (плівки) та у формі гелю.
У стоматологічній практиці застосовують мембранні ТС, оболонкою яких є співполімер оксиметилметакрилату і метилметакрилату у співвідношенні 30:70 або 50:50. Система вивільняє фторид натрію по 0,02–0,1 мг на добу протягом 30–180 днів. Для стоматологічних резервуарних систем з тетрацикліном використовують мембрани з ацетилцелюлози та/або етиленвінілацетатного співполімеру. Запропоновано принципово новий тип стоматологічних полімерних плівок «Диплен-Дента» (Росія), в яких добра адгезія до слизової оболонки поєднується з пролонгованою дією АФІ. Плівки складаються з двох шарів — гідрофільного і гідрофобного, і залежно від розташування шару розрізняють два боки плівки. Гідрофільний шар (або бік) має здатність приклеюватися до вологої слизової оболонки ранової поверхні. Зовнішній, гідрофобний, шар — пластичний, добре моделюється на поверхні слизової оболонки рота та ізолює уражену ділянку від зовнішньої механічної, хімічної і бактерицидної дії.
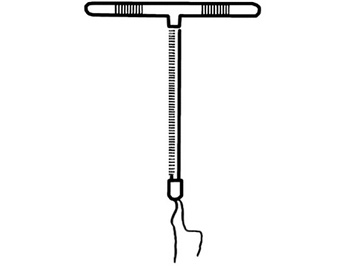
Прикладом вагінальних ТС є контрацептивна внутрішньоматкова система «Прогестасерт» (рис. 7), яка забезпечує надійну (97%) контрацепцію протягом одного року. Система складається з платформи, яка має Т-подібну форму, і модуля. Модуль — резервуар, в якому природний прогестерон (жовте тіло) знаходиться у вигляді суспензії в силіконовій олії. Крізь мембрану з регульованою швидкістю (65 мкг/добу) вивільняється прогестерон, що забезпечує контрацептивну дію.
Для одержання імплантованих ТС пролонгованої дії як носії використовують монокарбоксицелюлозу (напівсинтетичний полімер з гемостатичними властивостями, здатний без залишку резорбуватися організмом) та колаген і альгінова кислота. Для ТС, що гідратуються, як матрицю використовують гідрофільний полімер етиленглікометакрилату. Останній, набухаючи при контакті з фізіологічними рідинами, вивільняє АФІ. ТС, що гідролізуються (рис. 8), базуються на включенні АФІ в матрицю з біодеградуючих полімерів (полілактид, полі-(лактид-гліколід)-співполімер, поліортоетер, поліангідрид). Прикладами подібних ТС є Lupron Depot у формі мікросфер для ін’єкцій і Zoladex для підшкірної імплантації. До перспективних носіїв, які використовують для доставлення активних речовин, варто віднести ніосоми , одержані гідратуванням суміші неіонних ПАР (з одним або двома алкільними ланцюгами) і холестерину. Ніосоми є осмотично активними системами і використовуються для доставлення АФІ при парентеральному способі введення.

Таким чином, можна зробити висновок, що нині у світі великого значення надають розробленню й виробництву ТС з контрольованим вивільненням і спрямованою доставкою ліків до органа-мішені. Вирішення цієї важливої проблеми можливе лише при подальшому пошуку і розширенні номенклатури полімерних та інших допоміжних речовин, що можуть використовуватися як носії АФІ при розробленні ТС — ліків нового покоління.
Далі буде.
Національний фармацевтичний університет

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим