|
В июне 2004 г. Комитет по здравоохранению сообщил о намерении исследовать влияние фармацевтической отрасли на разработку, проведение клинических испытаний и продвижение ЛС, предоставление информации, профессиональное образование и обучение пациентов, оценку регуляторными органами безопасности и эффективности ЛС, ценообразование на ЛС. В процессе подготовки отчета заслушаны мнения министров и других должностных лиц Департаментов здравоохранения (Department of Health), торговли и промышленности (Department of Trade and Industry), медицинских работников и специалистов фармацевтической отрасли, ученых, журналистов, сотрудников PR-компаний, членов общественных и благотворительных организаций, Парламента, Национального института качества медицинской помощи (National Institute of Clinical Excellence — NICE и Агентства по регулированию оборота ЛС и продуктов для здравоохранения Великобритании (UK Medicines and Healthcare products Regulatory Agency — MHRA). Письменных сообщений получено свыше 100.
Во время составления отчета специалисты посетили несколько стран, в том числе Австралию и Новую Зеландию, в целях изучения особенностей регуляторных систем разных стран, а также посетили современные производства корпораций «ГлаксоСмитКляйн», «АстраЗенека» и «Пфайзер».
ОБЗОР СОСТОЯНИЯ ОТРАСЛИ
Фармацевтическая отрасль Великобритании является крупной, прибыльной и конкурентоспособной. Ее называют «бриллиантом в короне британской экономики». Коммерческий успех отрасли неоспорим. По объему продаж она занимает пятое место в мире, аккумулируя 7% мирового объема и уступая только США, Японии, Германии и Франции. Великобритания является третьей среди экспортеров ЛС, с третьим по величине активным сальдо торгового баланса. Только 3% мирового объема продаж рецептурных ЛС приходится на Великобританию, тогда как объем расходов предприятий отрасли на научно-исследовательские разработки составляет 10% мирового и более половины — европейского. Фармация представляет собой третью по прибыльности отрасль, следующую за туристическим и финансовым секторами экономики, в которой непосредственно занято 83 тыс. человек.
Сообщения, поступившие в адрес составителей отчета, свидетельствуют о том, что в последние годы крупные фармацевтические компании в своей деятельности полагаются преимущественно на маркетинговые подходы. Как отмечено в документе, это является источником многих проблем глобального характера. Подчеркивается, что регуляторная система, работники медицины и фармации, правительство не обеспечили безусловного соответствия деятельности отрасли интересам пациентов и Национальной системы здравоохранения (National Health System — NHS). Последствиями этого, как отмечено в отчете, являются, в частности, небезопасное применение ЛС и повышение так называемой медикализации общества.
«ТАБЛЕТКИ ОТ ЛЮБОЙ БОЛЕЗНИ» (PILL FOR EVERY ILL)
Объемы потребления ЛС непрерывно растут. Затраты NHS Великобритании на их приобретение составляют около 7 млрд фунтов стерлингов в год (12% бюджета этой организации). В 2003 г. на одного жителя Великобритании приходилось 13,1 наименований назначенных рецептурных ЛС, что на 40% больше, чем 10 лет назад. Общая стоимость назначенных ЛС существенно увеличивается год от года, опережая инфляцию. Так, в 1993 г. она составляла 3,1 млрд фунтов, в 2003 г. — 7,5 млрд, увеличившись с 2002 г. на 9,7% в денежном и на 6,4% в натуральном выражении. Кроме того, объем продаж безрецептурных препаратов составил 1,8 млрд фунтов.
Растущее потребление ЛС сопряжено с проблемами. Особенно выделяются две из них: небезопасное применение препаратов и «медикализация» — чрезмерное упование на ЛС и избыточное их применение, аргументированное тем, что существуют «таблетки от любой болезни» (pill for every ill). Наблюдается устойчивая тенденция к распространению мнения, что решение жизненных проблем сродни фармакотерапии: нужно только выпить таблетку. С готовностью прикрепляются диагностические ярлыки, а за этим следует медикаментозное воздействие. Люди предпочитают полагаться на многообещающие сообщения из коммерческих и профессиональных источников, вместо того чтобы активно решать собственные проблемы. «Медикализация» может порождать чрезмерные требования к NHS и способствовать формированию ошибочных представлений о том, как следует поддерживать хорошее состояние здоровья. Вторая проблема вытекает из первой: избыточное потребление ЛС ведет к повышенному риску развития побочных реакций (ПР). В настоящее время не существует данных об экономических последствиях ЛС-индуцированных заболеваний, но существуют предположения, что их последствия могут быть оценены в миллиарды фунтов в год. ПР, являющиеся причиной госпитализаций (3–5% общего их количества), за год обходятся в 500 млн фунтов. Не существует данных о затратах, связанных с ПР, не становящихся причиной лечения в стационаре, так же, как ПР у госпитализированных пациентов, которые предположительно развиваются у 15% стационарных больных.
В отчете выражается опасение, что отрасль насаждает беспокойство о болезни/здоровье. Такое предположение основано на том, что она существенно доминирует над научной общественностью по воздействию на массовое сознание посредством влияния инвесторов, маркетинговых рычагов и рекламы. Отрасль является очень влиятельной, воздействуя практически на всех, кто связан с миром медицины, включая врачей, пациентов, ученых, представителей средств массовой информации и даже регуляторных органов и Парламента Великобритании. Фармацевтические компании поощряют нас видеть себя «ненормальными» и поэтому нуждающимися в терапии (медикаментозной).
В качестве примера в Отчете рассмотрена проблема, возникшая в связи с применением антидепрессантов класса ингибиторов обратного нейронального захвата серотонина (ИОНЗС), рассмотрение которой Комитетом по безопасности ЛС (Commitee on the Safety of Medicines) совпало по времени с составлением самого документа. Депрессия — тяжелое заболевание, при котором требуется немедленное лечение, однако только 5% назначений проводилось пациентам с выраженной депрессией, при том, что около 2/3 всех случаев этого заболевания классифицируются как легкая депрессия. Случаи последней диагностируют у людей, которые несчастны и пребывают в состоянии дистресса из-за трудных ситуаций и обстоятельств. У большинства пациентов, которым в таких случаях были прописаны ИОНЗС, можно было ожидать умеренной пользы (нет убедительных доказательств), однако и существенного риска развития ПР.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Фармацевтическая отрасль Великобритании около 2,3 млрд фунтов в год инвестирует в научные исследования и разработки. В фармацевтических компаниях работают 29 тыс. человек, и отрасль является одной из крупнейших в стране по количеству занятых в ней специалистов с учеными степенями. Отрасль вкладывает в исследования, связанные с охраной здоровья, больше средств, чем все другие источники вместе взятые: в шесть раз больше, чем Департамент здравоохранения (Department of Health), в пять — по сравнению с благотворительными организациями и в восемь — чем Совет по медицинским исследованиям (Medical Research Council). В стране в общем объеме инвестиций в научно-исследовательские разработки фармацевтической отрасли принадлежат около 40%. Ведущими компаниями в этой сфере в стране являются «ГлаксоСмитКляйн», «АстраЗенека», «Пфайзер», «Эли Лилли», «Вайет», «Рош», «Мерк Шарп энд Дом» и «Новартис».
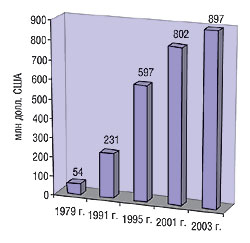
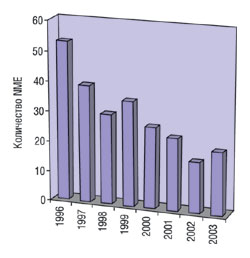
Согласно данным Ассоциации фармацевтической промышленности Великобритании (Association of the British Pharmaceutical Industry — АBPI), на разработку 1 ЛС в среднем требуется 12 лет и инвестиций в объеме свыше 500 млн фунтов (около 900 млн. долл. США) (рис. 1). За последние несколько лет объемы инвестиций существенно возросли. Большой проблемой ранних стадий разработки ЛС является трудность оценки значимости результатов, полученных при изучении клеточных, тканевых моделей и животных. Данные большинства этих пре- и неклинических тестов не могут быть экстраполированы на людей, и многие новые молекулярные субстанции (new molecular entity — NME) не выводятся на рынок в связи с проблемами на стадии разработки. Согласно данным Организации исследований в области онкологии Великобритании (Cancer Research UK), около 95% разработанных NME не достигают стадии выведения на рынок. Через стадию клинических испытаний также удается провести не все препараты. Из 100 ЛС, включенных в клинические испытания I стадии, во II продолжаются исследования только 70 из них, в III — 33, относительно 25 подаются заявки для получения разрешения на маркетинг и 20 получают одобрение. Ситуацию в отрасли составители отчета иллюстрируют данными не по Великобритании, а США: по информации Управления по контролю за лекарственными препаратами и продуктами питания США (FDA), за последние 10 лет количество одобренных инновационных ЛС непрерывно уменьшается (рис. 2). С другой стороны, FDA утверждает, что по мере дальнейшего развития биотехнологий и применения результатов исследования генома человека для лечения людей с различными заболеваниями интенсивность инновационного процесса будет повышаться.
|
|
| ЛС, выведенное на рынок первым | Последующее ЛС | Класс | Преимущества последующего ЛС |
| Акколат (accolate), зафирлукаст (zafirlukast) | Cингуляйр (singulair), монтелукаст (montelukast) | Антагонисты рецепторов лейкотриенов для перорального применения | Удобство применения (один вместо двух раз в день) |
| Беконазе (beconase, беклометазона дипропионат) | Фликсоназе (flixonase, флютиказона пропионат, fluticasone propionate) | Кортикостероиды для местного применения при заболеваниях полости носа | Выраженность эффекта, меньшая частота ПР |
| Зовиракс (ацикловир) | Вальтрекс (Valtrex, валацикловир) | Противовирусные средства | Более удобное дозирование |
| Мевакор (mevacor, ловастатин) | Липитор (аторвастатин) | Гиполипидемические средства | Выраженность эффекта |
| Тагамет (циметидин) | Зантак (ранитидин) | Антагонисты Н2-рецепторов | Более удобное дозирование; меньшая выраженность межлекарственных взаимодействий |
Представители ABPI отмечают, что исследования, проводимые в фармацевтической отрасли, в основном соответствуют приоритетам NHS. Например, 43% новых лекарственных препаратов, выведенных на рынок за последние 10 лет, созданы для решения 4-х приоритетных с точки зрения NHS проблем: лечение больных с онкологическими, сердечно-сосудистыми (ишемическая болезнь сердца), психическими заболеваниями, а также пациентов пожилого возраста. При этом около 90% клинических исследований и 70% статей, посвященных их результатам, организуются отраслью. Правительство хорошо осведомлено о доминировании фармацевтической отрасли в проведении исследований лекарственных препаратов, при котором приоритеты исследований определяют компании, выбирая, очевидно, наиболее выгодные с коммерческой точки зрения направления. Представители правительства утверждают, что недостаточное влияние государства на выбор направления разработок не вызывает беспокойства в правительственных кругах. Они отмечают, что существующая модель, в соответствии с которой лекарственные препараты разрабатываются частным сектором в ответ на идентифицируемые потребности системы здравоохранения, более эффективна и результативна, чем альтернативы, которые можно представить (такие, как национализация фармацевтической промышленности или выбор правительством направлений исследований).
Критика позиции правительства основана на том, что обязательства отрасли обеспечивать спонсоров хорошими дивидендами от инвестиций тормозит развитие новых и более совершенных подходов к лечению. Отмечается, что инновации в сфере создания лекарственных препаратов имеют тенденцию тяготеть к более выгодным, а не приоритетным для здравоохранения областям. Кроме того, подчеркивается, что коммерческий интерес в сфере немедикаментозного лечения отсутствует, и в этой области производится мало исследований. Представители Королевского колледжа врачей общей практики (Royal College of General Practitioners — RCGP) отметили, что больше средств инвестируется в разработку ЛС, применяемых для профилактики заболеваний, чем для лечения, что способствует «оттоку инвестиций от больных к здоровым, от старых к молодым и от бедных к богатым». Cancer Research UK утверждает, что «стимулы, побуждающие отрасль проводить клинические исследования в небольших популяциях пациентов, слишком слабые».
ИННОВАЦИИ И ПРОГРЕСС В ТЕРАПИИ
За последние 10 лет количество NME, выведенных на рынок, уменьшилось. В то же время количество препаратов «me-too» — ЛС, выполняющих ту же терапевтическую функцию, что и один или более из уже существующих препаратов, увеличилось. Данных по Великобритании о распространенности ЛС подобного типа не существует, но данные по США ясно иллюстрируют эту тенденцию. За последние 10 лет доля NME, которые обеспечили существенный терапевтический прогресс, варьировала от 23 до 54% (тогда как другие источники свидетельствуют, что эти цифры преувеличены). Представители отрасли подчеркивают, что поскольку применение действительно инновационных препаратов нередко связано с риском развития ПР, отрасль «осуждают и за то, что ею делается, и за то, что не делается». Другой аргумент заключается в том, что разработка ЛС «me-too», как правило, является менее затратной по сравнению с созданием действительно инновационных лекарственных средств. То есть, истинная инновационность сопряжена с рисками и разработку препаратов «me-too» стимулирует большая коммерческая выгода.
Есть мнение, что существование множества аналогичных ЛС на рынке не приносит пользы пациентам. Нередко, однако, первый препарат терапевтического класса не несет существенного прогресса. Случается, что второй или третий препарат того же класса более эффективен и вызывает меньше ПР по сравнению с первым из выведенных на рынок. Отдельные примеры, когда новые препараты не были совершенно инновационными, но предоставили существенные возможности для лечения по сравнению с существовавшими ранее, приведены ABPI (таблица). «Мe-too» имеют ценность, поскольку они могут нести небольшие терапевтические преимущества (например удобство применения) и у них неожиданно могут проявиться другие полезные качества. Например, «Пфайзер» отмечает, что разнообразие новых препаратов существенно улучшает терапевтические подходы, при этом в полной мере их влияние может быть продемонстрировано после применения в системе NHS в течение нескольких лет.
Представители «ГлаксоСмитКляйн» также подчеркивают полезность выведения на рынок новых препаратов одинакового класса. Препараты с похожими механизмами действия могут отличаться по эффективности, метаболизму, переносимости, профилю безопасности. Доступность различных лекарственных средств для лечения пациентов с одним и тем же заболеванием дает возможность врачу подбирать подход в зависимости от потребностей конкретного пациента.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЙ
Проведение отраслью испытаний препаратов — представителей нового класса, критикуют за:
- недостаточное информирование участников исследований;
- подвергание исследуемых недопустимому риску;
- применение неэффективных препаратов сравнения в неприемлемых дозировках;
- дублирование исследований;
- недостаточное количество исследований применения комбинаций препаратов;
- недостаточные прозрачность и доступность для врачей информации о текущих исследованиях.
Для получения разрешения на маркетинг необходимо предоставить доказательства того, что препарат эффективнее, чем плацебо, обычно по результатам двух контролируемых исследований. Однако, как отметил профессор Хеали, компании могут провести 10 или более исследований для выявления какого бы то ни было эффекта, и даже если результаты не продемонстрируют преимущества перед плацебо, препарат в дальнейшем все же может претендовать на получение разрешения на маркетинг. Исследования, при которых получены отрицательные результаты, скорее будут расценены как неудавшиеся, а не неудачный препарат.
В исследованиях лекарственных средств производства фармацевтических компаний, являющихся спонсорами этих исследований, часто допускаются систематические ошибки, в результате чего преувеличиваются положительные качества препаратов. Так, пять из шести систематических обзоров, проведенных за последние 2 года, доказали, что исследования, спонсорами которых выступали производители ЛС, чаще содержат позитивные результаты относительно продуктов этой компании, чем исследования, у которых независимый спонсор [3].
Частой ошибкой в дизайне исследований является применение неприемлемых препаратов сравнения, например с более высоким риском ПР, чем у других в той же терапевтической группе. Искажение результатов может наступать также в связи с особенностями выбора дозы: применение неоправданно низкой дозы препарата сравнения может стать причиной меньшей эффективности. Использование препарата сравнения в относительно высоких дозах может быть связано с тем, что снизится относительный риск ПР при применении тестируемого лекарственного средства.
Ключом к разрешению многих проблем является большая прозрачность информации об исследованиях. Поэтому составители отчета приветствуют признание отраслью необходимости учреждения регистра клинических испытаний, о создании которого заявили крупнейшие ассоциации производителей разных стран мира [4]. Однако если в их «Совместном заявлении…» указано, что результаты исследования должны поступать в базу данных в течение одного года после первой регистрации препарата или после завершения исследования (если препарат уже зарегистрирован), то Комитет не видит причин, по которым эти данные не могут быть отправлены немедленно. Составители отчета также выразили сомнение в том, что ведение регистра испытаний исключительно представителями отрасли вызовет доверие к нему со стороны общества и специалистов. Комитет рекомендовал, чтобы ведение регистра осуществлялось независимым органом, и результаты всех клинических исследований, включая полную информацию о них, помещались в регистр при выведении на рынок как условие для получения разрешения на маркетинг.
Комитет рекомендовал также, чтобы сотрудничество MHRA с фармацевтической отраслью и экспертами независимых компаний способствовало организации клинических исследований, результаты которых позволят установить реальную терапевтическую ценность новых препаратов. Исследования должны быть организованы таким образом, чтобы более точно установить действие ЛС в обычных клинических условиях. Комитет рекомендовал, чтобы комитеты по вопросам этики поощряли, когда это возможно, внедрение в дизайн клинического исследования препарата сравнения и нефармакологические методы лечения. Комитеты по вопросам этики также должны требовать от заявителей доказательства того, что исследование не повторяет предыдущие и что результаты будут опубликованы полностью.
ПРОМОЦИЯ ЛС
Во всем мире наблюдается тенденция к увеличению расходов фармацевтических компаний на маркетинг. В США крупные фармацевтические компании расходуют примерно 24–33% объема продаж на маркетинг, что в два раза больше, чем на научные исследования и разработки. Точное сравнение затруднено из-за невозможности точного разделения маркетинга и связанных с ним видов деятельности, особенно представления информации об ЛС и образовательных программ для профессионалов. В отчете указано, что соответствующие данные по Великобритании отсутствуют, но прямые расходы на промоцию в этой стране меньше, чем в большинстве других европейских стран, что отражает доминирование NHS как крупнейшего покупателя ЛС в условиях действия «Свода правил, регулирующих цены на препараты-брэнды» (Pharmaceutical Price Regulation Scheme PPRS).
С 1995 г. количество работников фармацевтической отрасли, занятых исследованиями, снизилось на 2%, а маркетингом — значительно увеличилось. Конкуренция между компаниями во многом основана на маркетинговых технологиях и PR. Разительная диспропорция объемов информации из отраслевых и неотраслевых источников в основном обусловлена несоразмерными объемами финансирования. Отрасль тратит свыше 1,65 млрд фунтов в год на маркетинг и промоцию, тогда как Department of Health — 4, 5 млн.
Маркетинг лекарственных препаратов строго регулируется, иногда слишком строго, тем не менее проблемы существуют. В отчете особенно выделены три из них. Первая касается объема промоционных материалов. Врачи уже перегружены промоционными сообщениями такого рода, это же в недалеком будущем ожидает медицинских сестер и фармацевтов. В отсутствие информации из альтернативных, не отраслевых источников, уровень назначения новых препаратов может быть неоправданно высоким. Однако, если качество промоционных материалов, адресованных врачам, уже регулируется АВРI, их количество ограничено только косвенно посредством PPRS. Комитет рекомендует установить ограничение относительно количества материалов, получаемых врачами, в частности в течение шести месяцев после выведения на рынок. Вторая проблема — незаконная маркетинговая деятельность. Наконец, процедуры изучения жалоб о нарушениях являются медленно действующими, необязательными для выполнения и официально не поддерживаются. Комитет рекомендовал изучить проблему в целях поиска возможностей ускорения проведения этих процедур и применения эффективных санкций.
Одним из немногих рычагов, которые имеются в распоряжении правительства в отношении фармацевтической отрасли, является PPRS. Он должен более эффективно применяться для влияния на деятельность отрасли в интересах общества. Если обнаружено, что компании нарушили регуляторные нормы относительно рекламы или опубликовали информацию, вводящую в заблуждение, допуск к промоции и исследованиям, проводимым согласно схеме, должен быть уменьшен.
РЕКЛАМА
По утверждению одного из экспертов, конкуренция в отрасли основывается в основном на инновационных маркетинговых методах и PR, а не на эффективности и безопасности продуктов. О неэффективности системы предварительной оценки материалов и препятствования недобросовестной рекламе свидетельствуют следующие факты. В апреле 2002 г. одной из компаний на рынок Великобритании был выведен препарат из группы пероральных контрацептивов, который в рекламе, направленной на врачей, был назван «препаратом для здоровья и благополучия», а рекламный слоган гласил: «Меняйте жизнь женщин к лучшему и назначайте препарат». Через несколько месяцев в «Drug and Therapeutics Bulletin» (DTB) появилась критическая публикация в отношении содержания рекламы и последовало заявление уполномоченному органу, ответственному за соблюдение общих требований к обороту, рекламе и назначению лекарственных средств (Prescription Medicines Code of Practice Authority, PMCPA) о том, что компания нарушила Свод норм и правил ABPI по 11 пунктам. Только через 10 мес после выведения препарата на рынок Агентство по контролю за лекарственными средствами (Medicines Control Agency — MCA) признало утверждения компании неприемлемыми и обратилось к ней с просьбой изъять рекламу и опубликовать разъяснения в журналах, где она была напечатана ранее. ABPI отмечает, что факты, свидетельствующие о нарушениях в сфере рекламной деятельности, такие, как сокрытие негативной информации о препаратах и предоставление специалистам информации, вводящей в заблуждение, свидетельствуют о том, что саморегуляция, действующая в фармацевтической отрасли, недостаточно эффективна. Некоторые рекламные слоганы требуют перефразирования, например, фраза «Защита для сердец» может быть заменена «Помоги защитить твое сердце». Как отмечено МHRA, этот вопрос, касающийся оригинального препарата симвастатина, требует серьезного рассмотрения.
Промоционная деятельность в фармацевтической отрасли имеет очень большие масштабы. Вместе с этим существует такая проблема, как недостаточно ответственный подход врачей к назначениям. Уровень подготовки по таким вопросам клинической фармакологии, как оценка результатов клинических исследований и маркетинг лекарственных препаратов, недостаточен. Врачам зачастую не хватает времени или знаний, чтобы различить исследования более высокого и более низкого методологического качества и критически оценить выводы, представленные авторами статей. Некоторые врачи отказываются признать, что промоционная активность компаний влияет на принятие ими решений о назначении тех или иных препаратов, что свидетельствует об опасной самоуспокоенности. Огромная вариабельность в объеме назначений некоторых ЛС иллюстрирует это положение. Агрессивная промоция препаратов вскоре после выведения на рынок, абсолютный объем информации, получаемой врачами и провизорами, которая «маскируется под обучение» в отсутствие уравновешивающей силы, определяет ненадлежащее назначение препаратов.
Большинство компаний обеспокоены существованием трудностей с предоставлением информации пациентам посредством своей информационной службы, в то время как потребителям доступно большое количество неофициальной и непроверенной информации в интернете и других источниках. В настоящее время, как указано в сообщении от «АстраЗенека», большинству пациентов, которые обращаются за информацией о том или ином препарате, невозможно предоставить развернутый ответ, поскольку это может быть истолковано как нелегальная промоция рецептурного препарата, направленная на потребителя. Поэтому больше информации о применении тамоксифена больные могут получить с помощью интернета, а не компании, которая разработала этот препарат.
Листки-вкладыши для пациентов являются наиболее простым для отрасли путем предоставить пациенту необходимую ему информацию. Проблемой является то, что обширный перечень побочных реакций без указания их распространенности в листе-вкладыше, защищающий компанию в правовом отношении, вызывает ненужную обеспокоенность пациентов. Проблема общепризнанна, и для ее решения создана специальная рабочая группа MHRA.
Промоция, направленная на врачей
Около 80% рекламы ЛС направлено на профессионалов здравоохранения, при этом в связи с появлением новых форм отпуска ЛС все больше внимания уделяют медсестрам. Промоция рецептурных препаратов может быть направлена только на специалистов, за исключением таких специфических случаев, как одобренная правительством программа вакцинации. Инициатива, предпринятая Европейской Комиссией в отношении разрешения рекламы, направленной на потребителя, была отклонена Европейским Парламентом в октябре 2002 г. большинством из 494 голосов при 42 голосах «за».
Промоционнная активность, направленная на врачей, может осуществляться в нескольких формах:
а) посредством деятельности медицинских представителей, которых в настоящее время в Великобритании работает около 8 тыс. Согласно своду норм и правил ABPI (ABPI’s Code of Practice), количество визитов обычно не должно превышать 3 в год;
б) спонсирование отраслевых мероприятий и медицинских конференций, различные формы поощрения врачей;
в) статьи в журналах и приложениях к ним;
г) прямая реклама, размещаемая в медицинских журналах и других изданиях. Прямая рассылка специалистам часто принимает форму информирования врачей об изменениях средств доставки ЛС или появлении новых лекарственных форм.
Для организации различных видов промоционной деятельности компаниями нередко привлекаются различные PR-агентства, многие из которых представляют собой подразделения огромных международных PR и коммуникационных компаний, таких, как «Огилви», «Берсон-Марстеллер», «Эдельман» и «Кетчам». Важнейшим аспектом деятельности медицинских коммуникационных компаний является работа с лидерами общественного мнения, в качестве которых обычно выступают ведущие специалисты отрасли.
В организации промоционных кампаний большое внимание уделяется идентификации эмоциональных потребностей специалистов здравоохранения и формированию маркетинговой деятельности с целью их удовлетворения. Брэндам намеренно присваивают атрибуты, которые не могут считаться «объективными и недвусмысленными», как требует ABPI’s Code of Practice, например, «энергичный», «страстный», «сексуальный» и т.д. При разработке маркетинговых стратегий принимаются во внимание моральное состояние врача, который может испытывать беспокойство относительно правильности назначения, усиливающееся в случае недовольства пациентов и критики со стороны коллег. Эта проблема эксплуатируется фармацевтической отраслью, которая при промоции брэндов утверждает, что их назначение позволяет «чувствовать уверенность» и «вызывать доверие пациентов».
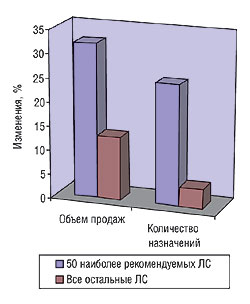
Реклама рецептурных препаратов, направленная на потребителя (Direct-to-consumer advertising — DTCA), разрешена только в США и Новой Зеландии. Этот вид рекламы весьма эффективен для повышения объема продаж. Согласно данным исследования, опубликованного в 2002 г., 20% из 25 тыс опрошенных заявили, что такой вид рекламы побуждает их обращаться к семейному врачу для обсуждения препарата, реклама которого привлекла их внимание [5]. Наблюдается связь между успешными рекламными компаниями и повышением объема продаж, который намного выше у рекламируемых препаратов, как и число назначений, чем у нерекламируемых (рис. 3).
|
Исследования, подобные вышеприведенному, позволили авторам отчета утверждать, что DTCA стимулирует ненужное и неправильное назначение препаратов. Отмечается, что практика назначений нарушается тем, что врач делает назначения, следуя выбору пациента, и чаще выписывает оригинальный препарат, если пациент спрашивает непосредственно о нем, чем генерический. В Великобритании (и других странах — членах ЕС) представители отрасли подчеркивают, что у них нет намерений внедрить в стране DTCA подобно США, расходы на которую в настоящее время составляют 4 млрд дол. США. При этом представители отрасли выражают заинтересованность в непосредственных контактах с пациентами. ABPI заявляет, что «никто не знает о лекарственных препаратах больше, чем люди, которые их разработали и сделали доступными».
В Отчете обращается внимание на заявления, согласно которым кампании, посвященные популяризации знаний о патологиях, могут действовать как реклама тех или иных препаратов, в частности если для лечения больных с данной патологией применяется хорошо известный оригинальный препарат. Такие кампании, организуемые компанией-производителем, часто приурочены к лончу препарата и могут проводиться одновременно с агрессивной рекламой, направленной на врачей. Согласно утверждению Королевского фармацевтического общества Великобритании (Royal Pharmaceutical Society of Great Britain), подобные кампании могут таить потенциальные неблагоприятные последствия. Пациенты могут получить ложно-позитивные результаты исследований, что станет причиной выполнения ненужных процедур.
Во внутренних документах компаний, на которые не распространяются положения ABPI’s Code of Practice, пациенты часто рассматриваются в качестве целевой аудитории. Например, проводятся детальные маркетинговые исследования для выяснения эмоционального состояния и мотивации определенной группы пациентов. В одном документе, в котором описан «процесс стратегического планирования», пациенты, которые «еще не обратились к врачу, чтобы получить препарат», обозначались как «упущенные миллионы», а их количество было оценено в почти 2 млн людей в Великобритании. По требованию компаний в настоящее время проводятся исследования, призванные определить рациональные и эмоциональные факторы, в силу которых пациент не обращается к врачу, и возможные методы воздействия на них. Представленные PR-компаниями данные из брифов компаний не оставляют сомнений, что компании организуют исследования с целью определить целевую аудиторию, возможные каналы коммуникации и разработать ее принципы.
В следующей публикации мы обратимся к исследованию влияния отрасли на оценку регуляторными органами безопасности и эффективности ЛС и ценообразование на ЛС. n
|
ЛИТЕРАТУРА |
|
|
Дарья Полякова

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим