Европейское агентство по лекарственным средствам (European Medicines Agency — EMA) и Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 31 июля опубликовали отчет о совместном семинаре, состоявшемся 26 ноября 2018 г. Его цель — обсуждение научных и нормативных подходов к решению проблем качества и производства, возникающих в ходе разработки лекарственных средств в рамках программ раннего доступа, таких как схема PRIority MEdicines (PRIME) в Европейском Союзе, и содействие прорывной терапии в Соединенных Штатах. Отчет содержит рекомендации о следующих шагах и сферах, которые будут дополнительно изучены EMA и FDA.
«С PRIME мы создали платформу, которая поддерживает разработку многообещающих лекарственных средств, чтобы помочь пациентам с неудовлетворенными медицинскими потребностями как можно раньше получить от них пользу», — отметила руководитель отдела поддержки исследований и разработок лекарств для человека EMA Энрика Альтери (Enrica Alteri).
В семинаре приняли участие представители компетентных органов ЕС, EMA, FDA и Японии, а также отраслевые деятели. Он транслировался в прямом эфире на веб-сайте EMA.
О схеме
PRIME — это схема, запущенная EMA для усиления поддержки в разработке лекарственных средств, направленных на неудовлетворенные медицинские потребности. С момента запуска PRIME в марте 2016 г. EMA получила и оценила в общей сложности 246 запросов на участие, из которых 55 удовлетворены (рис. 1).
Через PRIME агентство оказывает заблаговременную и активную помощь разработчикам, включая создание дизайна клинических исследований и прочие научно-консультационные услуги (рис. 2).
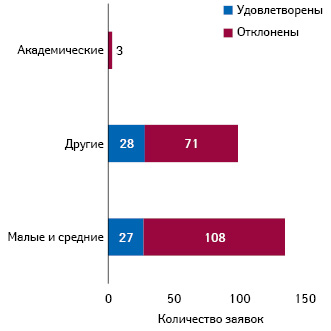
(по состоянию на июль 2019 г.)
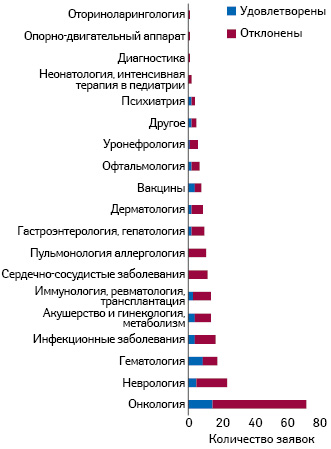

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим