Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 8 декабря сообщило, что имеется достаточно данных для выдачи разрешения на экстренное применение вакцины для профилактики COVID-19 американской компании «Pfizer» и немецкой «BioNTech».
«Данные о безопасности, эффективности и иммуногенности в заявке на экстренное применение обеспечивают положительную оценку рисков и пользы вакцины от COVID-19 компаний «Pfizer» и «BioNTech», а также соответствуют требованиям к данным, указанным в руководстве FDA относительно экстренного использования», — отмечено в документе, опубликованном на сайте FDA. Компании «BioNTech» и «Pfizer» подали заявку в FDA на экстренное одобрение своей вакцины 20 ноября. Консультативный комитет FDA соберется 9 декабря, чтобы принять решение об экстренном разрешении.
Наиболее частыми побочными эффектами были реакции в месте инъекции, усталость и головная боль, за которыми следовали мышечная боль, озноб, боль в суставах и лихорадка (рис. 1). Более серьезные реакции наблюдались только у 4,6% участников, чаще в возрасте 12 лет и старше (у 4,6% испытуемых такого возраста), чем в группе лиц в возрасте старше 55 лет (у 2,8%). Серьезные нежелательные побочные эффекты выявлены менее чем у 0,5% участников исследования, причем в обеих группах (получавших вакцину и плацебо) — одинаково. 6 пациентов умерли во время исследования, 2 из них получили вакцину, а 4 — плацебо. Исследователи считают, что ни одна из смертей не связана с вакциной.
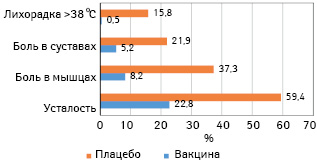
К известным преимуществам вакцины FDA относит снижение риска подтвержденного COVID-19, возникающего по крайней мере через 7 дней после 2-го введения вакцины, а также после первой дозы, до введения второй. То есть вакцина, по-видимому, обеспечивала некоторую защиту через 10 дней после первой дозы, будучи рассчитана на две дозы с интервалом 21 день. Еще одним преимуществом стало снижение риска подтвержденного тяжелого заболевания COVID-19 в любое время после первого введения. Отмечена также ограниченность данных для оценки эффективности вакцины в предупреждении передачи COVID-19 от вакцинированных в случае инфицирования последних.
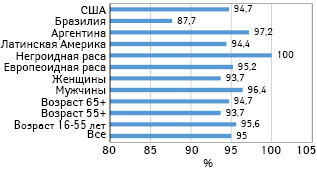
Анализ показал, что вакцина была эффективной во всех возрастных и расовых группах (рис. 2), хотя большинство заболевших были европеоидной расы, многие — в возрасте 55 лет и моложе. Так, среди заболевших 162 участника получили плацебо, а 8 — вакцину. Из них 146 были европеоидной расы по сравнению с 7 получавшими плацебо, что свидетельствует о примерно 95% эффективности.
Президент «Pfizer» Альберт Бурла (Albert Bourla) обещает, что цена на вакцину не будет заоблачной. Выручкой от продажи в странах с невысоким уровнем дохода вообще постараются лишь компенсировать производственные затраты. Вторая вакцина от «Moderna Inc.» пройдет аналогичную проверку на следующей неделе.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим