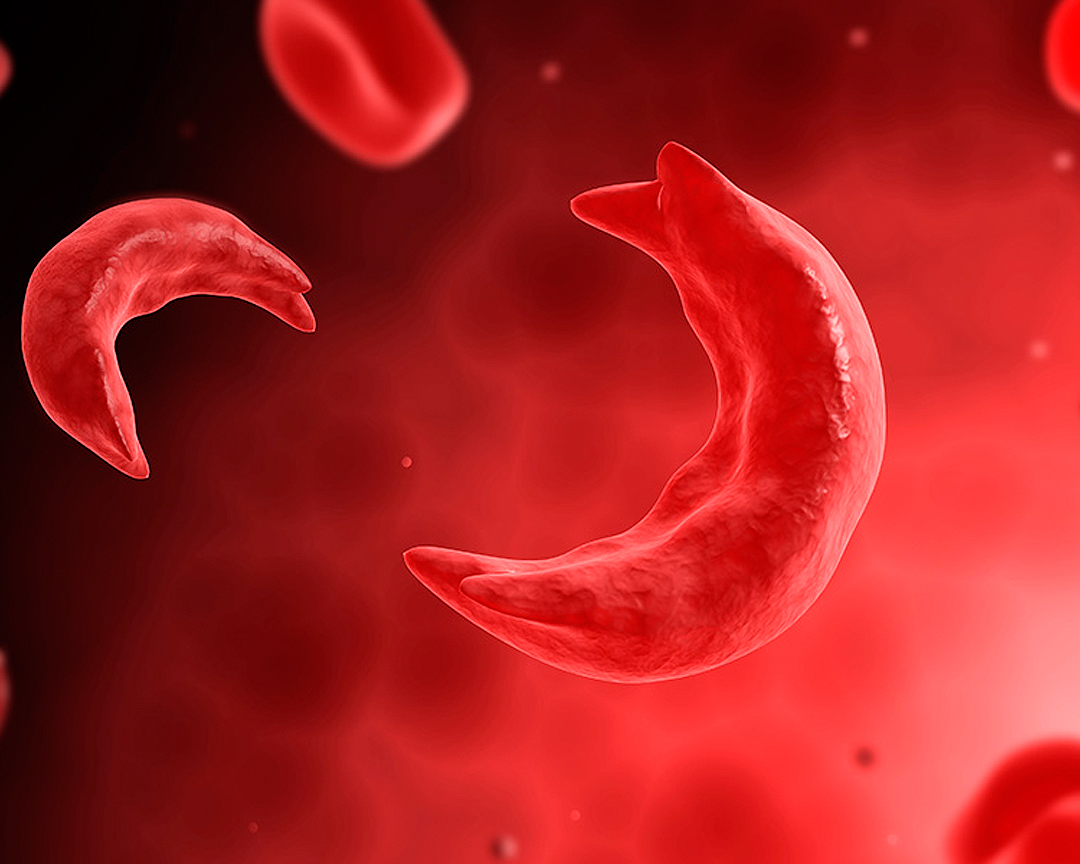
 Управління з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) схвалило два препарати генної терапії — Casgevy та Lyfgenia — перші засоби для лікування серповидно-клітинної анемії у пацієнтів віком від 12 років. Крім того, Casgevy є першим схваленим FDA препаратом, що ґрунтується на новій технології редагування геному.
Управління з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) схвалило два препарати генної терапії — Casgevy та Lyfgenia — перші засоби для лікування серповидно-клітинної анемії у пацієнтів віком від 12 років. Крім того, Casgevy є першим схваленим FDA препаратом, що ґрунтується на новій технології редагування геному.
Цей препарат призначений для пацієнтів із рецидивуючими вазооклюзійними кризами. Він є першою схваленою FDA терапією з використанням CRISPR/Cas9-технології редагування геному — розрізання ДНК у цільових ділянках, що дає змогу її редагувати (видаляти, додавати чи замінювати). Модифіковані стовбурові клітини крові трансплантують назад пацієнту, де вони приживаються (прикріплюються та розмножуються) у кістковому мозку та підвищують виробництво фетального гемоглобіну. У пацієнтів із серповидно-клітинною анемією підвищений рівень фетального гемоглобіну запобігає серпоподібному перетворенню еритроцитів.
Інший препарат — Lyfgenia, також схвалений для лікування пацієнтів віком від 12 років із серповидно-клітинною анемією та вазооклюзійними подіями в анамнезі. Лентивірусний вектор (носій доставки генів) з його складу модифікує стовбурові клітини крові пацієнта для вироблення HbAT87Q — гемоглобіну, який функціонує подібно до нормального дорослого гемоглобіну А, що виробляється в осіб без серповидно-клітинної анемії. Червоні кров’яні тільця, що містять HbAT87Q, мають нижчий ризик серпоподібного перетворення і закупорювання кровотоку.
Обидва продукти виготовляються з власних стовбурових клітин крові пацієнтів, які модифікуються та повертаються у вигляді одноразової інфузії в рамках трансплантації гемопоетичних (кров’яних) стовбурових клітин. Перед лікуванням у пацієнта збирають власні стовбурові клітини, а потім він повинен пройти мієлоаблативне кондиціонування (високодозова хіміотерапія) — процес, який видаляє клітини з кісткового мозку, щоб їх можна було замінити модифікованими клітинами. Пацієнти, які отримували препарати, проходитимуть довготривале дослідження для оцінки безпеки та ефективності кожного продукту.
Обидві заявки — щодо Casgevy і Lyfgenia, від компаній Vertex Pharmaceuticals Inc. та Bluebird Bio Inc. відповідно, отримали позначення Priority Review, Orphan Drug, Fast Track та Regenerative Medicine Advanced Therapy.
За матеріалами www.fda.gov

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим