 З чого починається хімія…
З чого починається хімія…
З кожним разом людству на шляху його розвитку потрібні все складніші та складніші хімічні речовини, із все більш витонченою структурою. Саме тому на шляху прогресу хімічні реакції, завдяки яким можна було б створити такі речовини, все більше і більше ускладнювалися: від найпростіших способів отримання елементарних хімічних сполук у процесі горіння, плавлення, реакцій відновлення ми перейшли до найбільш складних способів органічного синтезу. Спочатку хіміки отримували багато речовин методом проб і помилок, але потім навчилися передбачати хід реакцій і створювати оптимальні умови для синтезу того чи іншого продукту.
Усі живі організми складаються з органічних сполук, при цьому «молекулярний скелет» абсолютно всіх органічних молекул становить більш-менш складний ланцюжок сполучених між собою атомів вуглецю (вуглець-вуглецевий зв’язок) і є, мабуть, найважливішим хімічним зв’язком для всього живого на Землі.
Атом вуглецю, як і всі інші атоми, являє собою позитивно заряджене ядро, оточене шарами електронних хмар. При цьому для хіміків більш цікавий саме зовнішній шар, тому що саме із зовнішніми хмарами зазвичай відбуваються перетворення, які ми називаємо хімічними реакціями. У процесі хімічної реакції атом прагне добудувати свій зовнішній електронний шар так, аби довкола ядра оберталися вісім електронів. Сам по собі атом вуглецю має лише чотири зовнішні електрони, тому в хімічному зв’язку з іншими атомами він прагне узагальнити чотири хмари, що належать іншим, щоби досягти таким чином заповітної стабільної «вісімки». Так, у простій органічній молекулі — метані (CН4) — атом вуглецю спільно «володіє» електронами з чотирма атомами водню.
Проте для створення лікарських засобів (наприклад, з протипухлинною активністю, антибактеріальною або знеболювальною дією) все ж необхідні речовини з більш складною структурою. Інколи такі сполуки зустрічаються в природі. Так, наприклад, в кінці 1980-х років з глибини 33 м з дна Карибського моря була виловлена губка Discodermia dissoluta, яка захищається від ворогів складним органічним токсином. Дослідники встановили, що багато речовин, які виробляє ця губка, проявляють протимікробні, противірусні або протизапальні властивості. Однією з перших речовин, яка була виділена з даної губки та ідентифікована у 1990 р. співробітниками Інституту океанографії Харбора Бренча (Harbor Branch Oceanographic Institution; штат Флоріда, США), став (+)-дискодермолід (Gunasekera S.P., Gunasekera M., Longley R.E. et al., 1990). Дослідження показали, що ця речовина діє аналогічно одному з досить відомих препаратів, що застосовують при різних формах раку, — паклітакселу, який пригнічує синтез мікротрубочок і не дозволяє раковим клітинам множитися. Проте тих мікроскопічних кількостей цієї речовини, які можна отримати лише за допомогою водолазів із глибоких місць Карибського моря (дискодермолід розкладається під дією світла і тому на мілині добути його неможливо), не вистачило б навіть на детальні дослідження, не кажучи вже про промислове виробництво препаратів для лікування раку. Саме тому налагодити лабораторний, а потім і промисловий синтез таких речовин є не лише дуже принадним, але і важливим завданням. Забігаючи наперед, відзначимо, що завдяки паладієвому каталізу, за розробку якого в 2010 р. були нагороджені Нобелівською премією з хімії три вищезазначених дослідники, шляхом поліпшення різних варіантів багатостадійного синтезу дискодермоліду співробітникам дослідницького підрозділу фармацевтичної компанії «Novartis International AG» вдалося отримати 20 г цієї речовини та у 2004–2005 рр. дійти до завершення доклінічних і початку клінічних досліджень. До 2009 р. ці випробування були припинені через те, що препарат проявляв високу токсичність. Проте все ж лишаються перспективи його застосування у комбінації з іншими протипухлинними засобами (Molinski T.F., Dalisay D.S., Lievens S.L. et al., 2009); його доклінічні дослідження продовжуються і в цей час співробітниками дослідницької групи професора Амоса Сміта (Amos B. Smith III) з університету Пенсільванії (University of Pennsylvania) у співпраці з «Kosan Biosciences Inc.» (Хейвард, Каліфорнія; у даний час компанія належить «Bristol-Мyers Squibb Corp.») (Mickel S.J., Paterson I., Florencе G. et al., 2004; absmithgroup.chem.upenn.edu). Багатьма фармкомпаніями і дослідницькими центрами сьогодні проводиться вивчення протипухлинної активності й інших морських природних сполук (таблиця).
| Таблиця | Деякі морські природні сполуки — потенційні протипухлинні ліки (Стоник В.А., 2009; Grоnning T. et al., 2004) |
| Сполука | Біологічне джерело | Хімічнаприрода | Механізм дії | Компанія | Статус клінічних досліджень |
|---|---|---|---|---|---|
| Бріостатин-1 | Мохуватка | Полікетид | Інгібітор протеїнкінази | «GPC Biotech AG» | II фаза |
| Доластатин-10 | Молюск | Пептид | Інгібітор утворення мікротрубочок | «NCI/Knoll» | II фаза досліджень похідного TZT-1027 |
| HTI286 | Губка | Трипептид | – | «Novartis» | Продовження |
| Дискодермолід | Губка | Полікетид | – | «Novartis» | II фаза |
| Криптофіцин | Ціанобактерія | Циклічний депсипептид | – | «Eli Lilly&Co., Inc.» | Знятий з II фази |
| Аплідин | Асцидія | Циклічний депсипептид | Викликає окислювальний стрес клітин | «PharmaMar S.A.» («Zeltia Group») | II фаза |
| Ерибуліну мезилат | Губки | Похідне поліефіру | Інгібітор утворення мікротрубочок | «Eisai Inc.» | III фаза |
| Скваламін | Акула | Стероїд | Інгибітор ангіогенезу | «Genaera Corp.» | Знятий з II фази |
| Кохалалід F | Молюск | Циклічний депсипептид | Має лизосоматропну дію | «PharmaMar» | II фаза |
| Салиноспорамід А | Морська бактерія | Лактам-лактонне похідне | Інгібітор протеосом | «Nereus Pharmaceuticals» | II фаза |
Місце зустрічі — паладій

Якщо такі сполуки, як, наприклад, білкові молекули, можна отримати завдяки методам генної інженерії, то небілкові доводиться синтезувати майже штучно у хімічній лабораторії. При цьому як цеглини у майбутній складній конструкції виступають декілька низькомолекулярних органічних молекул. Дуже часто перед хіміками-синтетиками виникає питання: як змусити ці речовини взаємодіяти між собою? Адже атом вуглецю в органічній молекулі стабільний і змусити його вступити в будь-яку реакцію з іншими атомами є великою складністю. Завдання, як «розворушити» атом вуглецю і зробити його реакційноздатним, намагалися вирішити багато хіміків. І деякі — досить успішно. Так, на початку ХХ ст. Франсуа Гріньяр (Fran?ois Auguste Victor Grignard), нобелівський лауреат 1912 р., вперше знайшов спосіб «обдурити» вуглець і зробити його активнішим — він пов’язав його з атомом магнію, внаслідок чого вуглець втратив стабільність і «зайнявся пошуками» іншого атома вуглецю для того, щоб утворити з ним хімічний зв’язок: маючи на зовнішній орбіталі лише 2 електрони, магній легко віддає їх вуглецеві та виступає вельми привабливим партнером по хімічній реакції. Якщо розглядати приклад вже згадуваного вище метану, то замість того, щоб ділити атоми з воднем, вуглець у цій молекулі може «відтягнути» на себе пару електронів магнію, загалом майже повністю забравши їх собі. Завдяки такому хитрому трюку атом вуглецю стає іоном, оскільки виникає дисбаланс між позитивно зарядженим ядром та електронною оболонкою, яка отримує перевагу в два очки. Цей дисбаланс робить атом «агресивним», він, як кажуть хіміки, атакує інші атоми вуглецю й утворює з ними ковалентний зв’язок. Згодом ця реакція стала носити ім’я свого першовідкривача — реакція Гріньяра.
Метод, що був відкритий Ф. Гріньяром, став найважливішим інструментом органічної хімії та хімічної промисловості. Із ним вчені й технологи зуміли синтезувати масу органічних сполук. Проте коли справа дійшла до особливо великих і складних сполук, хіміки зіткнулися з низкою ускладнень. Головний недолік подібного методу полягав у тому, що «обдурений» і «агресивний» вуглець починав реагувати буквально зі всіма підряд атомами вуглецю, які тільки були поблизу. Таким чином утворювалася маса побічних продуктів, що знижувало вихід необхідної речовини і робило завдання розділення хімічної суміші практично неможливим. Відкриття паладієвого каталізу стало без перебільшення справжнім проривом, оскільки дозволило проводити реакції по «зшиванню» атомів вуглецю з високою вибірковістю і у досить м’яких умовах. Це надзвичайно важливо для багатостадійного синтезу (такого як синтез дискодермоліда), який практично неможливий у разі великої кількості побічних продуктів.
Усього ж за час існування Нобелівської премії п’ять премій з хімії було присуджено саме за розробку методів синтезу, які приводили б до виникнення зв’язку між двома атомами вуглецю. Окрім Ф. Гріньяра, премії за рішення цієї важливої задачі удостоїлися Отто Дільс (Otto Diels) і Курт Альдер (Kurt Alder) (премія 1950 р.), Герберт Браун (Herbert C. Brown) і Георг Віттіг (Georg Wittig) (премія 1979 р.), Ів Шовен (Yves Chauvin), Роберт Груббс (Robert H. Grubbs) і Річард Шрок (Richard R. Schrock) (премія 2005 р.). Нарешті, Нобелівська премія 2010 р. також була присуджена «за вживання реакцій крос-сполучення* з використанням паладієвих каталізаторів в органічному синтезі».
Нобелівські лауреати з хімії 2010 р. розробили методики для двох типів реакцій, де як каталізатор виступає паладій. Хімізм каталітичної реакції полягає в тому, що атом паладію виступає немов майданчиком для зустрічі двох атомів вуглецю, які завдяки ньому розташовуються так близько один до одного, що взаємодія починається саме між ними, а не між якимись іншими атомами. При цьому паладій, як і належить каталізатору, в такій реакції не витрачається, що важливо, враховуючи те, що цей метал належить до дорогоцінних.
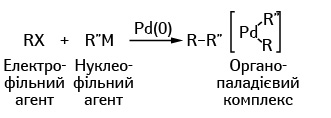
В обох типах реакцій взаємодіють два реагенти — електрофільний (з дефіцитом електронної щільності) і нуклеофільний (з надлишком електронної щільності). У ролі електрофільного агента завжди виступає молекула вуглеводню (R), в якому кінцевий атом водню заміщено атомом галогену (Х = хлор, бром, йод), а от нуклеофільні агенти розрізняються. В одному випадку (рис. 1) використовується молекула олефіну (лінійного вуглеводня з одним подвійним зв’язком), а в іншому (рис. 2) — металоорганічна сполука (М = цинк, бор або олово). Спочатку утворюється комплекс атому паладію з електрофільним агентом, а потім цей комплекс взаємодіє з нуклеофільною сполукою.
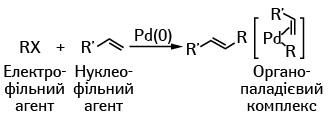
Р. Хек, що був співробітником хімічної компанії в штаті Делавер (США), почав працювати у сфері паладієвого каталізу у 1960-х роках, коли світом пройшла інформація про те, що німецький хімічний концерн «Wacker Chemie AG» почав використовувати паладій для промислового отримання ацетальдегіду з етилену. У 1968 р. Р. Хек опублікував ряд робіт, в одній з яких він розповідав про приєднання до ароматичного кільця молекули етилену за участю паладієвого каталізатора з отриманням стиролу — вихідної сировини для отримання полістиролу. Пізніше вдосконалена реакція отримала назву реакції Хека; у наш час це один з основних способів утворення одинарних зв’язків між атомами вуглецю. Сьогодні реакція Хека широко використовується в хімічному виробництві, наприклад, такого протизапального препарату, як напроксен, або засобу для лікування астми монтелукасту. Не дуже тривіальним шляхом — у декілька стадій — за цією методикою можна отримати наркотичний анальгетик морфін і його похідні, а також синтезувати стероїдні гормони (статеві гормони, гормони кори надниркової залози) і стрихнін.
Е. Негіші в 1977 р. працював у тому ж напрямку, вдосконаливши реакцію Гріньяра шляхом заміни в ній іону магнію на цинк, а також застосовуючи паладій. При використанні цинку ступінь активації вуглецю нижче порівняно з «класичним» для реакції Гріньяра магнієм, проте цинк дозволяє координувати вуглець на все тому ж атомі паладію, що визначає високу вибірковість реакції Негіші (рис. 3). Двома роками пізніше А. Сузукі проводив досліди з використанням як «активуючого» атому бору, який є найбільш м’яким і найменш токсичним елементом серед згаданих, що надто важливо під час промислового виробництва. Реакція Сузукі, зокрема, використовується в промисловому виробництві фунгіцидів.
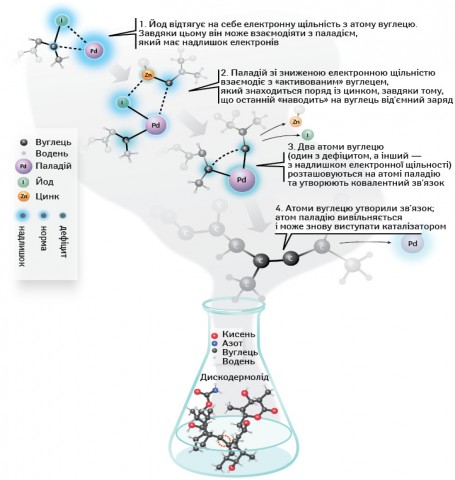
У теперішній час відкриття, яке зробили Р. Хек, Е. Негіші та А. Сузукі, широко застосовують в органічному синтезі, наприклад для модифікації природних молекул, а також підтвердження хімічної структури тієї чи іншої природної сполуки, що можна довести, лише синтезувавши штучний аналог у пробірці і порівнявши його властивості з властивостями природної речовини. Як перший приклад можна навести ванкоміцин — антибіотик, вперше виділений у 1950 р. зі зразка ґрунту джунглів Борнео. У наші дні він використовується для боротьби з мікроорганізмами, резистентними до багатьох інших антибіотиків (таких як пеніцилін), — метіцилінстійкого золотистого стафілококу та ентерококів. Учені за допомогою паладієвого каталізу прагнуть створити похідні цього антибіотику, щоб перемогти резистентність і дати людству надійний інструмент для боротьби з інфекціями. Проте найбільше значення має, звичайно ж, створення за допомогою паладієвого каталізу найскладніших органічних речовин. Одна з таких — палітоксин, що зустрічається в отруті шестипроменевих коралів зоонтарій, виділений вперше у 1971 р. на Гавайях. Палітоксин складається з 129 атомів вуглецю, 223 атомів водню, 3 атомів азоту і 54 атомів кисню. Синтез такої величезної органічної молекули надихнув хіміків на інші подвиги, що підвело нас до того, з чого ми, власне, почали свою розповідь: погляди дослідників з R&D-підрозділів фармкомпаній сьогодні звернені до тих речовин, що зустрічаються в природі. Їх синтез був би неможливий без реакцій Негіші та Сузукі. Завдяки ним на сьогодні вже вдалося синтезувати дазонамід А з філіппінської асцидії, який продемонстрував активність відносно раку кишечнику, а також синтетичний аналог драгмацидіну F з морської губки з італійського узбережжя, який проявляє дію відносно вірусів ВІЧ і герпесу (Cutignano A., Bifulco G., Bruno I. et al., 2000; Garg N., Caspi D., Stoltz B., 2004; Wang G., Shang L., Burgett A. et al., 2007; Laport M.s., Santos O.c.s., Muricy G., 2009; nobelprize.org). Проте найголовнішою подією стало, звичайно ж, схвалення Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration) в середині листопада 2010 р. препарату Halaven™ (ерибуліну мезилат, «Eisai») як засобу хіміотерапії раку молочної залози (www.fda.gov; www.nature.com). Ерибулін є синтетичним аналогом частини структури галіхондрина В (halichondrin B) — сполуки, що її було отримано з морської губки Halichondria okadai. У 1986 р. вчені, відкривши цю сполуку, з’ясували, що вона має потужну протипухлинну активність, проте основною перешкодою для глибших досліджень стало те, що вміст цієї речовини в природному джерелі дуже малий, і це істотно ускладнювало її виділення. Сполука також мала дуже складну структуру: на момент відкриття цієї речовини синтез її з нуля для хіміків був далеко за межами можливостей. Вся річ у тім, що багато сполук природного походження мають атоми вуглецю, що виступають як хіральні центри, завдяки яким ці речовини здатні утворювати різні оптичні ізомери або їх суміші; при цьому вказані ізомери, незважаючи на те, що в хімічній реакції вони поводяться ідентично, можуть проявляти різну фармакологічну активність. Галіхондрин В має 32 таких хіральних центри, внаслідок чого кількість можливих для нього оптичних ізомерів становить близько 4 млрд.
Японська компанія «Eisai» зайнялася синтезом аналогів галіхондрину В, один з яких — ерибулін — виявився більш потужим. Хоча його хімічна структура була порівняно простіше, ніж у галіхондрина В, він все одно має 19 хіральних центрів, що робило його синтез у промислових масштабах практично неможливим. Синтез цієї речовини японською компанією «Eisai» сьогодні складається з 62 кроків — досить тривалий процес як для отримання лікарського засобу. Подальші клінічні дослідження показали, що ерибулін здатний збільшити тривалість життя пацієнтів із раком молочної залози на пізніх стадіях у середньому на 2,5 міс серед тих з хворих, у яких було неефективне лікування іншими хіміотерапевтичними засобами, наприклад паклітакселом. Сьогодні аналітики прогнозують, що обсяг продажу ерибуліну в разі його схвалення при інших формах раку може сягнути 1 млрд дол. США, що зробить його одним із небагатьох препаратів-блокбастерів.
Випадок з ерибуліном свідчить, що, незважаючи на всі перепони, синтез таких складних органічних сполук все ж може бути успішним і досягнення, зроблені у сфері органічного синтезу, дають можливість отримувати сполуки у промислових кількостях. А це означає, що дуже скоро на озброєнні у фармацевтів з’являться ще більш складні, але й більш ефективні ліки.
за матеріалами nobelprize.org;
www.nature.com; www.chem.purdue.edu; www.fda.gov
Purdue University та nobelprize.org
 Японський хімік Акіра Сузукі народився 12 вересня 1930 р. у містечку Мукава, що розташоване на острові Хоккайдо. Закінчив університет Хоккайдо (Hokkaido University) в Саппоро. Після здобуття ступеня доктора філософії залишився працювати в альма-матер як асистент. Після цього 3 роки (з 1963 по 1965 р.) працював із Гербертом Чарльзом Брауном (Herbert Charles Brown) в університеті Пердью (Purdue University). Після закінчення співпраці з Г.Ч. Брауном повернувся до рідного університету, де вже працював у статусі професора. У 1994 р. А. Сузукі полишає університет Хоккайдо та 1 рік працює у Окаямському університеті (Okayama University of Science). А з 1995 по 2002 р. працює в Університеті наук і мистецтва Курашікі (Kurashiki University of Science and the Arts). У 1979 р. ним було опубліковані перші відомості про органічні реакції, що каталізуються паладієм. У багатьох сучасних публікаціях цей процес називають також реакцією Сузукі — Міяури, або сполученням Сузукі. Японський хімік Акіра Сузукі народився 12 вересня 1930 р. у містечку Мукава, що розташоване на острові Хоккайдо. Закінчив університет Хоккайдо (Hokkaido University) в Саппоро. Після здобуття ступеня доктора філософії залишився працювати в альма-матер як асистент. Після цього 3 роки (з 1963 по 1965 р.) працював із Гербертом Чарльзом Брауном (Herbert Charles Brown) в університеті Пердью (Purdue University). Після закінчення співпраці з Г.Ч. Брауном повернувся до рідного університету, де вже працював у статусі професора. У 1994 р. А. Сузукі полишає університет Хоккайдо та 1 рік працює у Окаямському університеті (Okayama University of Science). А з 1995 по 2002 р. працює в Університеті наук і мистецтва Курашікі (Kurashiki University of Science and the Arts). У 1979 р. ним було опубліковані перші відомості про органічні реакції, що каталізуються паладієм. У багатьох сучасних публікаціях цей процес називають також реакцією Сузукі — Міяури, або сполученням Сузукі.
Американський хімік Річард Хек народився 15 серпня 1931 р. у Спрінгфілді (штат Массачусетс). У 1952 р. отримав ступінь бакалавра в Каліфорнійському університеті (University of California), а за 2 роки там же отримав ступінь доктора філософії. Потім переїхав до Швейцарії, де працював у вищій технічній школі Цюріха (Eidgen?ssische Technische Hochschule Z?rich). Після цього повернувся до Лос-Анджелеса та деякий час працював у Каліфорнійському університеті, поки в 1957 р. компанія «Hercules» не запропонувала йому роботу. З 1971 р. і до виходу на пенсію у 1989 р. Р. Хек працював в університеті штату Делавер (University of Delaware). Мабуть, найкориснішим застосуванням відкриття Р. Хека стало використання паладію в реакціях алкіну з арілгалогенідом; ця реакція активно використовується для флуоресцентного забарвлення ДНК, що дозволяє аналізувати послідовність елементів в ДНК і спрощує дослідження людського геному. |

 Японський хімік
Японський хімік 
Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим