
ВІД РЕДАКЦІЇ
Рекомендації Всесвітньої організації охорони здоров’я (ВООЗ) щодо належної регуляторної практики (НРП) були розроблені відповідно до резолюції 67-ї Всесвітньої асамблеї охорони здоров’я WHA 67.20 щодо посилення системи регулювання медичних продуктів. Український переклад цього тексту зроблений відповідно до ліцензії CC BY-NC-SA 3.0 та публікується у «Щотижневику АПТЕКА» для некомерційних цілей.
©МОРІОН, 2024
Цей переклад не був створений ВООЗ. ВООЗ не несе відповідальності за зміст або точність цього перекладу. Оригінальне англомовне видання Звіту Експертного комітету ВООЗ зі специфікацій для фармацевтичних препаратів (П’ятдесят п’ятий звіт) (WHO Expert Committee on Specifications for Pharmaceutical Preparations: Fifty-fifth report). Женева: Всесвітня організація охорони здоров’я; 2021. Ліцензія: CC BY-NC-SA 3.0 IGO є обов’язковим і автентичним виданням.
Вказані рекомендації узагальнюють сучасний міжнародний досвід зі створення і посилення ефективних національних регуляторних органів у фармацевтичній галузі, який є наразі вкрай актуальним при створенні в нашій країні нового органу державного контролю (ОДК) відповідно до Закону України «Про лікарські засоби» від 28 липня 2022 р. № 2469-IX.
Переклад, підготовлений Юлією Мирошниченко, фахівцем зі зв’язків з громадськістю та пресою корпорації «Артеріум», публікується за науковою редакцією Сергія Сура, доктора фармацевтичних наук, директора із взаємодії з регуляторними органами корпорації «Артеріум».
ВІД НАУКОВОГО РЕДАКТОРА
У 1990–2010-х роках в країнах Азії, Африки та Латинської Америки зі слабкими регуляторними системами повідомлялося про десятки випадків погіршання здоров’я і навіть випадків смерті людей після застосування фальсифікованих та субстандартних ліків. При цьому найбільш резонансні і масштабні випадки смерті і госпіталізації людей в країнах, що розвиваються, були спричинені не фальсифікованими, а субстандартними зареєстрованими препаратами, виробленими із відхиленнями від вимог Належної виробничої практики (Good Manufacturing Practice — GMP) легальними виробниками з цих країн.
Після аналізу й обговорення цієї інформації стало зрозуміло, що зменшення кількості небезпечних ліків і зниження ризиків від них для пацієнтів у вказаних країнах може бути забезпечено посиленням національних систем регулювання медичних продуктів (лікарських засобів і медичних виробів).
Відповідно, Всесвітня асамблея охорони здоров’я у 2014 р. в резолюції WHA 67.20 «Regulatory system strengthening for medical products» закликала країни — члени ВООЗ вжити заходів щодо посилення національних систем регулювання медичних продуктів і дала доручення генеральному директору ВООЗ, зокрема, «продовжити розробку відповідних норм, стандартів і рекомендацій з урахуванням національних, регіональних і міжнародних потреб і ініціатив, з урахуванням принципів ВООЗ».
Ця задача була успішно виконана — в 2018–2023 рр. ВООЗ опублікувала ряд рекомендацій щодо оцінки і посилення національних систем регулювання медичної продукції:
- Guidance on good practices for desk assessment of compliance with good manufacturing practices, good laboratory practices and good clinical practices for medical products regulatory decisions: WHO TRS 1010, 2018, Annex 9.
- Collaborative procedure in the assessment and accelerated national registration of pharmaceutical products and vaccines approved by stringent regulatory authorities: WHO TRS 1010, 2018, Annex 11.
- Good practices of national regulatory authorities in implementing the collaborative registration procedures for medical products: WHO TRS 1019, 2019, Annex 6.
- Quality management system requirements for national inspectorates: WHO TRS 1025, 2020, Annex 5.
- WHO guideline on the implementation of quality management systems for national regulatory authorities: WHO TRS 1025, 2020, Annex 13.
- Good reliance practices in the regulation of medical products: high level principles and considerations: WHO TRS 1033, 2021, Annex 10.
- Good regulatory practices in the regulation of medical products: WHO TRS 1033, 2021, Annex 11.
- Evaluating and publicly designating regulatory authorities as WHO listed authorities: WHO, 2021, 20 p.
- WHO Global Benchmarking Tool (GBT) for Evaluation of National Regulatory System of Medical Products — Revision VI: WHO, 2021, 350 p.
- Manual for benchmarking of the national regulatory system of medical products and formulation of institutional development plans: WHO, 2021, 81 p.
- Global competency framework for regulators of medicines: WHO, 2023, 108 p.
- Manual for the performance evaluation of regulatory authorities seeking the designation as WHO listed authorities, version 2.0. Geneva: World Health Organization; 2023, 282 p.
- Operational guidance for evaluating and publicly designating regulatory authorities as WHO-listed authorities: WHO, 2023, 44 p.
У зв’язку з найближчими планами створення в Україні нового ОДК ми вирішили підготувати український переклад одних з найбільш важливих для виконання цієї задачі Рекомендацій ВООЗ «Good regulatory practices in the regulation of medical products: WHO TRS 1033, 2021, Annex 11». На наш погляд, він може бути корисний як проєктній команді МОЗ зі створення ОДК, так і широкій професійній фармацевтичній спільноті.
Український текст цих Рекомендацій можна буде використовувати при підготовці проєктів статутних документів, політик, процедур та інструкцій нового ОДК. А для розвитку і налаштування роботи ОДК надалі використовувати й інші документи ВООЗ, перелічені вище.
Додаток 11
Належна регуляторна практика (НРП) в регулюванні медичних продуктів
Передмова (Вступ)
Фундаментальною роллю уряду є захист та сприяння здоров’ю та безпеці населення, зокрема шляхом надання медичної допомоги. Добре функціонуюча система охорони здоров’я потребує доступних медичних продуктів, які є безпечними, ефективними та гарантовано якісними. Оскільки медичні продукти є важливими при профілактиці, діагностиці та лікуванні захворювань, застосування неякісної та фальсифікованої медичної продукції може нести загрози для життя людей. Це викликає занепокоєння, оскільки споживачі медичних продуктів зазвичай не в змозі самі оцінити їхню якість. Тому важливо, щоб їх інтереси та безпека були підтверджені регуляторним органом або органами, які забезпечують доступність ліків, що знаходяться на ринку лише на законних підставах, а продукти, що продаються, є безпечними, відповідають заявленій дії і мають гарантовану якість.
Регулювання медичної продукції стає дедалі складнішим у зв’язку із глобалізацією їх розробки, виробництва, постачання та швидких технологічних і соціальних змін в умовах обмежених фінансових та людських ресурсів. Важливість надійних систем регулювання була визнана 67-ю Всесвітньою асамблеєю охорони здоров’я, коли була схвалена резолюція WHA 67.20 про посилення систем регулювання медичних продуктів. У резолюції зазначається, що «ефективні системи регулювання є важливим компонентом зміцнення системи охорони здоров’я та сприяють покращенню здоров’я населення», «регулятори є важливою частиною працівників охорони здоров’я» і що «неефективні системи регулювання самі по собі можуть бути перешкодою для доступу до безпечних, ефективних та якісних медичних продуктів» (23).
Надійна система нагляду вимагає, щоб регуляторні органи підтримувалися ефективною системою законів, нормативних актів і настанов, а також щоб вони мали компетентність, спроможність, ресурси та наукові знання для виконання своїх повноважень в ефективний і прозорий спосіб. Якою мірою регуляторна система виконує свої політичні цілі — залежить від якості її розробки та впровадження. НРП має вирішальне значення для ефективної роботи регуляторної системи і, як наслідок, довіри громадськості до цієї системи. Водночас вона встановлює чіткі вимоги до установ, які регулюються. Надійна регуляторна структура, включно з міжнародними нормами та стандартами, підбором і розвитком компетентного персоналу, є необхідною, але недостатньою умовою для забезпечення «належного нагляду». Усі співробітники в регуляторних органах повинні керуватися НРП при встановленні відповідних вимог і формулюванні рішень, які є чіткими, прозорими, послідовними, неупередженими, пропорційними, своєчасними та науково обґрунтованими. Регульовані та інші зацікавлені сторони також відіграють важливу роль у забезпеченні чіткого ефективного регуляторного середовища з гарантією, що доступними для пацієнтів є медичні продукти лише із забезпеченою якістю.
Зміст
Подяки 6
Абревіатури до Додатка 11 6
Резюме 6
1. Вступ 7
2. Мета 7
3. Сфера застосування 7
4. Глосарій 7
5. Цілі 8
6. Ключові міркування 8
7. Огляд регуляторної системи медичних продуктів 9
7.1 Складові нормативно-правової бази 9
7.2 Компоненти регуляторної системи 9
8. Принципи належної регуляторної практики 11
8.1 Законність 11
8.2 Узгодженість 12
8.3 Незалежність 13
8.4 Неупередженість 13
8.5 Пропорційність 14
8.6 Гнучкість 14
8.7 Чіткість 15
8.8 Ефективність 16
8.9 Прозорість 17
9. Рушійні сили Належної регуляторної практики 19
9.1 Політична та всебічна підтримка з боку уряду 19
9.2 Ефективна організація та належне управління, підтримане лідерством 19
9.3 Міжорганізаційна та внутрішньоорганізаційна комунікація, співпраця та координація 19
9.4 Надійна та ефективна система управління якістю 19
9.5 Достатні та стабільні ресурси 19
9.6 Компетентні людські ресурси 19
9.7 Організаційна етика та цінності 19
9.8 Науково-інформаційний підхід до ухвалення рішень 19
10. Впровадження належних регуляторних практик 19
Список використаної літератури 20
Подяки
ВООЗ висловлює подяку всім авторам, зацікавленим сторонам і організаціям, які долучилися до підготовки цього документа.
Абревіатури до Додатка 11
| АТЕС (APEC) | Азійсько-Тихоокеанське економічне співробітництво (Asia–Pacific Economic Cooperation) |
| АДПСА (ASEAN) | Асоціація держав Південно-Східної Азії (Association of Southeast Asian Nations) |
| НРП (GRP) | Належна регуляторна практика (Good regulatory practices) |
| ОЕСР (OECD) | Організація економічного співробітництва та розвитку (Organisation for Economic Co-operation and Development) |
Резюме
Основна роль уряду полягає в захисті та зміцненні здоров’я та безпеки населення, зокрема наданні медичної допомоги. Злагоджене функціонування системи охорони здоров’я потребує доступних медичних продуктів, які є безпечними, ефективними та гарантовано якісними.
Сектор медичної продукції є однією з найбільш регульованих галузей через вплив різноманітних медичних продуктів на здоров’я, труднощі в оцінці їх якості, безпеки, ефективності або дієвості та складності розробки, виробництва, постачання та нагляду. Саме тому важливо, щоб інтереси та безпека громадськості були покладені на регуляторний орган або органи, які забезпечують доступність лише тих продуктів, що продаються на законних підставах, а також безпеку цих продуктів, які мають відповідати заявленим для них дії і якості.
Регуляторні органи зобов’язані забезпечити регулювання в спосіб, який уможливлює досягнення цілей державної політики. Має бути створена і реалізована послідовна правова база, що забезпечує необхідний рівень нагляду, одночасно сприяючи інноваціям і доступу до безпечних, ефективних і якісних медичних продуктів. Система також повинна мати необхідну гнучкість та оперативність, особливо при виникненні надзвичайних ситуацій у сфері охорони здоров’я, беручи до уваги нові технології та практики, і сприяти поширенню міжнародної регуляторної співпраці.
Уряди несуть витрати, встановлюючи та підтримуючи регуляторні системи задля захисту та покращення здоров’я своїх громадян. Регульовані сторони несуть витрати при дотриманні регуляторних вимог. Однак неефективні системи регулювання негативно впливають на системи охорони здоров’я, що має значні потенційні наслідки на захворюваність та смертність, витрати на охорону здоров’я та економіку.
Надійна правова база, ухвалення міжнародних норм і стандартів, а також підбір і розвиток компетентного персоналу є необхідними, але недостатніми умовами для забезпечення «належного регуляторного нагляду». Ці заходи повинні поєднуватися з належною регуляторною практикою (НРП), якою керуються всі особи в організаціях з регулювання медичних продуктів, яким доручено ухвалення рішень, які є чіткими, прозорими, послідовними, неупередженими, пропорційними, своєчасними і базуються на науковому підході та законодавстві.
НРП можна визначити як набір принципів і практик, що застосовуються до розробки, впровадження та перегляду регуляторних інструментів — законів, нормативних актів та рекомендацій — задля досягнення цілей у сфері громадського здоров’я в найефективніший спосіб. Успішне застосування НРП є ознакою сучасної, науково обґрунтованої регуляторної системи, в якій нормативні акти допомагають отримати бажані результати. НРП забезпечує засоби формування та реалізації надійного, доступного та ефективного регулювання медичних виробів як важливої частини ефективності та сталості системи охорони здоров’я.
Цей документ призначений для ознайомлення держав-членів з широко визнаними принципами НРП, підготовленими на основі широкого огляду публічних документів, опублікованих урядами та багатосторонніми організаціями, а також багатьох інших консультативних семінарів, порівняльного аналізу та взаємодії з державами-членами. 9 принципів, представлених у цьому документі, — законність, цілісність, незалежність, неупередженість, пропорційність, гнучкість, чіткість, ефективність та прозорість — актуальні для всіх органів влади, відповідальних за регулювання медичних продуктів, незалежно від їх ресурсів, складності чи регуляторної моделі. Регульовані та інші зацікавлені сторони також відіграють важливу роль у створенні ефективного регуляторного середовища.
НРП служить основою для нормативних документів кращої практики регулювання. Сукупність рекомендаційних документів ВООЗ призначена для забезпечення регуляторних органів вичерпними вказівками щодо покращення їх діяльності. Цей документ буде доповнено практичними посібниками та інструментами, призначеними для полегшення впровадження НРП.
1. Вступ
Цей документ адресований національним органам, відповідальним за регулювання медичних продуктів (див. 4. Глосарій) і містить рекомендації щодо заповнення загальних прогалин в регуляторній практиці, виявлених під час порівняльного аналізу. Цей документ розроблений на основі документів, опублікованих багатосторонніми органами, такими як Азійсько-Тихоокеанське економічне співробітництво (АТЕС) (10), Організація економічного співробітництва та розвитку (ОЕСР) [11, 12], Світовий банк [13] та Асоціація держав Південно-Східної Азії (АДПСА) [14], а також настанов, опублікованих низкою урядів. Документ також враховує попередні документи ВООЗ, які стосуються аспектів НРП [15–22] та досвіду ВООЗ у застосуванні інструменту глобального порівняльного аналізу ВООЗ (ІГПА) і поширенні принципів НРП. Правильне впровадження НРП через механізми НРП у системі регулювання (див. 4. Глосарій) може призвести до бажаних регуляторних результатів і впливу.
2. Мета
Цей документ представляє принципи НРП вищого рівня. Вони призначені служити орієнтиром і спрямовувати держави-члени застосовувати належні практики регулювання медичних продуктів. Цей документ також призначений направляти держави-члени у визначенні пріоритетних функцій їх регуляторних систем відповідно до їх ресурсів, національних цілей, політик охорони здоров’я, політик щодо медичних продуктів та середовища медичних продуктів. Цей «заснований на принципах» документ буде доповнено практичними посібниками та інструментами для полегшення впровадження НРП організаціями, відповідальними за регулювання медичних продуктів. Цей базовий документ доповнений відповідними інструкціями щодо найкращих нормативних практик, зокрема належних практик управління [24], належних практик довіри [25], належних практик перевірки [26] та управління системою якості (див. 4. Глосарій) для національних регуляторних органів (НРО) [27]. Ця група документів призначена для надання регуляторним органам комплексних інструкцій щодо підвищення їх ефективності.
3. Сфера застосування
Цей документ містить принципи та міркування щодо розробки та використання регуляторних інструментів, які підтримують регуляторну діяльність. Представлені поширені практики і додаткові атрибути визначають ефективність регуляторної системи для медичних продуктів.
Цей документ актуальний для всіх регуляторних органів, незалежно від їх ресурсів, зрілості або регуляторної моделі. Принципи НРП вищого рівня однаково прийнятні для наднаціональних (наприклад регіональних), національних і субнаціональних систем регулювання та систем, в яких декілька установ відповідальні за регулювання певних різних продуктів або видів діяльності в країні чи юрисдикції. Цей документ також призначений для ряду суміжних аудиторій: установ і осіб, що формують правила, відповідальних за створення політик охорони здоров’я, законів та настанов; інституцій, які разом утворюють національні чи наднаціональні системи регулювання медичних продуктів; і регуляторні мережі та зацікавлені сторони, на які впливають нормативно-правові акти, такі як виробники або розробники медичних продуктів.
4. Глосарій
Наведені нижче визначення застосовуються до термінів, які використовуються в цьому документі. Вони можуть мати різні значення в інших контекстах. Також заохочуємо читачів звернутися до суміжних рекомендацій ВООЗ, щоб отримати більш повні визначення, що відповідають належним регуляторним практикам (див. Список використаної літератури).
Співрегулювання (Co-regulation). Система спільної регуляторної відповідальності, в якій галузева асоціація або професійна група бере на себе певні регуляторні функції, наприклад, нагляд, впровадження або встановлення регуляторних стандартів.
Міжнародні стандарти та настанови (International standards and guidelines). Для цілей цього документа термін включає відповідні стандарти та рекомендації ВООЗ та будь-які інші відповідні, визнані на міжнародному рівні, стандарти (наприклад Міжнародної організації стандартизації (ISO) або фармакопейні стандарти) і настанови (наприклад Міжнародна рада з гармонізації технічних вимог до фармацевтичних препаратів для використання людьми (ICH) або настанови Конвенції про фармацевтичну інспекцію та Схема співпраці з фармацевтичної інспекції (PIC/S)).
Медична продукція (Medical product). Для цілей цього документа цей термін включає лікарські засоби, вакцини, кров і продукти крові та медичні вироби, зокрема для діагностики in vitro.
Надзвичайна ситуація у сфері охорони здоров’я (Public health emergency). Умова, згідно з якою влада має оголосити про надзвичайний стан у сфері охорони здоров’я, визначена як:
- поява або безпосередня загроза хвороби або стану здоров’я, спричинені біотероризмом, епідемією чи пандемією, або новим і надзвичайно смертельним інфекційним агентом або біологічним токсином, який створює ризик значної кількості випадків смерті людей або інцидентів, або постійної чи довгострокової втрати працездатності.
Оголошення надзвичайного стану у сфері охорони здоров’я дозволяє владі призупинити державне регулювання та змінити функції державних органів [1].
Система управління якістю (Quality management system). Відповідна інфраструктура, що включає організаційну структуру, процедури, процеси, ресурси та систематичні дії, необхідні для забезпечення достатньої впевненості в тому, що продукт або послуга задовольняють заявлені вимоги до якості.
Визнання (Recognition). Ухвалення регуляторного рішення іншого регулятора або іншої довіреної установи. Визнання має ґрунтуватися на доказах того, що нормативні вимоги іншого регуляторного органу є достатніми для того, щоб відповідати нормативним вимогам перевіряючого органу. Визнання може бути одностороннім або взаємним, і в останньому випадку воно може бути предметом взаємної угоди про визнання.
Нормативна конвергенція (Regulatory convergence). Добровільний процес, за допомогою якого регуляторні вимоги в різних країнах або регіонах стають більш подібними або «узгодженими» через деякий час. Конвергенція є результатом поступового впровадження на міжнародному рівні визнаних технічних керівних документів, стандартів та наукових принципів, загальноприйнятих або подібних практик і процедур або встановлення відповідних національних регуляторних механізмів, які відповідають спільним принципам досягнення загальної мети здоров’я населення [2].
Регуляторне співробітництво (Regulatory cooperation). Практика серед регуляторних органів задля ефективного та продуктивного регулювання медичних продуктів. Може практикуватися агенцією, організацією чи урядом. До формальних механізмів належить створення спільних інститутів, договорів і конвенцій, таких як взаємне визнання угод, тоді як менш формальні механізми включають обмін інформацією, наукову співпрацю, спільну оцінку ризиків, спільні огляди та інспекції й розробку стандартів. Може також включати роботу з міжнародними партнерами з нарощування регуляторного потенціалу або надання технічної допомоги, таким чином сприяючи удосконаленню практики міжнародного регуляторного управління [3–6].
Регуляторна гармонізація (Regulatory harmonization). Процес, за якого технічні документи регуляторних органів кількох країн уніфікуються [7].
Аналіз регуляторного впливу (Regulatory impact analysis). Процес вивчення ймовірних впливів запропонованого регулювання та альтернативних правил задля розробки процесу [8].
Нормативний запас (Regulatory stock). Збір або інвентаризація накопичених нормативних актів.
Регуляторна система (Regulatory system). Поєднання інститутів, процесів і нормативної бази, за допомогою яких уряд контролює певні аспекти діяльності [9].
Довіра (Reliance). Акт, який бере до уваги регуляторний орган в одній юрисдикції і надає значну вагу оцінкам іншого регуляторного органу чи довіреної установи чи будь-якої іншої авторитетної інформації задля ухвалення власного рішення. При цьому регуляторний орган, що здійснює перевірку, залишається незалежним і несе відповідальність за ухвалені рішення, навіть якщо вони спираються на рішення, оцінки та інформацію інших регуляторних органів.
5. Цілі
НРП забезпечує обґрунтоване та ефективне регулювання медичних продуктів як важливої частини ефективності та стійкості системи охорони здоров’я. Якщо вона буде впроваджена цілісно та ефективно, це може зумовити більш якісне регулювання, краще ухвалення регуляторних рішень і їх відповідність, ефективніші системи регулювання і кращі результати у сфері охорони здоров’я.
НРП допомагає забезпечувати актуальність регуляторним системам, оскільки як технології, так і системи, в яких вони використовуються, продовжують розвиватися. У все більш складному, взаємопов’язаному регуляторному середовищі НРП також сприяють довірі між регуляторними органами та іншими зацікавленими сторонами, такими як промисловість, академічні кола, дослідницькі центри та працівники сфери охорони здоров’я, тим самим сприяють міжнародній співпраці та ухваленню ефективніших та більш дієвих підходів до забезпечення якості, безпеки та ефективності медичних продуктів у світовому регуляторному співтоваристві. Кінцевою метою НРП є служіння та захист громадського здоров’я, а також інтересів пацієнтів, з дотриманням усіх застосовних етичних принципів.
6. Ключові міркування
Сектор медичних продуктів є однією з найбільш регульованих галузей через вплив різноманітних медичних продуктів на здоров’я та суспільство, труднощі в оцінці їх якості, ефективності або дієвості та безпеки, уроки, винесені з трагедій у сфері охорони здоров’я, та складності розвитку, виробництва, постачання та моніторингу медичних продуктів, щоб переконатися, що їх дія відповідає заявленій. Тому багато країн укладають усе складніші збірки законів, правил та інструкцій задля контролю усіх аспектів життєвого циклу медичних продуктів.
З урахуванням необхідних правил та інструментів для виконання публічно наданих повноважень регуляторні органи зобов’язані забезпечити регулювання таким чином, щоб досягти цілей державної політики. Тому вони повинні встановити та запровадити узгоджену нормативну базу для забезпечення необхідного рівня нагляду і контролю, одночасно сприяючи інноваціям і доступу до безпечних, ефективних та високоякісних медичних продуктів. Система також повинна мати необхідну гнучкість та оперативність, особливо в питаннях надзвичайних ситуацій у сфері охорони здоров’я (див. 4. Глосарій), беручи до уваги нові технології та практики, і сприяти поширенню міжнародної регуляторної співпраці (див. 4. Глосарій).
Регуляторні органи та автори законів усе частіше впроваджують сучасні моделі регулювання, які реагують на обмеження ресурсів, відповідаючи на виклики, пов’язані з розвитком науки, глобалізацією, зростанням суспільних очікувань і надзвичайних ситуацій у сфері охорони здоров’я. Слабка або неефективна регуляторна система може обмежити доступ до безпечних, ефективних та високоякісних медичних продуктів та становити загрозу для здоров’я населення. Оскільки країни зміцнюють свій регуляторний потенціал, вони повинні переконатися, що їх регуляторні системи є науково обґрунтованими, що вони дотримуються міжнародних стандартів і вказівок і що їх підхід використовує внесок інших, надійних регуляторних органів та установ, коли це можливо. З цією метою країнам пропонується сформулювати і впроваджувати політику та стратегії, які сприяють міжнародній співпраці [23], конвергенції, гармонізації, обміну інформацією та довірі (див. 4. Глосарій) як частини НРП [25]. ВООЗ створює основу для оцінки НРО і регіональних регуляторних систем та для визначення тих, що відповідають вимогам ВООЗ [28].
Як зазначено вище, необхідність регуляторного контролю медичних продуктів для охорони здоров’я населення повністю визнана. Питання полягає в тому, яким чином регулювати ефективно та прозоро, щоб відповідати інтересам системи охорони здоров’я. Важливе значення має послідовне застосування НРП у всіх аспектах нагляду, у забезпеченні задоволення цих інтересів і бази для ефективності регуляторної системи. НРП — це принципи і практики, що застосовуються для розробки, впровадження та перегляду нормативних інструментів — законів, нормативних актів та рекомендацій — для досягнення цілей громадського здоров’я найбільш ефективним способом. НРП прищеплює культуру передового досвіду між установами, відповідальними за регуляторний нагляд, щоб забезпечити застосування регулювання справедливо, послідовно й ефективно.
7. Огляд регуляторної системи медичних продуктів
Визначення є важливими для загального розуміння понять. Тим часом як більше термінів визначено в Глосарії, терміни «нормативна база», «законодавча база», «регуляторний орган», «система регулювання» та «регуляторні результати» пояснюються нижче, щоб забезпечити належне розуміння їх використання в цьому документі.
7.1 Складові нормативно-правової бази
У цьому документі терміни «закон» і «регулювання» використовуються для опису складових частин нормативно-правової бази (пов’язане законодавство). Можуть бути й інші значення, які використовуються в деяких юрисдикціях, наприклад «акт» замість «закон» або «указ» замість «регулювання».
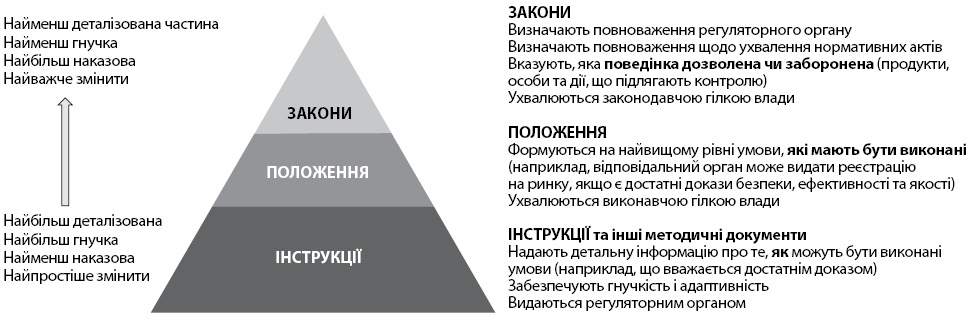
Закони (Laws) загалом визначають роль та обов’язки установ, у цьому випадку регуляторного органу, міністерства охорони здоров’я чи інших відповідних організацій. Вони визначають продукцію, осіб і види діяльності, які підлягають регулюванню та окреслюють, що дозволяється, а що — ні. Що більш важливо, закони уповноважують установу ухвалювати нормативно-правові акти нижчого рівня (або підзаконні акти).
Положення (Regulations) — це різноманітний набір інструментів, за допомогою яких уряди встановлюють вимоги до підприємств і громадян. Нормативні акти зазвичай на вищому рівні встановлюють умови, які повинні бути виконані, і вимоги, визначені в законодавстві. Наприклад, закон може заборонити виробництво, імпорт або продаж медичного продукту за відсутності спеціального дозволу, тоді як правила формують умови для отримання дозволу, наприклад, надання певних видів інформації (результати неклінічних і клінічних випробувань, дані про виробництво та контроль), які дозволяють регуляторному органу оцінити якість, безпеку, ефективність або дієвість медичного продукту.
Інструкції (Guidelines) (та інші нормативні документи) надають додаткові відомості про те, як регульовані зацікавлені сторони можуть дотримуватися законів і правил. Інструкції можуть також надати детальну інформацію про процеси забезпечення виконання відповідного законодавства (законодавчі акти). У рамках нормативної бази для медичних продуктів такі документи, як правило, необов’язкові і зазвичай мають більш деталізовану і наукову природу. Таким чином, вони підходять для опису підходів, які зазвичай вважаються придатними для задоволення нормативних вимог, але непридатні для включення в законодавство (рис. 1).
7.2 Компоненти регуляторної системи
Регуляторний орган (Regulatory authority) — це державна(і) установа(и) або державний орган або органи, уповноважені законом здійснювати незалежний регуляторний нагляд за розробкою, виробництвом, маркетингом і контролем медичних продуктів. Хоча цей термін передбачає, що відповідальність несе одна організація за всі регуляторні функції, ці функції можуть виконуватися однією або більше установами, які підпорядковуються тому самому чи іншому вищому органу. Регуляторний орган відіграє вирішальну роль у забезпеченні якості, безпеки, ефективності і дієвості медичних продуктів, а також актуальності і точності інформації про продукт.
Нормативна база (Regulatory framework) — це збірка законів, постанов, інструкцій, керівних документів та інших нормативних документів, за допомогою яких уряд і регуляторний орган контролюють окремі аспекти конкретної діяльності.
Нормативно-правова база (Legal framework) — це частина регуляторної бази, яка містить обов’язкові законодавчі акти, такі як закони та нормативні акти.
Регуляторні результати (Regulatory outputs) — це результати або продукти регуляторного органу, такі як звіти про перевірки та оцінки, рішення та маркування продукції.
Термін регуляторна система (regulatory system) використовується для опису комбінації органів, процесів, нормативної бази та ресурсів, які разом є невід’ємною частиною ефективного регулювання медичних продуктів в країні або юрисдикції кількох країн. НРП слід враховувати та застосовувати до всієї регуляторної системи.
Рис. 2 ілюструє принципи та механізми НРП і компоненти регуляторної системи.
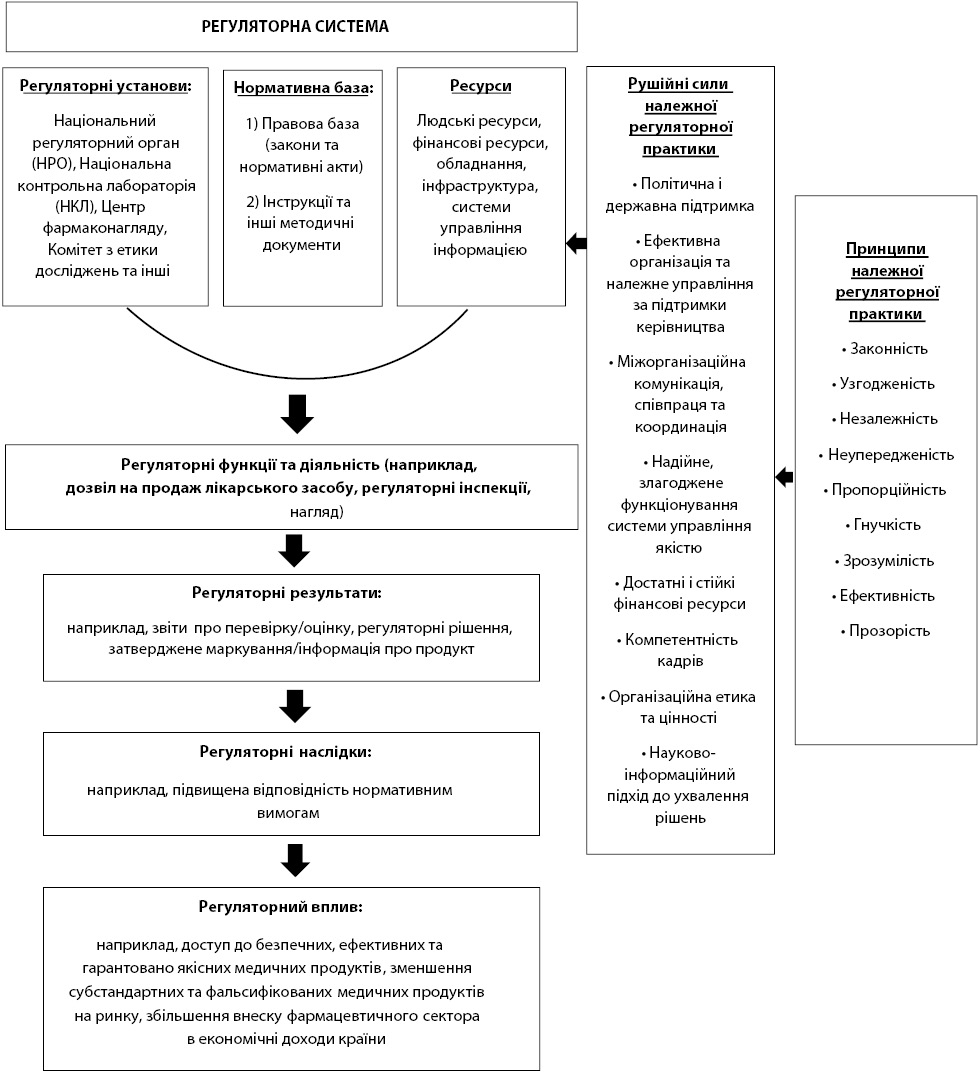
У загальній регуляторній системі саме ці три компоненти роблять свій внесок найбільше у регуляторні функції і діяльність: (і) нормативна база, складається із законодавчої бази (законів і нормативних актів), інструкцій та інших методичних документів; (іі) регуляторні установи, які можуть бути представлені однією або декількома організаціями, включаючи НРО, національну контрольну лабораторію, центри фармаконагляду та комітети з етики досліджень; та (ііі) усі типи ресурсів, які включають людські та фінансові ресурси, інфраструктуру, обладнання та системи управління інформацією. Нормативні результати залежать від відповідних функцій та діяльності (наприклад регуляторні дозволи на продаж лікарського засобу, звіти про перевірку та оцінку). Концепції та принципи НРП застосовуються до загальної системи регулювання, як пояснювалося вище. Для застосування і запровадження НРП суттєвими є кілька механізмів (див. розділ 9). Чинники належної регуляторної практики). Бажаного регуляторного результату можна досягти, коли принципи НРП належним чином реалізуються через вказані чинники.
ВООЗ поділяє спектр регуляторної діяльності на 7 загальних регуляторних функцій, які застосовуються до всіх медичних продуктів: нагляд за клінічними випробуваннями, реєстрація, фармаконагляд, ринковий нагляд і контроль, ліцензування закладів, регуляторні інспекції та лабораторний контроль [29]. Крім того, ряд додаткових функцій застосовується до деяких медичних продуктів, наприклад, видача дозволів на офіційний випуск серій вакцин або інших біологічних препаратів.
Термін регуляторний орган (regulatory authority) зазвичай означає, що одній організації доручено виконувати всі регуляторні функції. Але це не завжди так. Наприклад, різні організації можуть нести юридичну відповідальність за регулювання ліків, вакцин, а також медичних виробів. Навіть коли один орган відповідальний за всі регуляторні функції, аспекти, критичні для певних функцій, можуть знаходитися поза межами його повноважень, наприклад ті, що здійснюються наглядовими центрами, які мають офіційні відносини з владою; сюди входять такі заходи, як збір звітів про несприятливі події, контроль неякісних та фальсифікованих медичних продуктів та моніторинг реклами. Певні регуляторні функції можуть здійснюватися третіми сторонами, як у випадку аудиторських організацій для медичних виробів. Для забезпечення комплексної та ефективної регуляторної системи мають бути визначені чіткі ролі, відповідальність, процеси і канали зв’язку серед різних організацій, відповідальних за виконання регуляторних функцій.
Регуляторна діяльність також може здійснюватися на наднаціональному рівні (наприклад регіональному), національному або субнаціональному рівнях. Приклади включають наднаціональну оцінку певних продуктів з метою реєстрації, дійсної для кількох країн, або перевірки певних виробничих майданчиків для медичних продуктів щодо належної виробничої практики на національному рівні.
8. Принципи належної регуляторної практики
Не існує універсальної моделі регулювання медичних продуктів. Кожен підхід відображає національну політику та пріоритети охорони здоров’я, національний соціально-економічний розвиток, наявність ресурсів та інфраструктури, систему охорони здоров’я, національну правову систему, потужність у галузі наукових досліджень і розробки, а також потужність місцевого виробництва. Проте, як і в інших регульованих секторах, існує зростаючий міжнародний консенсус щодо найкращих практик, які слід використовувати при регулюванні медичних продуктів.
Огляд опублікованих документів щодо НРП [10, 13, 14, 30] вказує на загальні практики, які мають бути ухвалені всіма установами, відповідальними за або залученими до регулювання медичних продуктів. Ці принципи застосовуються однаково до розробки та впровадження регуляторного нагляду та щоденної регуляторної діяльності. НРП керується головними принципами. 9 принципів перелічені в таблиці і описані нижче з урахуванням відповідних аспектів регулювання медичних продуктів. Ці принципи, практики та приклади будуть детальніше розглянуті у додаткових рекомендаціях, які доповнять цей документ.
| Законність (Legality) | Регуляторні системи та ухвалені на їх підґрунті рішення повинні мати надійну правову базу. |
| Цілісність (Consistency) | Регуляторний нагляд за медичними продуктами має відповідати існуючим державним політикам і законодавству та застосовуватися у систематичний та передбачуваний спосіб. |
| Незалежність (Independence) | Установи, які виконують регулювання медичних продуктів, повинні бути незалежними. |
| Неупередженість (Impartiality) | До всіх регульованих сторін слід ставитися однаково, справедливо та без упередженості. |
| Пропорційність (Proportionality) | Регулювання та регуляторні рішення повинні бути пропорційні ризику та можливостям регулятора щодо їх впровадження та реалізації. |
| Гнучкість (Flexibility) | Регуляторний нагляд не повинен бути директивним, натомість має бути гнучким у реагуванні на мінливе середовище та непередбачувані обставини. Можливість своєчасного реагування на конкретну потребу, зокрема у випадках надзвичайних ситуацій у сфері охорони здоров’я, має бути вбудоване в регуляторну систему. |
| Чіткість (Clarity) | Нормативні вимоги мають бути доступними та зрозумілими користувачам. |
| Ефективність (Efficiency) | Регуляторні системи повинні досягати своїх цілей у межах зумовленого терміну, раціонально докладаючи зусиль та витрачаючи кошти. Міжнародне співробітництво сприяє ефективності, забезпечуючи найкраще використання ресурсів. |
| Прозорість (Transparency) | Регуляторні системи повинні бути прозорими; вимоги та рішення мають бути відомими, а також має здійснюватися залучення громадськості до регуляторних пропозицій. |
8.1 Законність
Регуляторні системи та ухвалені на їх підґрунті рішення повинні мати надійну правову базу.
Ключові елементи:
- Нормативна база повинна забезпечувати необхідні повноваження, сферу дії та гнучкість для захисту та зміцнення здоров’я.
- Делегування повноважень і обов’язків на різні рівні регуляторної системи має бути чітким.
- Нормативно-правова база повинна підтримувати та надавати регуляторним органам можливість сприяти міжнародному співробітництву та отримувати користь від нього.
- Необхідно створити системи, які гарантуватимуть можливість перегляду регуляторних рішень і санкцій.
- Нормативно-правова база повинна чітко визначати сферу дії та межі повноважень установ, які формують регуляторну систему, задля забезпечення її цілісності.
- Регуляторний орган повинен нести відповідальність за свої дії та рішення перед суспільством, тими, кого регулюють, і урядом у рамках правового поля.
Принцип законності вимагає, щоб регуляторна система була структурованою таким чином, щоб усі регуляторні дії та рішення ґрунтувалися на чітких правових повноваженнях, поважаючи «верховенство права».
Регуляторний орган існує для досягнення цілей, які уряд вважає суспільними інтересами. Він повинен діяти в межах та відповідно до повноважень, наданих законодавчою базою [31]. Закон або акт, яким засновується регуляторний орган, повинен чітко визначати мету законодавства, повноваження органу, сферу та діяльність, яка підлягає регулюванню, положення щодо ухвалення нормативних актів.
Делегування влади та відповідальності на різні рівні регуляторної системи має бути чітким і зрозумілим. У випадках, коли до регулювання медичних продуктів залучено більше однієї установи або рівня уряду, функції та відповідальність кожного повинні бути зрозумілі та взаємодоповнюватися, а також мають бути визначені процеси комунікації та координації між ними (див. розділ 8.2 Узгодженість).
Оскільки співпраця між регуляторними органами є важливою для розв’язання дедалі складніших та міжюрисдикційних питань, сучасна правова база для медичних продуктів повинна підтримувати та заохочувати всі форми співпраці, зокрема конвергенцію, гармонізацію, обмін інформацією, довіру та визнання (див. 4. Глосарій). В найкращому випадку це має бути чітко вказано в положеннях законів та/або нормативних актів, а операційні деталі надані в політиках і процедурних інструкціях. Законодавча база не повинна забороняти такі форми регуляторної співпраці, як використання оцінок і рішень інших контролюючих органів та установ у власній діяльності. Співпраця не змінює суверенної відповідальності та обов’язку кожного регуляторного органу захищати здоров’я та безпеку своїх громадян, але дозволяє обмінюватися передовими практиками, допомагає заощаджувати ресурси та уникати дублювання.
Законодавство має бути впроваджене для контролю та здійснення всіх необхідних регуляторних дій у межах спільних та окремих регуляторних функцій. Політики, рекомендації та процедури не можуть компенсувати відсутність законодавства. Правова структура повинна забезпечити цілісність регуляторної системи, надаючи чіткі повноваження, владу, ролі та відповідальність установам, які складають систему. Слід уникати конфліктів при організації регуляторних органів або в їх відповідальності.
Усі регуляторні органи повинні нести відповідальність перед громадськістю, організаціями, які підлягають регулюванню, та урядом за свої дії та рішення як частину належного управління та підзвітності. У контексті НРП регуляторні органи є підзвітними, якщо вони: (i) відповідають за дії відповідно до певних стандартів і зобов’язань, (ii) відповідають за свої дії та (iii) готові до наслідків у ситуаціях, коли стандарти або обов’язки не виконуються.
Регуляторні дії та рішення повинні узгоджуватися з повноваженнями та засобами контролю, передбаченими правовою базою. Отже, мають існувати процеси для перегляду регуляторних рішень, зокрема внутрішні апеляції і судові оскарження рішень регуляторних органів, наприклад, щодо процедурної справедливості та належної правової процедури, на додаток до наукових та адміністративних підстав.
8.2 Узгодженість
Регулювання медичної продукції має узгоджуватися з державною політикою та законодавством і застосовуватися послідовно та передбачувано.
Ключові елементи:
- Нормативно-правова база для медичних продуктів повинна бути узгоджена з національно-правовою та політичною структурами.
- Нові нормативні акти повинні доповнювати існуючі регуляторні інструменти, а не суперечити їм.
- Нормативні вимоги мають бути впроваджені та реалізовані послідовно для всіх секторів медичних продуктів та зацікавлених сторін.
Регулювання медичних продуктів має здійснюватися в контексті та узгоджено із національною законодавчою базою, загальною державною політикою та цілями сфери охорони здоров’я. Регулювання також має узгоджуватися з будь-якими договорами, конвенціями, регіональними чи міжнародними угодами, учасником яких є країна, а також будь-яким наднаціональним законодавством, що стосується держав-членів.
Слід уникати непорозумінь або конфліктів з існуючими законами, оскільки це призводить до плутанини, дублювання повноважень і непотрібної регуляторної роботи та підвищує ймовірність невиконання вимог. Виробники (для цілей цього документа виробники також означають власників реєстраційних посвідчень), імпортери, дистриб’ютори та інші зацікавлені сторони повинні мати можливість визначити з текстів законів і нормативних актів, який державний орган є відповідальним за регулювання. Узгодженість особливо важлива у випадках децентралізованого регулювання медичних продуктів, наприклад, центральними, державними або провінційними органами влади. Мають існувати ефективні системи консультацій, співпраці та координації між різними рівнями влади для сприяння національній уніфікованості регуляторних вимог з дотриманням місцевих законів. Усі регуляторні функції та діяльність мають бути ефективно інтегровані, щоб забезпечити цілісність регуляторної системи. Подібні міркування застосовуються, коли більше ніж одна установа чи відділ на одному рівні управління відповідають за різні або однакові регуляторні функції та продукти — така ситуація не є рідкісною. Невизначені або суперечливі повноваження та вимоги створюють складні регуляторні системи та ускладнюють ефективну комунікацію та координацію. У всіх випадках слід встановити офіційні механізми для належної координації під час розробки та виконання нормативних документів та діяльності органів, відповідальних за регулювання медичних продуктів.
Узгодженість регуляторних дій і рішень забезпечується, коли однакові або подібні обставини призводять до того самого або подібного результату. Тому важливо, щоб регуляторна система створювала інституційну пам’ять, записуючи рішення, щоб забезпечити подібне справедливе ставлення в майбутніх ситуаціях.
Незалежно від відмінностей у технологіях, має бути узгоджений рівень регуляторного нагляду щодо ризиків, який становлять різні типи медичних продуктів і суб’єктів, що регулюються (виробників, імпортерів та дистриб’юторів). Узгодженість забезпечується, коли регуляторна база передбачає можливість неупередженого оскарження регуляторних рішень. Виконання таких апеляцій та коригувальних заходів також має бути узгодженим між секторами.
Узгодженість гарантується достатніми чіткими регуляторними вказівками, які, за можливості, базуються на міжнародних рекомендаціях; програмами орієнтації та навчання для персоналу; регулярними, прозорими взаємодіями із регульованими та іншими зацікавленими сторонами (наприклад асоціаціями промисловості, пацієнтами, асоціаціями медичних фахівців та іншими відповідними урядовими установами). Ці механізми сприяють поліпшенню процесів, виявленню та розв’язанню проблем.
Впровадження належно функціонуючої системи управління якістю, яка охоплює всю регуляторну діяльність [33], є критичним для регуляторної узгодженості. Це включає впровадження процесного підходу, що передбачає систематичне визначення, управління регуляторними процесами та їх взаємодіями для досягнення запланованих результатів відповідно до політики якості та стратегічного напряму організації.
Показники ефективності, внутрішні перевірки та зовнішні аудити також можуть бути важливими для забезпечення узгодженості в застосуванні нормативних актів і регуляторних операцій.
8.3 Незалежність
Установи, відповідальні за регулювання медичних виробів, мають бути незалежними.
Ключові елементи:
- Регуляторна система має діяти незалежно та авторитетно, виконуючи свої обов’язки незалежно від політиків, уряду та регульованих організацій.
- Регуляторна діяльність і рішення мають бути позбавлені неправомірного впливу зацікавлених сторін.
- Важливим елементом є наявність належного фінансування та чітких процесів фінансування.
- Необхідно встановити незалежність керівництва задля забезпечення належної поведінки під час і після працевлаштування.
Відповідно до публікації ОЕСР під назвою «Створення культури незалежності» [32]:
«Регуляторні органи часто опиняються під тиском з боку різних зацікавлених сторін та груп інтересів, що може піддавати їх різноманітним формам впливу. З метою забезпечення правильного здійснення своїх дій та досягнення відповідних політичних результатів їм необхідно враховувати законні інтереси та захищати себе від неприйнятного чи надмірного впливу».
Належне управління та заходи з протидії корупції [24] повинні бути впроваджені в регуляторну структуру для усунення фактичних конфліктів інтересів, необґрунтованої упередженості або неприпустимого впливу зацікавлених сторін (також відомого як «регуляторне захоплення»). Для збереження довіри громадськості регуляторний орган повинен функціонувати відкрито, авторитетно та неупереджено і виконувати свої обов’язки незалежно від регульованих суб’єктів (наприклад дослідників та промисловості).
Коли регулятори фінансуються зі зборів, важливим є належний механізм відшкодування витрат для встановлення «правильного» збору та уникнення ситуації, коли регулятор недостатньо фінансується, потрапляє під вплив промисловості або стає об’єктом впливу виконавчого органу. Легше впливати на регулятора, який фінансується із загальних доходів уряду, зменшуючи його ресурси. Річні асигнування роблять регулятора більш вразливим до впливу, ніж багаторічні асигнування, які менше піддаються короткотерміновим ситуаціям, таким як політичні або виборчі накази. Належні заходи можуть захистити бюджет від неправомірного використання регулятором.
Вибір та призначення керівництва регулятора повинні ґрунтуватися на прозорих та відповідальних процесах. Необхідно встановити чіткі правила задля уникнення конфліктів інтересів з метою забезпечення незалежної поведінки під час і після працевлаштування.
8.4 Неупередженість
Усі регульовані сторони повинні бути контрольовані однаково, справедливо та без упередженості.
Ключові елементи:
- У регуляторній системі, її діях та рішеннях мають бути відсутні конфлікти інтересів чи необґрунтована упередженість.
- Регуляторний орган не повинен брати участі в діяльності, яку він регулює, або знаходитися в ієрархічному підпорядкуванні відносно установ, які виконують регульовану діяльність.
- Регуляторні рішення повинні ґрунтуватися на науці і доказах, а процес ухвалення рішень має бути надійним, відповідним визначеним критеріям.
Регуляторні інструменти мають бути створені таким чином, щоб регуляторні дії та рішення, ухвалені на основі таких інструментів, були легітимними, ґрунтувалися на доказах та були етичними. Публічні та приватні органи, а також внутрішні та зарубіжні суб’єкти мають регулюватися на рівних умовах, за тими самими принципами та у рамках одного й того ж законодавства для забезпечення конкурентної нейтральності.
Регуляторний орган повинен функціонувати неупереджено, виконуючи свої обов’язки незалежно від регульованих суб’єктів (див. розділ 8.3 Незалежність). Цей принцип поширюється на дослідників та інших експертів, які є членами наукових та консультативних комітетів, що надають рекомендації регуляторному органу з питань регуляторної політики чи дозволів на медичні вироби. Декларації про інтереси повинні бути заповнені та переглянуті, а правила відступу мають бути визначені до обговорень, щоб забезпечити цілісність та неупередженість комітету та його рекомендацій.
Регуляторний орган не повинен брати участі в діяльності, яку він регулює, або знаходитися в ієрархічному підпорядкуванні установам, які виконують регульовану діяльність, зокрема закупівлю медичних виробів міністерством охорони здоров’я чи іншою урядовою установою.
Регуляторні дії та рішення повинні базуватися на наукових даних і доказах та бути передбачуваними. Хоча належне регуляторне вирішення та відсутність дискреційних повноважень є необхідними в ефективному нагляді, дії та рішення повинні базуватися на регуляторних вимогах та доказах чи обставинах ситуації (див. також розділи 8.2 Узгодженість та 8.6 Гнучкість).
Регуляторам слід уникати стороннього впливу, вони мають бути відкритими та прозорими щодо своїх рішень та процесу їх ухвалення. Наукова та технічна база для регуляторного нагляду має бути об’єктивною та доступною. Консультації населення та прозорість у всьому процесі ухвалення рішень мають забезпечувати неупередженість, поліпшення регуляторних результатів та більшу довіру громадськості до використання регульованих продуктів.
8.5 Пропорційність
Регуляторний нагляд та регуляторні рішення повинні бути пропорційними ризику та здатності регулятора впроваджувати та забезпечувати виконання рішень.
Ключові елементи:
- Регуляторний нагляд має бути достатнім для досягнення мети, при цьому бути не занадто обтяжливим.
- Регуляторні заходи повинні бути пропорційними ризикованості продукту, діяльності чи послуги.
- Регулювання не повинно перевищувати національну здатність до його впровадження та забезпечення виконання.
- Оцінка медичних продуктів повинна базуватися на оцінці співвідношення користі та ризику, а також на постійному моніторингу профілю користі та ризику в надійній системі нагляду.
Принцип пропорційності вимагає, щоб дія не переходила межі того, що необхідно для досягнення запланованої мети. Цей принцип повинен використовуватися до всіх елементів регуляторної системи. Регулювання має застосовуватися лише тоді, коли це необхідно, і повинно бути адекватним для досягнення мети, не будучи занадто обтяжливим. Зміст та форма регулювання мають бути відповідними як самій проблемі, так і ризику, які вона представляє. Наприклад, для отримання дозволу на продаж нового медичного продукту необхідні широкі доклінічні та клінічні дослідження для забезпечення безпеки та ефективності, тоді як для генеричних лікарських засобів достатні in vivo біоеквівалентність чи in vitro дослідження.
Нормативно-правові механізми та інспекційні перевірки також повинні бути пропорційними ризику та серйозності порушення з метою зниження чи уникнення ризику для здоров’я, що виникає внаслідок такого порушення. Пропорційний підхід, що базується на ризику, дозволяє регулятору розподіляти ресурси туди, де є більша потреба. Він також гарантує, що вартість регулювання пропорційна характеру ризику. Наприклад, частота інспекцій може частково визначатися історією регулювання конкретного виробника.
Принцип пропорційності також застосовується до політик та процесів, на підставі яких здійснюється регулювання. Процес регулювання повинен бути гнучким та пропорційним складності та/або впливу проблеми, яку воно має розв’язати. Наприклад, для нового складного регуляторного процесу може знадобитися ретельний аналіз вартості та впливу, тоді як більш прагматичний підхід може використовуватися для простого регулювання або при обмеженні альтернативних політик.
Регулювання не повинно перевищувати національну здатність до впровадження та забезпечення його виконання.
Якщо відсутні стратегії, засоби та ресурси для впровадження та забезпечення реалізації, законодавство само по собі нічого не досягне. Закон із скромними цілями та завданнями, який належним чином впроваджується, є більш прийнятним, ніж вимогливий, але нереальний для реалізації [21].
Крім того, відсутність ресурсів чи можливостей щодо впровадження та реалізації являє собою обтяжливий фактор для урядів.
Оцінка медичних продуктів має базуватися на оцінці користі та ризику, на основі доказів щодо якості, безпеки та ефективності чи дієвості продукту. Усі продемонстровані переваги медичних продуктів повинні враховуватися при визначенні виявлених ризиків. Регуляторні системи мають включати відповідний нагляд і моніторинг профілю користі та ризику, щоб вживати необхідних заходів.
8.6 Гнучкість
Регуляторний нагляд повинен бути гнучким з огляду на мінливе середовище та непередбачувані обставини.
Ключові елементи:
- Регуляторна система, зокрема і її нормативна база, повинна забезпечувати достатню гнучкість для реагування на зміни в регульованому середовищі, наприклад на нові наукові дані і розвиток технологій.
- Регуляторна система має бути готова своєчасно реагувати на невідкладні ситуації, такі як надзвичайні ситуації у сфері громадського здоров’я та дефіцит медичних продуктів.
- Мова регулювання має відображати ефективність, коли це можливо, дозволяючи альтернативні підходи для досягнення того самого результату.
- Регуляторна система має забезпечувати гнучкість для застосування розумного судження.
Гнучкість необхідна, щоб нормативно-правова база та системи регулювання залишалися «відповідними меті». Тому розробка та використання нормативних інструментів мають бути відповідними. Змістовна, зрозуміла, працююча нормативна база повинна бути достатньо детальною для забезпечення її зрозумілості. Вона також має забезпечувати гнучкість реагування на нові технології та інновації та на зміни у регульованому середовищі і забезпечити своєчасну відповідь на непередбачені загрози громадському здоров’ю. Гнучкість регуляторного нагляду повинна базуватися на оцінці ризиків та не має ставити під загрозу якість, безпеку, ефективність або дієвість продуктів [28].
Реагування є розширеним принципом гнучкості. Воно надає можливість діяти швидше, ніж зазвичай, у певних обставинах. Наприклад, швидша реакція або огляд можуть бути необхідними в питаннях громадського здоров’я у надзвичайних ситуаціях.
Реагування обмежене в часі і тимчасове, оскільки воно необхідне у невідкладних ситуаціях, питаннях громадського здоров’я, при серйозній нестачі медичних продуктів без альтернатив, невирішених медичних потребах або рідкісних захворюваннях. Регуляторні системи повинні бути добре підготовлені та мати необхідні регуляторні інструменти для реагування та управління такими ситуаціями. Національний регулятор повинен мати гнучкі та прискорені програми розробки чи процеси огляду для прискорення доступу пацієнтів до інноваційних продуктів для серйозних, небезпечних для життя та рідкісних захворювань і розв’язання невирішених медичних потреб. Гнучкі положення є критичними для забезпечення того, щоб регуляторний орган міг ухвалювати рішення на підставі наявних наукових даних та розглядати переваги та ризики, часто в умовах неповної інформації (наприклад використання зі співчуття, дозвіл на екстрене використання або надання переліків). Відсутність необхідних регуляторних інструментів та гнучкості може бути значущою перешкодою для забезпечення громадської безпеки, особливо при надзвичайних ситуаціях у сфері охорони здоров’я.
Коли регуляторне реагування є суттєвим, регуляторний орган має розглянути питання про визначення пріоритетів своєї діяльності через підхід, що ґрунтується на оцінці ризику. Залучення політиків та осіб, що ухвалюють рішення, регуляторне співробітництво та координація в міжнародній регуляторній спільноті значно сприяють регуляторному реагуванню.
Метою гнучкості та реагування в регуляторних процесах має бути врахування еволюції науки та технології. Мова регулювання, яка підтримує закони, зазвичай більше базується на результативності, ніж на прописах [15], тим самим дозволяючи регульованим сторонам використовувати альтернативні підходи для досягнення того самого результату.
Найбільш деталізованими, найбільш гнучкими регуляторними інструментами є інструкції та інші керівні документи, які можна швидко змінювати. Такі властивості забезпечують можливість нормативній базі вчасно реагувати на нові ризики та дозволяють ймовірне використання досягнень регуляторної науки та технологій для майбутніх медичних продуктів. На відміну від законів та положень, інструкції самі по собі зазвичай не мають сили закону; проте інструкції є дуже ефективними, якщо вони належним чином закріплені в положеннях та використовуються для опису того, як можна досягнути відповідності з положеннями. Вони також повинні дозволяти інші, обґрунтовані підходи для досягнення відповідності. Альтернативні підходи до принципів та практик, описаних в рекомендаціях, можуть бути прийнятними за умови їх належного обґрунтування. Гнучкість та можливість змін у інструкціях втрачаються, якщо такі деталізовані тексти стають частиною положень.
Для науки, яка швидко розвивається, але недостатньо зріла, щоб обґрунтувати регуляторні інструкції, перелік «моментів, які слід розглянути» може надати корисні принципові рекомендації та визначення для просування найкращих практик, загального регуляторного розуміння та міжнародного зближення і підготувати ґрунт для кінцевих інструкцій. Міжнародні рекомендації та стандарти завжди повинні розглядатися при розробці нових нормативних документів, і регулятори повинні підтримувати міжнародну гармонізацію та конвергенцію. Національні вимоги, що виходять за межі міжнародних стандартів, мають бути добре обґрунтованими.
Регулювання медичних продуктів є складним і еволюційним процесом. Нові технології та практики будуть продовжувати ставити виклики перед регуляторними системами та переосмислювати межі того, що може і повинно бути регульовано. Перш ніж розробляти положення щодо нових технологій або певних практик, регулятори повинні мати необхідну регуляторну гнучкість для тлумачення належним чином існуючого законодавства та положень. Має бути можливість переглянути або скасувати положення чи інструкцію, якщо вони більше не потрібні.
8.7 Чіткість
Регуляторні вимоги мають бути доступними та зрозумілими для користувачів.
Ключові елементи:
- Регуляторні інструменти повинні бути описані мовою, зрозумілою для користувачів.
- Має бути визначена термінологія і, за можливості, вона має відповідати такій в міжнародних документах.
- У нових вимогах мають бути роз’яснені та передбачені консультації, освіта та навчання.
- Інструкції й належна роз’яснювальна практика є інструментами для правильної інтерпретації положень.
- Процес та підстава для ухвалення регуляторних рішень та примусових дій мають бути зрозумілими.
Відповідність та цілісне застосування регуляторних вимог і процесів потребує чіткого розуміння того, що очікується. Як регулятор, так і суб’єкт регулювання мають розуміти очікуваний порядок взаємодії і наслідки недотримання вимог.
Запропоновані регуляторні інструменти повинні бути описані мовою, зрозумілою для відповідних користувачів. Це потребуватиме співробітництва з юридичним персоналом при розгляді цілей юридичних інструментів, цільової аудиторії, інших зацікавлених сторін, які можуть бути задіяні, та отримання відгуків від внутрішніх і зовнішніх консультантів, зокрема фахівців у відповідній сфері. Опис інструментів чіткою, однозначною, точною мовою, у формі, яка відповідає іншим законам та положенням, зменшує можливі суперечності чи неправильне тлумачення та сприяє дотриманню правил. Зустрічі між НРО та суб’єктами регулювання можуть бути корисними для уточнення застосування рекомендацій та розгляду ситуацій, для яких немає рекомендацій.
На початковому етапі НРО, який розробляє положення для медичних продуктів, має бути проведено огляд для ідентифікації невизначених питань і усунення будь-яких невідповідностей в самому положенні або з іншими положеннями. Цей етап також надає можливість перегляду «нормативного запасу» — накопиченого набору нормативних актів (див. 4. Глосарій), — для визначення необхідності оновлення та кращої інтеграції регуляторних вимог для усунення суперечностей, зайвої інформації, надмірної складності або для адаптації до нових вимог.
Зацікавлені сторони, зокрема громадськість, повинні бути поінформовані та брати участь у розробці регуляторних актів та у аналізі регуляторного впливу (див. 4. Глосарій), щоб підвищити якість та мову регуляторного інструменту, забезпечити чітке розуміння задуманого та підвищити ймовірність підтримки та майбутнього дотримання правил. Способи, за допомогою яких зацікавлені сторони можуть зробити свій внесок, повинні бути чітко визначені.
Аналіз регуляторного впливу є цінним для систематичного оцінювання очікуваних ефектів регуляторних пропозицій. Зазвичай його виконують аналітики в регуляторних департаментах, агентствах чи міністерствах, які є ініціаторами проєктів, переважно для допомоги тим, хто ухвалює рішення про затвердження нормативних документів. Результатом аналізу регуляторного впливу є документ, який узагальнює регуляторну пропозицію, можливі альтернативи, аспекти та вплив впровадження такої пропозиції.
У нормативних документах мають бути визначені терміни, щоб уникнути неоднозначності або неправильного тлумачення. Коли це можливо, вони повинні бути узгоджені із ухваленими міжнародними нормами, стандартами та гармонізованими інструкціями. Як вже зазначалося раніше, міжнародні стандарти та рекомендації (див. 4. Глосарій) є особливо важливими засобами для просування загальної регуляторної мови, конвергенції та міжнародного співробітництва.
Принцип чіткості також застосовується до регуляторних та адміністративних рекомендацій, які є інструментами для тлумачення та забезпечення операційної чіткості положень. Інструкції повинні бути розроблені згідно з належною практикою керування, щоб забезпечити їх чіткість і лаконічність, а також відповідність іншим інструкціям та основним положенням. Слід використовувати стандартні шаблони та формати, стилі, а також звертатися до редакторів, експертів з нормативної бази та збирати відгуки користувачів за допомогою встановлених інструментів (наприклад форм, вебінарів, опитувань).
Проєкти інструкцій, так само як і положень, слід подавати на внутрішні та зовнішні обговорення для підтвердження того, що їх мова є зрозумілою, чи потрібний їх перегляд для поліпшення сприйняття. Слід використовувати просту мову та просту структуру речень, за можливості з наданням ілюстративних прикладів. Для забезпечення чіткості та відповідності при введенні чи внесенні змін до положень та інструкцій, особливо якщо вони є складними, слід розглянути використання освітніх заходів, інформаційних сесій та навчання, із чіткими часовими рамками ухвалення нових положень та інструкцій.
Положення та супровідні інструкції повинні періодично переглядатися, щоб бути впевненими, що вони відображають поточні практики регуляторних органів та їх очікування, адаптовані до наукових та технологічних досягнень і, якщо прийнятно, відповідають поточним міжнародним стандартам і рекомендаціям. Огляд і перегляд інструкції повинні включати розгляд взаємопов’язаних змін в інших інструкціях, які мають бути переглянуті одночасно.
Процес та основа ухвалення регуляторних рішень і їх виконання повинні бути зрозумілими і доступними для тих, хто безпосередньо на них впливає або стає об’єктом впливу (див. розділ 8.9 Прозорість).
Таким чином, чіткість є важливою у всіх аспектах регуляторного нагляду (вимоги, процедури, рішення та комунікації), якщо регуляторні програми прагнуть досягти бажаного результату.
8.8 Ефективність
Регуляторні системи повинні досягати своїх цілей протягом зумовленого часу, з раціональними витратами зусиль та коштів.
Ключові елементи:
- Ефективні регуляторні системи досягають запланованих цілей громадського здоров’я.
- Надійна нормативна база, кваліфікований персонал і ефективне використання ресурсів та інформації від інших органів є ключовими елементами ефективної регуляторної системи.
- Політики повинні шукати найбільш ефективні, найменш обтяжливі засоби досягнення своїх регуляторних цілей і підтвердити їх ефективність після впровадження.
- Необхідно провести оцінку загального навантаження та ресурсів, необхідних для загального регулювання.
- Регуляторні органи повинні постійно досліджувати можливості підвищення ефективності при виконанні своїх повноважень.
- Узгодження регуляторних вимог з вимогами інших країн та міжнародна співпраця сприяють ефективності.
- Регульовані суб’єкти роблять критичний внесок в ефективність регуляторних систем.
- Ефективність регуляторних інструментів та операцій повинна бути оцінена за допомогою індикаторів вимірювання ефективності.
Ефективна регуляторна система повинна базуватися на науці та доказах, принципах оцінки та управління ризиками і включати стратегію міжнародного регуляторного співробітництва в щоденну діяльність. Регуляторна система, в якій обґрунтовані рішення не можуть бути ухвалені вчасно та системно, не є ефективною. Її ефективність залежить не лише від достатніх ресурсів, але й від типу ресурсів та їх ефективного використання, незалежно від їх кількості. У цьому контексті відсутність цілісності в загальній регуляторній системі є бар’єром для регуляторної ефективності.
Регуляторні системи з меншими ресурсами можуть бути так само ефективними, як і ті, що мають більше ресурсів, якщо вони використовують ризикорієнтований підхід, користуються напрацюваннями та рішеннями інших регуляторних органів та спрямовують свої ресурси на важливу і корисну діяльність, яку може забезпечити лише регуляторний орган [26].
Регуляторний нагляд не може вважатися ефективним, якщо він створює необґрунтовані бар’єри для доступу до медичних продуктів, торгівлі чи міжнародного регуляторного співробітництва. Успішне впровадження ефективного регуляторного контролю за медичними продуктами залежить, як було описано вище, від кількох факторів, зокрема від:
- аналізу варіантів, зокрема результатів консультацій із зацікавленими сторонами, оскільки положення, ймовірно, будуть ефективними, якщо ті, на кого вони впливають, надали свої пропозиції;
- регуляції, які пропорційні передбаченому ризику, сприяють інноваціям та не створюють непотрібних бар’єрів для торгівлі (наприклад випробування зразків продуктів при імпорті);
- раннього планування для впровадження та практичності майбутньої реалізації заходів. При впровадженні та виконанні не має бути вагань.
При розробці нових регуляторних інструментів та аналізі їх впливу, регуляторний орган повинен розробити «стратегії для навчання, допомоги, переконання, просування, економічних стимулів, моніторингу, виконання та санкцій» [34]. Орган має визначити, які стратегії використовувати для забезпечення виконання та чи можна розумно використовувати свідомість споживачів та ринкові сили, додатково до загрози штрафів. Також слід розглядати роль громадянського суспільства у здійсненні контролю за дотриманням регуляторних вимог. У певних обставинах може розглядатися співрегулювання (див. 4. Глосарій). У таких ситуаціях уряд видає положення та укладає нормативно-правову угоду з організацією (наприклад з промисловим чи професійним об’єднанням у сфері охорони здоров’я), щоб розробити та впровадити програму дотримання регуляторних вимог. Коли уряд працює через такий орган у регулюванні діяльності, він не делегує своє наглядове право за цією діяльністю.
Регуляторні органи також можуть розглядати можливість залучення сторонніх установ для здійснення своєї діяльності. Ця модель є поширеною в регулюванні медичних виробів, наприклад, залучення визнаних організацій для аудиту систем управління якістю виробників, щоб забезпечити їх відповідність міжнародному стандарту та вимогам законодавства. Регуляторні ресурси використовуються для створення та забезпечення нагляду за аудиторськими організаціями, що призводить до більш ефективного використання обмежених ресурсів [35].
Уряди витрачають кошти, впроваджуючи та підтримуючи регуляторні системи. Промисловість та інші регульовані сторони витрачають кошти для відповідності регуляторним вимогам, зокрема на проведення досліджень, підготовку реєстраційних досьє, ведення записів та сплату внесків — це вартість ведення бізнесу. Додаткові витрати виникають в неефективних регуляторних системах. Якщо вартість виконання регуляторних вимог надто висока, компанії можуть вирішити не розробляти продукт та/або не виводити його на ринок певної країни. Наприклад, обов’язкова вимога проведення локальних клінічних випробувань як умова для реєстрації може стати перешкодою для входження на цей ринок, особливо якщо випробування, вже проведені в інших місцях, відображають характеристики пацієнтів цього ринку і підтверджують безпеку та ефективність продукту. Подібним чином тривалі та/або непередбачувані терміни експертизи та реєстрації продукту призводять до втрати прибутку та необов’язкових затримок у наданні продуктів пацієнтам, що може мати потенційно суттєві негативні наслідки для захворюваності, смертності, витрат на охорону здоров’я та економіку. Здорові економіки потребують здорових людей.
Неефективність також призводить до негативного впливу на ресурси, репутацію та задоволення від роботи регуляторного органу та збільшує витрати часу на розгляд скарг щодо його ефективності. Нормативна база, що відображає принципи пропорційності, гнучкості та цілісності, ймовірніше, буде більш ефективною, оскільки вона дозволяє спрямовувати ресурси на регуляторні заходи, які найбільше їх потребують.
Регуляторні органи повинні постійно досліджувати способи підвищення своєї ефективності, підтримуючи при цьому стандарти для оцінки якості, безпеки та ефективності або дієвості медичних продуктів. Це може включати введення або уточнення належних практик реєстрації [28] та системи управління якістю [28]; ширше та більш ефективне використання інформаційних технологій; консультації з промисловістю, медичними працівниками та пацієнтами з питань недоліків та оптимальних методів їх вирішення; критерії, що базуються на ризиках, для планування та проведення інспекцій; усунення прогалин в інструкціях; вимірювання ефективності та — як вказано вище — регуляторну співпрацю і довіру [26].
Промисловість також робить критичний внесок в ефективність регуляторних систем. Наприклад, якісно підготовлені досьє на реєстрацію скорочують загальний час розгляду за рахунок зменшення кількості циклів їх розгляду. Так само виробник з хорошою історією перевірок не повинен потребувати такої самої частоти або глибини інспектування, що й виробник зі слабкою ефективністю. Консультації та навчання можуть ефективно доповнювати примусові заходи для досягнення бажаного рівня відповідності.
В аналізі регуляторного впливу політики повинні шукати найбільш ефективні, найменш обтяжливі методи досягнення своїх регуляторних цілей. Регуляторний підхід має включати розгляд загального навантаження та ресурсів, необхідних для загального регулювання.
Повинні проводитися періодичні оцінки ефективності для визначення реальної ефективності регуляторних інструментів, щоб забезпечити реалізацію передбачених переваг, а також контролювати прямі та непрямі витрати.
8.9 Прозорість
Прозорість є ознакою добре функціонуючої системи регулювання, необхідної для зміцнення громадської довіри та сприяння міжнародній співпраці.
Ключові елементи:
- Прозорість потребує інвестицій та культури відкритості, що підтримується політикою уряду, його зобов’язаннями та діями.
- При розробці нових або зміні попередніх регуляторних інструментів слід проводити консультації із зацікавленими сторонами.
- Регуляторні вимоги, процеси, збори, оцінки, рішення та дії мають бути максимально доступними.
- Політика регуляторного органу щодо розкриття інформації має відповідати національному законодавству щодо доступу до інформації.
У Статуті ВООЗ вказано: «Інформована думка та активна співпраця громадськості мають велике значення для поліпшення здоров’я людей». Прозорість є важливою для інтересів пацієнтів, споживачів, урядів, працівників сфери охорони здоров’я та виробників, оскільки вона підвищує довіру громадськості та впевненість в регулюванні медичних продуктів. Прозорість регуляторних вимог і дій призводить до кращих обґрунтованих рішень щодо інвестицій як у сфері публічного, так і приватного сектору, та перешкоджає практикам дискримінації, корупції або зловживання.
За відповідної прозорості всі сторони, які є зацікавленими або можуть бути зацікавленими, — внутрішні, зарубіжні, громадські та приватні — мають суттєву можливість бути поінформованими про нові чи відредаговані регуляторні акти або інструкції та висловлювати свою думку, перш ніж вони будуть ухвалені. Коли регуляторні акти та інструкції щодо медичних продуктів ухвалено, вони є легкодоступними зацікавленим сторонам та громадськості. Відповідні закони, положення та інструкції із вказівками повинні бути розміщені на вебсайті відповідного органу. Крім того, національні галузеві та професійні асоціації часто співпрацюють з регуляторними органами для поширення нових регуляторних документів та створення можливостей для обміну відповідною інформацією.
Оцінки (позитивні та, за можливості, негативні), рішення та дії регуляторного органу мають бути задокументовані та публічно доступні, з обґрунтуванням рішень, в ідеалі — шляхом оприлюднення звіту про оцінку. Ця інформація важлива для різних зацікавлених сторін, включаючи промисловість, дослідників, медичних працівників, пацієнтів та споживачів, які використовують цю інформацію для різних цілей. Вона також є важливою для побудови довіри і впевненості в регуляторній системі.
Сторони, які підлягають регулюванню, повинні мати доступ до повних звітів про оцінку продукту чи інспекцію об’єкта, які їх стосуються. Це не лише забезпечує відомості щодо підстав для коментарів та рішень, але також важливо і в навчальних цілях, що сприяє покращенню відповідності регуляторним вимогам та якості майбутніх заявок. Ця практика також може бути корисною для регуляторного органу, сприяючи культурі прозорості та відповідальності на операційному та управлінському рівнях. Крім того, це може зумовити створення звітів вищої якості, забезпечуючи чітке пояснення того, як такі оцінки призвели до ухвалених рішень. Виробникам повинна бути надана можливість виключити будь-яку комерційну таємницю або конфіденційну, особисту чи комерційну інформацію перед оприлюдненням.
Прозорість потребує інвестицій та культури відкритості, яку, своєю чергою, слід підтримувати політикою, зобов’язанням та діями уряду. Хоча не всі регуляторні органи можуть впроваджувати повний спектр заходів для оптимально прозорої регулятивної системи, може бути вжитий поетапний підхід. З огляду на поширеність смарт-пристроїв та інтернету, можна було б створити та підтримувати сучасний, доступний для пошуку вебсайт, який містить основну інформацію, таку як:
- ролі, обов’язки, структура та контактна інформація регуляторного органу;
- доступ до законів, положень, інструкцій та процедур, необхідних для виконання регуляторних вимог та підвищення ефективності, безпеки та якості медичних продуктів;
- зручний для пошуку реєстр затверджених, призупинених та вилучених продуктів;
- інформація про продукти для медичних працівників та пацієнтів;
- статус ліцензування місць виробництва;
- медичні консультації, інформація про безпеку, попередження щодо якості або про субстандартні або фальсифіковані медичні продукти, оголошення про виведені з обігу продукти та іншу інформацію, що є важливою з точки зору громадського здоров’я;
- цілі та результати їх виконання, щорічні звіти;
- запропоновані нові регуляторні інструменти, включаючи терміни для коментарів і порядок надання відгуків;
- звіти про громадське оцінювання та звіти про перевірки чи інспекції закладів.
Результати всіх аудитів чи переглядів роботи та діяльності регуляторного органу повинні стати публічно доступними. Такі огляди є важливими елементами звітності перед громадськістю, так само як і звіти про досягнення цілей та щорічні звіти.
Виконуючи свої обов’язки, регуляторні органи створюють або отримують доступ до службової або конфіденційної інформації. Приклади такої інформації включають ідентифіковану особисту інформацію з клінічних випробувань або звітів про побічні дії, торгові секрети або конфіденційну комерційну інформацію, таку як специфікації компонентів, матеріалів медичних продуктів чи виробничі процеси. Повинні бути вжиті заходи для запобігання розголошенню такої інформації з механізмом вирішення суперечок щодо права власності або конфіденційності інформації.
Загалом національні закони та положення мають сприяти прозорості та доступу громадськості як до процесу, так і до критеріїв ухвалення регуляторних рішень. Політика розкриття інформації регуляторного органу має бути узгоджена з національними законами щодо публічного доступу до урядової інформації або «свободи інформації». Процедури та контактні точки для отримання інформації, якою володіє регуляторний орган, мають бути доступними і зрозумілими.
Прозорість дозволяє впроваджувати нові, більш ефективні способи проведення регуляторних операцій.
На регуляторів покладається обов’язок практикувати прозорість в регуляторних операціях та рішеннях не лише для дотримання правил державної регуляторної політики, але й для забезпечення довіри та максимізації можливостей для співпраці як частини загальної відповідальності регуляторної спільноти. Регулятори зобов’язані дотримуватися прозорості в регуляторних операціях і рішеннях не тільки як фундаментальних принципів НРП, а й для зміцнення довіри та максимізації можливостей для співпраці та надійності як частини спільної відповідальності регуляторної спільноти.
9. Рушійні сили Належної регуляторної практики
Створення сприятливого середовища зумовлює успішну реалізацію НРП. Деякі елементи описано нижче.
9.1 Політична підтримка та всебічна підтримка з боку уряду
Постійна підтримка на найвищому політичному та урядовому рівнях є ключовою для належної реалізації концепції та принципів НРП. НРП повинна становити невід’ємну частину всіх урядових політик у сфері регулювання.
9.2 Ефективна організація та належне управління, підтримане лідерством
Структура та лінія влади зовні і всередині всіх установ системи регулювання повинні бути чітко визначені. Цілісність загальної системи регулювання є критичною для ефективної роботи кожної з її установ. Якщо в системі регулювання взаємодіють більше однієї установи, законодавство чи інституційне регулювання повинно передбачати чітку координацію та відсутність перекриття регуляторної діяльності. Лідерство має важливе значення для встановлення та реалізації організаційної візії, місії, політик та стратегій, що, своєю чергою, значно сприяє ефективності організації.
9.3 Міжорганізаційна та внутрішньоорганізаційна комунікація, співпраця та координація
Достатня та ефективна комунікація відіграє фундаментальну роль у взаємодії інформації як всередині, так і поза установами, що формують систему регулювання. Коли регуляторні органи регулярно взаємодіють як всередині, так і зовні, вони залишаються більш прозорими та відповідальними. Комунікація правильної інформації запобігає можливим непорозумінням та поширенню відомостей, що можуть вводити в оману пацієнтів та громадськість. Комунікація є потужним інструментом для співпраці та координації з відповідними національними та міжнародними зацікавленими сторонами, що, своєю чергою, зумовлює ефективне використання ресурсів та покращення результатів регулювання.
З огляду на свої обов’язки, регуляторні органи повинні мати персонал, інфраструктуру та технічні засоби, що відповідають виконанню їхніх завдань. Координацію можна полегшити за допомогою технологій комунікацій та ефективного швидкого обміну інформацією, що призведе до меншої кількості прогалин та дублювання зусиль.
9.4 Надійна та ефективна система управління якістю
Система управління якістю [28], яка включає застосування принципів управління ризиками, робить рішення регуляторних органів більш авторитетними, а їх діяльність стабільнішою та послідовною. Система управління якістю сприяє системному плануванню, контролю та підвищенню якості в усіх процесах регуляторних функцій, гарантує комплексний підхід.
9.5 Достатні та стабільні фінансові ресурси
Інвестиції в регуляторну систему є ключовим елементом добре функціонуючої системи охорони здоров’я. Достатні фінансові ресурси для ефективного виконання своєї функції та постійного покращення результативності регуляторної діяльності є необхідними для незалежності, послідовності та ефективності регуляторної системи. Фінансові ресурси всіх інститутів системи регулювання повинні бути сталими, окрім благодійних внесків від донорів чи філантропічних організацій.
9.6 Компетентні людські ресурси
Різноманітні технічні та наукові знання та навички персоналу регуляторних органів сприяють розробці, впровадженню та підтримці ефективної регуляторної системи для медичних продуктів. Політика та заходи щодо особистісного та кар’єрного розвитку (наприклад програми навчання, конкурентоспроможні системи оплати праці) є критичними для того, щоб регуляторні органи могли залучати компетентний персонал та утримувати його.
9.7 Організаційна етика та цінності
Персонал регуляторного органу повинен дотримуватися етичних принципів та цінностей організації та виявляти професіоналізм. Усі співробітники регуляторної системи мають бути обізнані та проходити навчання з етичних принципів та цінностей регуляторного органу (наприклад кодекс поведінки). Має бути встановлена система в межах або поза системою регулювання для управління відхиленнями від етики та цінностей організації.
9.8 Науково-інформаційний підхід до ухвалення рішень
Регуляторні рішення та процес ухвалення рішень повинні ґрунтуватися на наукових основах та точних даних, а не на інтуїції чи випадковості. Науково обґрунтовані рішення забезпечують стабільні та передбачувані результати регулювання. Дотримання міжнародних стандартів та рекомендацій є ключовим фактором для науково обґрунтованого процесу ухвалення регуляторних рішень. Зазначені вище фактори неефективні, коли вони наявні окремо. Навпаки, вони працюють узгоджено у застосуванні та впровадженні НРП. Наприклад, достатні та сталі фінансові ресурси сприяють набору, розвитку та утриманню компетентних людських ресурсів. Так само управління фінансовими ресурсами має здійснюватися відповідно до практики належного управління.
10. Впровадження належних регуляторних практик
Країни — члени ВООЗ залучаються до впровадження НРП у свої регуляторні системи з урахуванням реалій їх правових та регуляторних систем. Для забезпечення високоякісного регуляторного нагляду, який досягає поставлених цілей з мінімізацією негативних впливів та витрат, слід використовувати прозорі та передбачувані процеси. Водночас регуляторні системи мають бути достатньо гнучкими для застосування процесів пропорційно до обсягу, масштабу та складності проблеми. Необхідна постійна підтримка на найвищому рівні разом із належними ресурсами.
Також буде надано додаткові рекомендації для допомоги країнам-членам як для створення нових регуляторних систем для медичних продуктів, так і для удосконалення існуючих.
Список використаної літератури
1. WHO definitions: emergencies. Geneva: World Health Organization; 2020 (http://www.who.int/hac/about/definitions/en/, accessed 29 January 2021).
2. Regulatory harmonization. Geneva: World Health Organization; 2014. WHO Drug Inf. 2014;28(1):3–10 (http://www.who.int/medicines/publications/druginformation/issues/Drug Information2014_Vol28-1/en/, accessed 29 January 2021).
3. International regulatory co-operation: addressing global challenges. Paris: Organisation for Economic Co-operation and Development; 2013 (dx.doi.org/10.1787/9789264200463-en, accessed 29 January 2021).
4. Guidelines on international regulatory obligations and cooperation. Ottawa: Treasury Board of Canada Secretariat; 2007 (http://www.tbs-sct.gc.ca/hgw-cgf/priorities-priorites/rtrap-parfa/guides/iroc-cori/iroc-cori-eng.pdf, accessed 29 January 2021).
5. International regulatory cooperation — better rules for globalization. Paris: Organisation for Economic Co-operation and Development; 2013 (http://www.oecd.org/gov/regulatory-policy/irc.htm, accessed 29 January 2021).
6. Recommendation of the Council on Regulatory Policy and Governance. Paris: Organisation for Economic Co-operation and Development; 2012 (http://www.oecd.org/gov/regulatorypolicy/2012-recommendation.htm, accessed 29 January 2021).
7. Regulatory harmonization and convergence. Silver Spring (MD): US Food and Drug Administration; 2015 (http://www.fda.gov/BiologicsBloodVaccines/InternationalActivities/ucm271079.htm, accessed 29 January 2021).
8. Best practice regulation handbook. Canberra: Australian Government; 2007 (regulationbodyofknowledge.org/wpcontent/uploads/2013/03/AustralianGovernment_Best_Practice_Regulation.pdf, accessed 29 January 2021).
9. Evaluating the effectiveness of infrastructure regulatory systems. Washington DC: The World Bank; 2006:17 (ppp.worldbank.org/public-private-partnership/sites/ppp.worldbank.org/files/documents/world_bank-_ppiaf_handbook_for_evaluating_infrastructure_regulatory_systems_2006_english.pdf, accessed 29 January 2021).
10. APEC–OECD Co-operative Initiative on Regulatory Reform. APEC–OECD integrated checklist on regulatory reform. Paris: Organisation for Economic Co-operation and Development; 2005 (http://www.oecd.org/regreform/34989455.pdf, accessed 29 January 2021).
11. The OECD report on regulatory reform. Paris: Organisation for Economic Co-operation and Development; 1997 (http://www.oecd.org/gov/regulatory-policy/2391768.pdf, accessed 29 January 2021).
12. OECD guiding principles for regulatory quality and performance. Paris: Organisation for Economic Co-operation and Development; 2005 (http://www.oecd.org/fr/reformereg/34976533.pdf, accessed 29 January 2021).
13. Better regulation for growth. Governance frameworks and tools for effective regulatory reform. Washington DC: The World Bank; 2007 (documents1.worldbank.org/curated/en/955811468330978599/pdf/556350WP0Box0310Governance01PUBLIC1.pdf, accessed 29 January 2021).
14. ASEAN good regulatory practice (GRP) guide. Bangkok: Association of Southeast Asian Nations; 2009 (regulatoryreform.com/wp-content/uploads/2015/08/ASEAN-Good-Regulatory-Practice-GRP-Guide-2009.pdf, accessed 29 January 2021).
15. The «blue book». Marketing authorization of pharmaceutical products with special reference to multisource (generic) products, a manual for national medicines regulatory authorities (NMRAs). Second edition. Geneva: World Health Organization; 2011 (apps.who.int/iris/bitstream/handle/10665/44576/9789241501453_eng.pdf;jsessionid=52D37F5BD27B9BB5055CF9DA79453B5B?sequence=1, accessed 29 January 2021).
16. National drug regulatory legislation: guiding principles for small drug regulatory authorities. In: WHO Expert Committee on Specifications for Pharmaceutical Preparations: thirty-fifth report (WHO Technical Report Series, No. 885). Geneva: World Health Organization; 1999: Annex 8 (http://www.who.int/medicines/technical_briefing/tbs/National_drug_regulatory_legislation_Annex8TRS885_en.pdf), accessed 29 January 2021).
17. Regulation of vaccines: building on existing drug regulatory authorities. Geneva: World Health Organization; 1999 (document WHO/V&B/99.10) (apps.who.int/iris/bitstream/10665/65968/1/WHO_V-B_99.10_eng.pdf, accessed 29 January 2021).
18. Effective drug regulation: a multi-country study. Geneva: World Health Organization; 2002 (apps.who.int/iris/bitstream/handle/10665/42470/9241562064.pdf?sequence=1&isAllowed=y, accessed 29 January 2021).
19. Medical device regulations: global overview and guiding principles. Geneva: World Health Organization; 2003 (http://www.who.int/medical_devices/publications/en/MD_Regulations.pdf, accessed 29 January 2021).
20. A model regulatory programme for medical devices: an international guide. Washington DC: Pan American Health Organization; 2001 (new.paho.org/hq/dmdocuments/2009/AmodelRegulatoryProgramforMedicalDevices_AnInternalGuide.pdf?ua=1, accessed 29 January 2021).
21. How to develop and implement a national drug policy, second edition. Geneva: World Health Organization; 2001 (http://www.who.int/medicines/areas/policy/emp_ndp2nd/en/, accessed 29 January 2021).
22. Global model regulatory framework for medical devices including IVDs. Geneva: World Health Organization; 2017 (apps.who.int/iris/bitstream/handle/10665/255177/9789241512350-eng.pdf?sequence=1, accessed 29 January 2021).
23. Resolution WHA67.20. Regulatory system strengthening for medical products. In: Sixty-seventh World Health Assembly, Geneva, 19–24 May 2014. Resolutions and decisions: resolutions. Geneva: World Health Organization; 2014 (apps.who.int/gb/ebwha/pdf_files/WHA67/A67_R20-en.pdf, accessed 29 January 2021).
24. Good Governance for Medicines: Model Framework, Geneva: World Health Organization; 2014 (http://www.who.int/medicines/areas/governance/ggm_modelframe_updated/en/, accessed 29 January 2021).
25. Good Reliance Practices: Good reliance practices in regulatory decision-making: 6 high-level principles and recommendations 8 Draft. Geneva: World Health Organization; 2020 (working document QAS/20.851 (http://www.who.int/medicines/areas/quality_safety/quality_assurance/QAS20_851_good_reliance_practices.pdf?ua=1, accessed 29 January 2021).
26. Good review practices: guidelines for national and regional regulatory authorities. In: WHO Expert Committee on Specifications for Pharmaceutical Preparations: forty-ninth report. Geneva: World Health Organization; 2015: Annex 9 (WHO Technical Report Series, No. 992; http://www.who.int/medicines/areas/quality_safety/quality_assurance/Annex9TRS992.pdf?ua=1 accessed 29 January 2021).
27. WHO guideline on the implementation of quality management systems for national regulatory authorities. In: WHO Expert Committee on Specifications for Pharmaceutical Preparations: fifty fourth report. Geneva: World Health Organization; 2020: Annex 13 (WHO Technical Report Series, No. 1025, http://www.who.int/publications/i/item/978-92-4-000182-4, accessed 29 January 2021).
28. Policy evaluating and publicly designating regulatory authorities as WHO-listed authorities. Draft. Geneva: World Health Organization; 2019 (working document QAS/19.828; http://www.who.int/medicines/areas/quality_safety/quality_assurance/QAS19_828_Policy_on_WHO_Listed_Authorities.pdf?ua=1, accessed 29 January 2021).
29. WHO Global Benchmarking Tool (GBT) for evaluation of national regulatory systems (http://www.who.int/medicines/regulation/benchmarking_tool/en/, accessed 29 January 2021).
30. APEC Sub-committee on Standards and Conformance. Information notes on good practice for technical regulation. Singapore: Asia-Pacific Economic Cooperation; 2000 (http://www.inmetro. gov.br/qualidade/comites/pdf/docAPEC.pdf, accessed 29 January 2021).
31. Improving regulation and regulatory review. Executive Order 13563. Executive Office of the President. Federal Register: the Daily Journal of the United States Government, 21 January 2011 (federalregister.gov/a/2011-1385, accessed 29 January 2021).
32. The governance of regulators. Creating a culture of independence. Practical guidance against undue influence. Paris: Organisation for Economic Co-operation and Development; 2017 (http://www.oecd.org/gov/creating-a-culture-of-independence-9789264274198-en.htm, accessed 29 January 2021).
33. Recommendation of the Council of the OECD on improving the quality of government regulation, including the OECD reference checklist for regulatory decision-making and background note. Paris: Organisation for Economic Co-operation and Development; 1995 (legalinstruments.oecd.org/public/doc/128/128.en.pdf, accessed 29 January 2021).
34. Medical device single audit program (MDSAP). Silver Spring (MD): Food and Drug Administration; 2020 (http://www.fda.gov/medical-devices/cdrh-international-programs/medical-device-singleaudit-program-mdsap, accessed 29 January 2021).

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим