ПОЯСНЮВАЛЬНА ЗАПИСКА
1. Обґрунтування необхідності прийняття акта
Проект постанови Кабінету Міністрів України «Про заходи щодо вдосконалення державного регулювання ціноутворення на лікарські засоби і вироби медичного призначення» розроблено на виконання п. 5 постанови Кабінету Міністрів України від 17.10.2008 р. № 955 зі змінами, внесеними постановою Кабінету Міністрів України від 25.03.2009 р. № 333.
Ситуація, яка склалася впродовж останніх дев’яти місяців у сфері ціноутворення на лікарські засоби, вимагає невідкладного втручання держави, оскільки призводить до негативних соціально-економічних наслідків, що становлять загрозу національній безпеці держави, а також унеможливлює повноцінне забезпечення конституційних прав громадян на медичну та фармацевтичну допомогу.
Створення ефективної системи ціноутворення на лікарські засоби на макро- та мікроекономічному рівні, і перш за все, впровадження дієвих методів державного регулювання цін на лікарські засоби та медичну продукцію на всіх етапах їх формування, є визначальним у вирішенні питань доступності фармацевтичної допомоги населенню, раціонального використання бюджетних коштів та підвищення ефективності діяльності суб’єктів фармацевтичного ринку.
Впровадження державної реєстрації граничних оптово-відпускних цін (митної вартості) виробників та імпортерів, роздрібних цін є актуальним завданням, вирішення якого поновить баланс соціально-економічних інтересів держави, суспільства та суб’єктів господарювання.
2. Мета та шляхи її досягнення
Даний проект постанови Кабінету Міністрів України передбачає запровадження державної реєстрації граничних оптово-відпускних цін на лікарські засоби і вироби медичного призначення, як один із інструментів державного регулювання ціноутворення, що застосовується для стабілізації та недопущення стрімкого зростання цін. Враховуючи, що саме ціни виробників та митна вартість є базою визначення торгівельних надбавок та роздрібних цін, державна реєстрація граничних оптово-відпускних цін виробника (митної вартості) забезпечить прозорість та публічність усієї системи цін на лікарські засоби і вироби медичного призначення.
Державна реєстрація граничних оптово-відпускних та роздрібних цін запроваджується також і для підготовки подальшого введення системи відшкодування вартості лікарських засобів і виробів медичного призначення та/або системи обов’язкового медичного страхування в Україні.
Крім того, проект акта спрямований на забезпечення єдиної цінової політики при закупівлі лікарських засобів і виробів медичного призначення за бюджетні кошти, внаслідок чого відбуватиметься їх значна економія.
Цим проектом визначається порядок проведення моніторингу цін на лікарські засоби і вироби медичного призначення, на здійснення якого уповноважена Держлікінспекція.
Моніторинг цін є важливим та необхідним інструментом державного регулювання фармацевтичного ринку.
Проведення моніторингу дасть можливість державним органам контролювати динаміку та варіацію цін на лікарські засоби і вироби медичного призначення, визначати їх доступність для населення; операторам ринку отримувати об’єктивну інформацію про тенденції ціноутворення, які складаються на фармацевтичному ринку, а споживачам — повну та достовірну інформацію про ціни виробників, наявність аналогів лікарських засобів, завдяки чому споживачі зможуть вирішувати, які ліки їм купувати — чи дорогий імпортний препарат, чи аналогічний дешевший препарат вітчизняного виробництва.
Поставлена мета досягається шляхом затвердження Порядку державної реєстрації граничних оптово-відпускних цін на лікарські засоби і вироби медичного призначення, Положення про Державний реєстр цін на лікарські засоби і вироби медичного призначення, Порядку проведення моніторингу цін на лікарські засоби і вироби медичного призначення та внесення необхідних змін до інших постанов Кабінету Міністрів України.
3. Правові аспекти
Нормативно-правові акти, що діють у відповідній сфері суспільних відносин:
- Закон України «Про лікарські засоби»;
- Закон України «Про ціни і ціноутворення»;
- постанова Кабінету Міністрів України від 17 жовтня 2008 р. № 955 «Про заходи щодо стабілізації цін на лікарські засоби і вироби медичного призначення»;
- постанова Кабінету Міністрів України від 25 березня 2009 р. № 333 «Деякі питання державного регулювання цін на лікарські засоби і вироби медичного призначення».
4. Фінансово-економічне обґрунтування
Реалізація акта не потребує додаткових витрат із державного бюджету України.
5. Позиція заінтересованих органів
Проект акта потребує погодження з Мінекономіки, МОЗ, Мінфін, Мін’юст, Держкомпідприємництва.
6. Регіональний аспект
Проект розпорядження не стосується питання розвитку адміністративно-територіальних одиниць.
7. Громадське обговорення
Проект акта потребує обговорення з громадськістю.
8. Прогноз результатів
Прийняття запропонованого проекту акта забезпечить:
- стабілізацію та зниження цін на лікарські засоби;
- економію бюджетних коштів (реєстрація ціни унеможливить штучне завищення ціни при проведенні закупівель лікарських засобів і виробів медичного призначення за бюджетні кошти);
- створення об’єктивної базової ціни виробника на лікарські засоби;
- належне застосування граничних постачальницько-збутових та торгівельних
- підґрунтя для впровадження системи медичного страхування та/або відшкодування вартості лікарських засобів і виробів медичного призначення за рахунок державного бюджету та інших залучених коштів.
ПОРІВНЯЛЬНА ТАБЛИЦЯ
| Чинна редакція | Редакція з урахуванням змін |
| 1. Правила торгівлі лікарськими засобами в аптечних закладах, затверджені постановою Кабінету Міністрів України від 17 листопада 2004 р. № 1570 | |
|
5. Торгівля може здійснюватися лише зареєстрованими в Україні в установленому порядку лікарськими засобами за наявності сертифіката якості виробника, крім випадків, передбачених законодавством України. Продаж незареєстрованих лікарських засобів, лікарських засобів, строк придатності яких минув, а також без копії сертифіката якості виробника є підставою для анулювання ліцензії. Забороняється торгівля неякісними та фальсифікованими лікарськими засобами. |
5. Торгівля може здійснюватися лише зареєстрованими в Україні в установленому порядку лікарськими засобами за наявності сертифіката якості виробника, крім випадків, передбачених законодавством України. Продаж незареєстрованих лікарських засобів, лікарських засобів, строк придатності яких минув, а також без копії сертифіката якості виробника є підставою для анулювання ліцензії. «Забороняється торгівля неякісними та фальсифікованими лікарськими засобами, а також лікарськими засобами і виробами медичного призначення, ціни на які підлягають державній реєстрації, та не зареєстровані у встановленому порядку.». |
|
11. Мати паспорт аптечного складу (бази) згідно з додатком. |
11. мати паспорт аптечного складу (бази) згідно з додатком. «надавати Держлікінспекції інформацію про оптово-відпускні та закупівельні ціни на лікарські засоби і вироби медичного призначення, що включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480);». |
|
23. Зберігати протягом не менше трьох років документи, що засвідчують факт купівлі із зазначенням назви, дати, кількості та серії одержаного лікарського засобу, інформації про постачальника та реквізитів його ліцензії; |
23. зберігати протягом не менше трьох років документи, що засвідчують факт купівлі із зазначенням назви, дати, кількості та серії одержаного лікарського засобу, інформації про постачальника та реквізитів його ліцензії; «надавати Держлікінспекції інформацію про закупівельні та роздрібні ціни на лікарські засоби і вироби медичного призначення, що включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480);». |
| 2. Порядок здійснення державного контролю за якістю лікарських засобів, що ввозяться в Україну, затверджений постановою Кабінету Міністрів України від 14 вересня 2005 р. № 902 | |
|
4. Державний контроль здійснюють Державна інспекція з контролю якості лікарських засобів з безпосередньо підпорядкованими їй державними інспекціями з контролю якості лікарських засобів в Автономній Республіці Крим, областях, м. Києві та Севастополі (далі — органи державного контролю) разом з митними органами. |
4. Державний контроль здійснюють Державна інспекція з контролю якості лікарських засобів з безпосередньо підпорядкованими їй державними інспекціями з контролю якості лікарських засобів в Автономній Республіці Крим, областях, мм. Києві та Севастополі (далі — органи державного контролю) разом з митними органами. 4-1. «Суб’єкт господарювання до початку митного оформлення вантажу подає заяву до органу державного контролю за місцем провадження господарської діяльності для отримання довідки щодо ввезення лікарських засобів на митну територію України та їх ціну (далі — довідка) в паперовому та електронному вигляді за формою, затвердженою Держлікінспекцією спільно з Держмитслужбою. Для отримання довідки суб‘єкт господарювання подає органові державного контролю заяву за формою, затвердженою Держлікінспекцією. Орган державного контролю протягом п‘яти робочих днів здійснює розгляд поданих документів, проведення моніторингу цін, підтвердження факту, що лікарські засоби не належать до таких, обіг яких було заборонено відповідними органами державного контролю, в тому числі за ознаками фальсифікації. За результатами розгляду, орган державного контролю видає суб‘єкту господарювання довідку та один екземпляр поданої копії рахунку-фактури (інвойсу) з відміткою про видачу довідки. Довідка щодо ввезення лікарських засобів на митну територію України та їх ціну дійсна протягом двох тижнів та подається суб‘єктом господарювання до відповідного митного органу»; |
| 3. Положення про Державну інспекцію з контролю якості лікарських засобів, затвердженого постановою Кабінету Міністрів України від 20 грудня 2008 р. № 1121 | |
|
25) Здійснює моніторинг цін на лікарські засоби і медичну продукцію та готує пропозиції щодо вдосконалення їх державного регулювання, організовує ведення відповідних державних реєстрів цін; |
«25) організовує і проводить державну реєстрацію граничних оптово-відпускних і граничних роздрібних цін на лікарські засоби і медичну продукцію, ведення Державного реєстру граничних оптово-відпускних і роздрібних цін, здійснює моніторинг цін на лікарські засоби і медичну продукцію;». |
| 4. Постанова Кабінету Міністрів України від 17 жовтня 2008 р. № 955 «Про заходи щодо стабілізації цін на лікарські засоби і вироби медичного призначення» | |
|
1. Лікарські засоби і вироби медичного призначення вітчизняного виробництва, оптово-відпускна ціна яких нижча ніж 12 гр. за одну упаковку, не підлягають державному регулюванню, крім тих, що придбаваються за бюджетні кошти. |
1. «На лікарські засоби і вироби медичного призначення вітчизняного виробництва, включені до Національного переліку основних лікарських засобів і виробів медичного призначення (крім наркотичних, психотропних лікарських засобів, прекурсорів та медичних газів) та оптово-відпускна ціна яких нижча ніж 12 гр. за одну упаковку, встановити граничні постачальницько-збутові надбавки не вище ніж 15 відсотків оптово-відпускної ціни та граничні торговельні (роздрібні) надбавки не вище ніж 35 відсотків закупівельної ціни.» |
| 5. Порядок формування цін на лікарські засоби і вироби медичного призначення, щодо яких запроваджено державне регулювання, затверджений постановою Кабінету Міністрів України від 25 березня 2009 р. № 333 | |
|
4. Оптово-відпускна ціна є ціною одиниці імпортованого товару або ціною одиниці товару, що встановлюється в договорі, укладеному між вітчизняним товаровиробником та суб’єктом господарювання, що здійснює оптову торгівлю товаром. |
«4. Оптово-відпускна ціна є ціною одиниці імпортованого товару або ціною одиниці товару, що встановлюється у договорі, укладеному між вітчизняним товаровиробником та суб’єктом господарювання, в межах зареєстрованої граничної оптово-відпускної ціни.». |
| Міністр охорони здоров’я України | В.М. Князевич |
Проект
КАБІНЕТ МІНІСТРІВ УКРАЇНИ
ПОСТАНОВА
від_______ №________
«ПРО ЗАХОДИ ЩОДО ВДОСКОНАЛЕННЯ ДЕРЖАВНОГО РЕГУЛЮВАННЯ ЦІНОУТВОРЕННЯ НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ»
Відповідно до Закону України «Про ціни і ціноутворення», з метою вдосконалення державного регулювання цін на лікарські засоби і вироби медичного призначення та ефективного використання бюджетних коштів, встановлення об’єктивної бази для подальшого впровадження системи обов’язкового медичного страхування та/або відшкодування вартості лікарських засобів і виробів медичного призначення за рахунок державного бюджету та інших залучених коштів
Кабінет Міністрів України постановляє:
1. Установити, що граничні оптово-відпускні та роздрібні ціни на лікарські засоби і вироби медичного призначення, що включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480), підлягають державній реєстрації.
2. Затвердити, що додаються:
- Порядок державної реєстрації граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення;
- Положення про Державний реєстр цін на лікарські засоби і вироби медичного призначення;
- Порядок проведення моніторингу цін на лікарські засоби і вироби медичного призначення.
3. Мінекономіки за даними моніторингу, що здійснюється Держлікінспекцією, затвердити граничні оптово-відпускні та граничні роздрібні ціни на лікарські засоби і вироби медичного призначення, включені до Національного переліку основних лікарських засобів і виробів медичного призначення, затвердженого постановою Кабінету Міністрів України від 25 березня 2009 р. № 333 («Офіційний вісник України», 2009, № 27, ст. 906).
Установити, що затверджені Мінекономіки граничні оптово-відпускні та граничні роздрібні ціни діють до прийняття рішення про державну реєстрацію граничних оптово-відпускних цін на лікарські засоби і вироби медичного призначення.
4. Установити, що не можуть придбаватися за бюджетні кошти лікарські засоби і вироби медичного призначення, включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480), граничні оптово-відпускні та роздрібні ціни на які не будуть зареєстровані до 1 грудня 2009 р.
5. Міністерству охорони здоров’я в термін до 1 грудня 2009 р. разом з Мінекономіки, Мінфіном, Держлікінспекцією надати пропозиції щодо переліку лікарських засобів, вартість яких може відшкодовуватись за рахунок державного бюджету та інших залучених коштів, обсяги такого відшкодування та порядку його запровадження.
6. Внести до постанов Кабінету Міністрів України зміни, що додаються.
7. Міністерствам та іншим органам виконавчої влади привести власні нормативно-правові акти у відповідність до цієї постанови.
8. Ця постанова набуває чинності через тиждень після її офіційного оприлюднення, крім підпункту 1 пункту 1 змін, що вносяться до постанов Кабінету Міністрів України, затверджених цією постановою, що набуває чинності з 1 грудня 2009 року.
| Прем’єр-міністр України | Ю. Тимошенко |
ЗАТВЕРДЖЕНО
постановою Кабінету Міністрів України
від ___ ___________ _____ р. № ______
ПОРЯДОК ДЕРЖАВНОЇ РЕЄСТРАЦІЇ ГРАНИЧНИХ ОПТОВО-ВІДПУСКНИХ ТА РОЗДРІБНИХ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
1. Цей Порядок визначає механізм державної реєстрації граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення (далі — ціни), внесення їх до Державного реєстру цін на лікарські засоби і вироби медичного призначення (далі — Державний реєстр).
Державній реєстрації підлягають граничні оптово-відпускні та роздрібні ціни на всі лікарські форми, дозування, первинну і споживчу упаковку лікарського засобу всіх виробників, усіх типів, видів, марок тощо для виробів медичного призначення.
Гранична роздрібна ціна на лікарські засоби і вироби медичного призначення, що включені до Національного переліку основних лікарських засобів і виробів медичного призначення (крім наркотичних, психотропних лікарських засобів, прекурсорів та медичних газів), формується з урахуванням граничних постачальницько-збутових і торговельних (роздрібних) надбавок встановлених постановою Кабінету Міністрів України від 17 жовтня 2008 р. № 955 «Про заходи щодо стабілізації цін на лікарські засоби і вироби медичного призначення» («Офіційний вісник України», 2008, № 84, ст. 2825).
Гранична роздрібна ціна на лікарські засоби і вироби медичного призначення (крім наркотичних, психотропних лікарських засобів, прекурсорів та медичних газів), що придбаваються повністю або частково за бюджетні кошти, формується з урахуванням граничних постачальницько-збутових і торговельних (роздрібних) надбавок встановлених постановою Кабінету Міністрів України від 17 жовтня 2008 р. № 955 «Про заходи щодо стабілізації цін на лікарські засоби і вироби медичного призначення» («Офіційний вісник України», 2008, № 84, ст. 2825).
Гранична оптово-відпускна ціна на лікарські засоби і вироби медичного призначення, крім лікарських засобів і виробів медичного призначення на які встановлено граничні постачальницько-збутові і торговельні (роздрібні) надбавки згідно постанови Кабінету Міністрів України від 17 жовтня 2008 р. № 955 «Про заходи щодо стабілізації цін на лікарські засоби і вироби медичного призначення» («Офіційний вісник України», 2008, № 84, ст. 2825), не може бути меншою ніж на 30% за граничну роздрібну ціну на той же лікарський засіб і виріб медичного призначення.
У цьому Порядку до лікарських засобів також поширюється медичні імунобіологічні препарати.
2. Для державної реєстрації цін Заявник надає до Держлікінспекції наступні документи:
а) заяву про реєстрацію ціни за встановленою формою (додатки 1, 2);
б) копію ліцензії на здійснення господарської діяльності з виробництва лікарських засобів (для національних виробників) або копію дозвільного документу на здійснення виробництва лікарських засобів, виробів медичного призначення виданого уповноваженим органом країни виробника (для іноземних виробників);
в) довідку щодо оптово-відпускної ціни на лікарський засіб або виріб медичного призначення імпортного виробництва в іноземній валюті та гривнях, що обраховується згідно підпункту першого п. 5 Порядку формування цін на лікарські засоби і вироби медичного призначення, щодо яких запроваджено державне регулювання, затвердженого постановою Кабінету Міністрів України від 25 березня 2009 р. № 333 («Офіційний вісник України», 2009, № 27, ст. 906), на дату подання заяви про державну реєстрацію ціни за одиницю продукції (споживчу упаковку) на умовах «поставка без сплати мита» з урахуванням витрат, пов’язаних з митним оформленням вантажу (зборів за митне оформлення) (додатки 3, 4);
г) обґрунтування виробником оптово-відпускної ціни на лікарський засіб або виріб медичного призначення у гривнях (або іноземній валюті) за одиницю продукції (споживчу упаковку) (додаток 5);
ґ) довідка про реєстрацію цін на лікарські засоби і вироби медичного призначення, за встановленою формою (додаток 6), в країнах, де впроваджено державну реєстрацію цін.
Документи, вказані в підпунктах а, в, г, ґ подаються на паперових та електронних носіях.
Документи подаються українською мовою або з перекладом на українську мову, засвідченим в установленому порядку. Копії документів, що подаються, повинні бути засвідчені в установленому порядку.
3. Держлікінспекція в термін, що не перевищує 15 робочих днів з дати реєстрації заяви, опрацьовує надані документи на відповідність вимогам п. 1, 2 цього Порядку, після чого направляє їх на розгляд Міжвідомчої експертної ради, а у разі неподання Заявником у повному обсязі документів, зазначених у п. 2 цього Порядку, або неналежного їх оформлення, Держлікінспекція повідомляє про це Заявника письмово. Якщо Заявник протягом 15 робочих днів після отримання повідомлення не усуває недоліки, заява залишається без розгляду, про що Держлікінспекція письмово повідомляє Заявника. Час, протягом якого Заявник доопрацьовує комплект документів, не входить до терміну проведення державної реєстрації ціни.
4. Для вирішення питань щодо державної реєстрації цін на лікарські засоби і вироби медичного призначення створюється Міжвідомча експертна рада.
Міжвідомча експертна рада здійснює свою діяльність згідно положення, що додається (додаток 7).
5. Міжвідомча експертна рада, розглянувши отримані документи, приймає рекомендації щодо здійснення державної реєстрації цін на лікарський засіб або виріб медичного призначення та направляє їх до Мінекономіки. На підставі поданих Міжвідомчою експертною радою рекомендацій Мінекономіки приймає рішення про державну реєстрацію цін на лікарський засіб або виріб медичного призначення та направляє таке рішення до Держлікінспекції. Держлікінспекція протягом 3 робочих днів з дня отримання рішення вносить відповідну інформацію до Державного реєстру та видає Заявнику, на його вимогу, витяг з Державного реєстру.
6. У випадку необґрунтованого перевищення поданих на державну реєстрацію цін на лікарський засіб чи виріб медичного призначення за даними моніторингу Держлікінспекції, Міжвідомча експертна рада пропонує Заявнику знизити ціни та надає рекомендації щодо меж зниження, направляє Заявнику таку пропозицію на погодження.
Заявник, отримавши таку пропозицію, протягом 10 робочих днів з дня отримання надає обґрунтовану відповідь або погоджує запропоновані ціни за замовчуванням.
7. У випадку відсутності протягом зазначеного строку відповіді Заявника або отримання такої відповіді, Міжвідомча експертна рада приймає відповідні рекомендації щодо здійснення державної реєстрації цін на лікарський засіб або виріб медичного призначення та направляє такі рекомендації до Мінекономіки.
8. Міжвідомча експертна рада може направити документи щодо реєстрації (перереєстрації) цін на експертизу, порядок проведення якої встановлює Мінекономіки.
9. При державній реєстрації гранична оптово-відпускна ціна вітчизняного виробника зазначається у гривнях, іноземного – в іноземній валюті і в гривнях, що обраховується згідно підпункту першого пункту 5 Порядку формування цін на лікарські засоби і вироби медичного призначення, щодо яких запроваджено державне регулювання, затвердженого постановою Кабінету Міністрів України від 25 березня 2009 р. № 333 («Офіційний вісник України», 2009, № 27, ст. 906), на дату її державної реєстрації. При цьому визначальною для подальшого розрахунку граничних постачальницько-збутових, торговельних (роздрібних) надбавок і граничної роздрібної ціни є ціна у гривнях.
10. Зареєстровані ціни підлягають перереєстрації за ініціативою Заявника або рішенням Міжвідомчої експертної ради у зв’язку зі зміною курсу валют, ставок податків і зборів (обов’язкових платежів), цін на сировину й матеріали, розміру мінімальної заробітної плати, а також інших витрат, пов’язаних з виробництвом та реалізацією лікарських засобів і виробів медичного призначення.
Мінекономіки, Мінфін, МОЗ, Держлікінспекція, за наявності підстав, передбачених в абзаці першому п. 10 цього Порядку, виносить на розгляд Міжвідомчої експертної ради питання щодо перереєстрації зареєстрованих цін. У випадку обґрунтованої необхідності перереєстрації зареєстрованих цін, Міжвідомча експертна рада приймає рекомендації щодо здійснення перереєстрації граничних оптово-відпускних цін на лікарський засіб або виріб медичного призначення та направляє їх до Мінекономіки.
На підставі прийнятого рішення Мінекономіки, Держлікінспекція протягом 3 робочих днів з дня отримання рішення вносить відповідну інформацію до Державного реєстру та направляє Заявнику витяг з Державного реєстру.
Перереєстрація цін за ініціативою Заявника відбувається у тому ж порядку, що й реєстрація, крім перереєстрації з підстав зміни курсу валют. При цьому Заявник до документів, зазначених у п. 2 цього Порядку додає пояснювальну записку з обґрунтуванням зміни цін та інші документи, що підтверджують обставини, викладені в заяві.
Перереєстрація цін з підстав зміни курсу валют здійснюється за заявою Заявника, в якій обґрунтовується зміна курсу валют та її вплив на ціну. До заяви додаються документи, що підтверджують зміну курсу валют та інші обставини, викладені в заяві. Строк перереєстрації з зазначеної підстави не може перевищувати 10 робочих днів з моменту реєстрації відповідної заяви.
11. Держлікінспекція оприлюднює відомості про зареєстровані ціни на лікарські засоби і вироби медичного призначення в друкованих та електронних засобах масової інформації, збірниках тощо, а також розміщує відповідну інформацію на офіційному сайті.
12. Документи, пов’язані з державною реєстрацією цін на лікарські засоби і вироби медичного призначення, зберігаються в установленому порядку протягом одного року після закінчення терміну дії зареєстрованих цін.
ДОДАТКИ ДО ПОРЯДКУ ДЕРЖАВНОЇ РЕЄСТРАЦІЇ ГРАНИЧНИХ ОПТОВО-ВІДПУСКНИХ ТА РОЗДРІБНИХ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
ЗАТВЕРДЖЕНО
постановою Кабінету Міністрів України
від ___ ___________ _____ р. № ______
ПОЛОЖЕННЯ
ПРО ДЕРЖАВНИЙ РЕЄСТР ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
1. Державний реєстр цін на лікарські засоби і вироби медичного призначення (далі —Державний реєстр) містить відомості про граничні оптово-відпускні та граничні роздрібні ціни на лікарські засоби і вироби медичного призначення, що включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480).
2. Державний реєстр ведеться з метою забезпечення:
- організації державної системи відшкодування вартості лікарських засобів;
- визначення граничних оптово-відпускних та граничних роздрібних цін, що визначені з урахуванням встановлених граничних постачальницько-збутових та граничних торговельних (роздрібних) надбавок;
- доступності інформації про граничні оптово-відпускні та граничні роздрібні ціни на лікарські засоби.
3. Державний реєстр веде Держлікінспекція.
4. До Державного реєстру вносяться такі відомості:
4.1. Для лікарських засобів:
- реєстраційний номер;
- номер та дата наказу Мінекономіки про державну реєстрацію цін;
- міжнародна непатентована назва;
- код АТХ;
- торговельна назва;
- лікарська форма, дозування, упаковка, кількість у первинній і споживчій упаковці;
- номер реєстраційного посвідчення на лікарський засіб або сертифікату про державну реєстрацію медичного імунобіологічного препарату, дата видачі і термін дії;
- ціна за споживчу упаковку;
- валюта;
- гранична оптово-відпускна ціна, грн.;
- гранична роздрібна ціна, грн.;
- гранична роздрібна ціна при закупівлі за бюджетні кошти, грн.;
- відомості про включення до Національного переліку основних лікарських засобів і виробів медичного призначення.
4.2. Для виробів медичного призначення:
- реєстраційний номер;
- номер та дата наказу Мінекономіки про державну реєстрацію цін;
- назва медичного виробу;
- тип, вид, марка тощо;
- код УКТЗЕД;
- ціна за споживчу упаковку;
- валюта;
- гранична оптово-відпускна ціна, грн.;
- гранична роздрібна ціна, грн.;
- гранична роздрібна ціна при закупівлі за бюджетні кошти, грн.;
- відомості включення до Національного переліку основних лікарських засобів і виробів медичного призначення.
5. Державний реєстр ведеться в електронному вигляді за формою, що додається.
6. Виключення відомостей щодо граничних цін на лікарський засіб або виріб медичного призначення з Державного реєстру здійснюється Держлікінспекцією у зв’язку із закінченням терміну дії його державної реєстрації або на підставі рішення Міністерства охорони здоров’я про повну або тимчасову заборону застосування лікарського засобу шляхом припинення дії реєстраційного посвідчення.
У разі виключення лікарського засобу або виробу медичного призначення з Державного реєстру, заборони його застосування на території України чи перереєстрації граничної оптово-відпускної та роздрібної ціни у Державному реєстрі робиться відповідний запис.
7. Відомості щодо зареєстрованих цін на лікарські засоби і вироби медичного призначення оприлюднюються в друкованих та електронних засобах масової інформації та на офіційному сайті Держлікінспекції.
ЗАТВЕРДЖЕНО
постановою Кабінету Міністрів України
від ___ ___________ _____ р. № ______
ПОРЯДОК
ПРОВЕДЕННЯ МОНІТОРИНГУ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
1. Загальні положення
1.1. Цей Порядок встановлює процедуру проведення моніторингу цін на лікарські засоби і вироби медичного призначення (далі — Порядок).
1.2. Моніторинг цін (далі — моніторинг) проводиться на всі торговельні назви лікарських засобів і виробів медичного призначення згідно міжнародних непатентованих назв, що включені до Національного переліку основних лікарських засобів і виробів медичного призначення, затвердженого постановою Кабінету Міністрів України від 25 березня 2009 р. № 333 («Офіційний вісник України», 2009, № 27, ст. 906) та/або до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480).
Моніторингу цін підлягають фактичні оптово-відпускні, закупівельні та роздрібні ціни, а також ціни на лікарські засоби і вироби медичного призначення, що закуповуються за бюджетні кошти. Уцінені товари до моніторингу не включаються.
1.3. Цей порядок поширюється на всіх суб‘єктів господарювання, що здійснюють виробництво, оптову та роздрібну торгівлю лікарськими засобами (далі — суб’єкти господарювання), МОЗ та МОЗ Автономної Республіки Крим, обласні, Київську та Севастопольську міські державні адміністрації, що здійснюють закупівлі лікарських засобів і виробів медичного призначення за бюджетні кошти, Держмитслужбу.
1.4. Метою проведення моніторингу є вивчення рівня та динаміки цін на лікарські засоби і вироби медичного призначення, їх аналіз і порівняння, та внесення на підставі отриманих даних пропозицій щодо удосконалення державного регулювання ціноутворення, а також аналіз даних для державної реєстрації цін на лікарські засоби і вироби медичного призначення.
1.5. Організація моніторингу та аналіз отриманих даних здійснюється Держлікінспекцією, збір даних — територіальними держаними інспекціями з контролю якості лікарських засобів в Автономній Республіці Крим, областях, містах Києві та Севастополі (далі — територіальні органи Держлікінспекції) згідно з цим Порядком. Суб’єкти господарювання та органи влади надають інформацію в паперовій та електронній формі. Порядок надання інформації в електронній формі встановлює Держлікінспекція.
2. Принципи відбору територій та суб’єктів господарювання, на базі яких проводиться моніторинг
2.1. Спостереження за змінами цін проводиться у міських поселеннях всіх регіонів країни. Відбір міських поселень, в яких проводиться моніторинг, здійснюється Держлікінспекцією і є репрезентативним для розрахунку індексу цін для кожного з 27 регіонів країни.
2.2. Інформація про роздрібні ціни на лікарські засоби і вироби медичного призначення збирається в обласних центрах, містах Києві, Сімферополі, Севастополі та містах і районних центрах, які відібрані на основі процедури стратифікованого багатоступеневого відбору з елементами методу імовірності, пропорційній розміру. Цей метод передбачає відбір одиниць з генеральної сукупності шляхом надання кожній одиниці ймовірність включення у вибірку, яка пропорційна чисельності населення.
Процес відбору складається з таких етапів.
На першому етапі міські поселення розподіляються на групи в залежності від середньорічної чисельності наявного міського населення кожного з регіонів:
- 1 група — чисельність населення більше 100 000 осіб;
- 2 група — від 50 001 до 100 000 осіб;
- 3 група — від 25 001 до 50 000 осіб;
- 4 група — до 25 000 осіб.
На другому етапі проводяться розрахунки частки кількості реєстрацій цін по країні (кількість реєстрацій – 10% від загальної кількості аптек), а також частки населення і реєстрацій за кожною групою всередині регіону з метою зіставлення даних по кожному регіону в цілому з даними по країні. Відповідність цих співвідношень є критерієм для відбору міських поселень для спостереження за змінами цін на лікарські засоби і вироби медичного призначення.
На третьому етапі здійснюється відбір міських поселень з кожної групи. Кожна група є зменшеною генеральною сукупністю, в якій відбір здійснюється окремо.
До спостереження за змінами цін включені всі міські поселення з першої та другої груп, які є саморепрезентативними.
З третьої та четвертої груп відібрані по одному міському поселенню, які відповідають таким вимогам:
- найбільша кількість населення та реєстрацій цін;
- репрезентативність моделей споживання для кожного з регіонів;
- рівномірне географічне охоплення регіонів реєстрацією цін.
Перелік міських поселень, в яких проводиться моніторинг, кількість реєстрацій цін в них, перелік суб’єктів господарювання для моніторингу закупівельних і роздрібних цін щорічно, до 1 березня, переглядається та затверджується Держлікінспекцією. Якщо з об’єктивних причин неможливо набрати необхідну кількість реєстрацій у визначеному міському поселенні, допускається заміна відповідної кількості суб’єктів із інших міських поселень даного району або обласного центру; відповідна заміна затверджується наказом Держлікінспекції.
2.3. Моніторинг закупівельних і роздрібних цін здійснюється за вибірковим колом суб’єктів господарювання. Відбір суб’єктів господарювання для моніторингу проводять спеціалісти територіальних органів Держлікінспекції на місцях. Кількість суб’єктів господарювання для моніторингу роздрібних цін становить 10% від загальної кількості аптек у регіоні; закупівельних цін — 10% від загальної кількості у регіоні суб’єктів господарювання, що мають ліцензію на оптову торгівлю лікарськими засобами. Територіальні органи Держлікінспекції щорічно складають перелік суб’єктів господарювання регіону, що приймають участь у моніторингу, та до 25 січня надсилають його до Держлікінспекції.
Моніторинг проводиться в аптеках (роздрібні ціни) та аптечних складах (закупівельні ціни) усіх форм власності (державної, приватної, комунальної). У кожному поселенні відбираються великі, середні, малі підприємства (аптеки), розташовані як у центральній частині міського поселення, так і віддалені від центру. Кількість аптек, що відносяться до однієї аптечної мережі одного й того самого суб’єкта господарювання, не може перевищувати 10% від загальної кількості аптек, що приймають участь у моніторингу роздрібних цін в одному регіоні та/або місті.
Не допускається участь у моніторингу роздрібних цін тільки 1 суб’єкта господарювання в регіоні, а також розрахунок індексів цін на основі однієї зареєстрованої ціни.
3. Порядок збору інформації про ціни
3.1. Моніторинг оптово-відпускних цін імпортного товару здійснюється на підставі даних, які щомісячно надаються Держмитслужбою за формою (додаток 1) відповідно до встановленого порядку.
3.2. Моніторинг оптово-відпускних цін на лікарські засоби вітчизняного виробництва здійснюється щомісячно на всіх вітчизняних підприємствах-виробниках лікарських засобів (додаток 2), дані збираються на електронних та паперових носіях.
3.3. Збір інформації щодо роздрібних і закупівельних цін на лікарські засоби і вироби медичного призначення проводиться щомісячно фахівцями територіальних органів Держлікінспекції шляхом отримання даних від суб’єктів за затвердженою формою (додатки 3, 4) в електронному вигляді.
3.4. Збір інформації щодо цін на лікарські засоби і вироби медичного призначення, що закуповуються за бюджетні кошти проводиться щомісячно Держлікінспекцією шляхом отримання даних від МОЗ та МОЗ Автономної Республіки Крим, обласних, Київської та Севастопольської міських державних адміністрацій за затвердженою формою (додаток 5) на електронному та паперовому носіях.
3.5. В окремих випадках, за окремими дорученнями або розпорядженнями Кабінету Міністрів України, Міністерства охорони здоров’я та інших центральних органів виконавчої влади, збір інформації проводиться з періодичністю, визначеною таким документом.
3.6. Суб’єкти господарювання та органи виконавчої влади в термін до 7 числа наступного за звітним місяця надають інформацію в електронному вигляді до територіальних органів Держлікінспекції або до Держлікінспекції, паралельно відправляючи копію зазначених даних на паперовому носії поштою (за необхідністю). Фахівці територіальних органів Держлікінспекції перевіряють:
а) правильність заповнення електронних форм;
б) відповідність електронних форм паперовим носіям (вибірково) та в термін до 9 числа наступного за звітним місяця передають інформацію до Держлікінспекції.
4. Розрахунок середніх цін та індексів цін на регіональному рівні
4.1. Після отримання даних з територіальних органів Держлікінспекції, фахівцями Держлікінспекції в термін до 15 числа наступного за звітним місяця проводиться розрахунок середніх цін, індексів цін та їх аналіз як на регіональному рівні, так і в цілому по Україні.
4.2. Розрахунки середніх цін, індивідуальних, групових та зведених індексів цін на регіональному рівні проводяться для закупівельних, роздрібних та цін, за якими лікарські засоби і вироби медичного призначення закуповуються за бюджетні кошти.
4.3. Спочатку розраховуються середні ціни на кожний товар (послугу) у кожному регіоні за звітний та попередній місяці на основі порівняних цін, на кожну товарну позицію, за формулою (1):
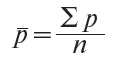
де: ![]() — середня ціна;
— середня ціна;
![]() — сума порівняних цін;
— сума порівняних цін;
n — кількість порівняних цін.
4.4. На основі розрахованих середніх цін розраховується індивідуальний індекс цін (![]() ) на кожну товарну позицію (з точністю до 0,0001) за формулою (2):
) на кожну товарну позицію (з точністю до 0,0001) за формулою (2):
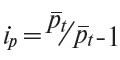
де: ![]() — середня ціна звітного місяця;
— середня ціна звітного місяця;
![]() — середня ціна попереднього місяця.
— середня ціна попереднього місяця.
4.5. Територіальне варіювання цін (закупівельних, роздрібних) визначають за допомогою коефіцієнта варіації цін (v) за формулою (3):
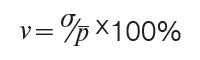
де: ? — середнє квадратичне відхилення цін.
4.6. Середнє квадратичне відхилення визначається за формулою (4):
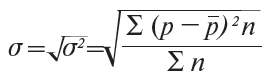
4.7. Груповий індекс цін (Ig) визначається як середньоарифметичний показник з індивідуальних індексів цін лікарських засобів або виробів медичного призначення, які увійшли у вибірку (формула 5):
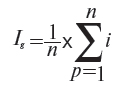
4.8. Зведений індекс цін (I) розраховується як середньозважений із групових індексів, де за вагу припускається питома вага середньомісячної реалізації певної групи продукції у загальному обсязі реалізації лікарських засобів, стосовно яких проводиться моніторинг, у базисному періоді, за формулою (6):
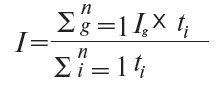
де: ti — питома вага обсягу середньомісячної реалізації певної групи медикаментів у загальному обсязі реалізації лікарських засобів, стосовно яких проводився моніторинг, у базисному періоді.
5. Розрахунок середніх роздрібних цін та індексів цін по Україні
5.1. Середні оптово-відпускні (для імпортних препаратів), закупівельні та роздрібні ціни по країні (![]() ) розраховуються як середньозважені, де за вагу припускається чисельність населення регіону до загальної чисельності населення в Україні за формулою (7):
) розраховуються як середньозважені, де за вагу припускається чисельність населення регіону до загальної чисельності населення в Україні за формулою (7):
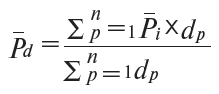
де:![]() — середня роздрібна ціна на лікарський засіб або виріб медичного призначення у досліджуваному регіоні;
— середня роздрібна ціна на лікарський засіб або виріб медичного призначення у досліджуваному регіоні;
dp— питома вага середньорічного наявного населення цього регіону в загальній чисельності населення країни;
n — кількість регіонів країни.
Якщо ціна на лікарський засіб в якомусь регіоні не була зареєстрована в поточному або попередньому періоді, то при розрахунку середньої ціни по Україні питома вага чисельності населення такого регіону не враховується.
5.2. За формулами (3), (4) розраховуються показники варіації цін, групові індекси розраховуються за формулою (5).
5.3. Зведений індекс цін на лікарські засоби і вироби медичного призначення розраховується за формулою (6), де за вагу припускається обсяг середньомісячного товарообігу певної групи медикаментів до загальної структури товарообігу лікарських засобів і виробів медичного призначення, за якими проводився моніторинг цін.
5.4. Розрахунки індексів цін до різних базисних періодів (за необхідності) проводяться відповідно до порядку, встановленому Держкомстатом.
6. Формування вагової структури
6.1. Розрахунки вагових коефіцієнтів здійснюються шляхом нормалізації через ділення кожного вагового коефіцієнта на суму всіх вагових коефіцієнтів у базисному періоді. В результаті сума вагових коефіцієнтів дорівнює одиниці або 100%.
Перегляд вагової структури проводиться щорічно.
У випадку, якщо за вагу припускається середньомісячний показник, він розраховується шляхом ділення значення річного показника на 12.
7. Визначення показників доступності основних лікарських засобів
7.1. Доступність лікарських засобів (D) визначається за формулою (8):
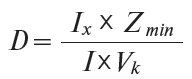
де: Ix— індекс зміни середньої заробітної плати за визначений період;
Z min — мінімальна заробітна плата в країні;
I — зведений індекс цін на лікарські засоби за той же період часу;
Vk — вартість споживчого кошика в досліджуваний період.
7.2. Для збільшення рівня доступності і досягнення межі доступності лікарських засобів (D = 1) індекс росту цін не повинен перевищувати індекс росту заробітної плати, а мінімальна заробітна плата в країні повинна наближатися до вартості споживчого кошика.
7.3. При розрахунку показника доступності, застосовуються статистичні дані за відповідний період, що розміщені на офіційному сайті Державного комітету статистики України .
8. Перевірка достовірності інформації
8.1. Інформація щодо цін на лікарські засоби і вироби медичного призначення, зібрана в процесі моніторингу, є основою для розрахунку індексу цін і потребує проведення ряду контрольних заходів з метою забезпечення її відповідної якості та достовірності.
8.2. Працівники територіальних органів Держлікінспекції після отримання даних від суб’єктів господарювання здійснюють контроль правильності проведення моніторингу через перевірки форм звітності з моніторингу, які надходять від суб’єктів.
Контроль форм звітності в електронному вигляді включає такі складові:
- своєчасність надходження форм звітності в електронному вигляді;
- правильність заповнення полів форми;
- відповідність електронних форм паперовому варіанту (вибірково);
- підтвердження незвичайної або значної (більше 10%) зміни ціни.
Форми звітності на паперових носіях, що надходять від суб’єктів поштою, перевіряються на правильність заповнення полів форми, наявність підпису керівника та печатки суб’єкта, та зберігаються протягом року у відповідних територіальних органах Держлікінспекції.
Якщо знайдені помилки, форму необхідно повернути до суб’єкта, який вносить необхідні зміни та надсилає форму до територіального органу Держлікінспекції, після повторної перевірки фахівцями форма надсилається до Держлікінспекції.
ЗАТВЕРДЖЕНО
постановою Кабінету Міністрів України
від ___ ___________ _____ р. № ______
ЗМІНИ, ЩО ВНОСЯТЬСЯ ДО ПОСТАНОВ КАБІНЕТУ МІНІСТРІВ УКРАЇНИ
1. Внести до Правил торгівлі лікарськими засобами, затверджених постановою Кабінету Міністрів України від 17 листопада 2004 р. № 1570 (Офіційний вісник України, 2004, № 47, ст. 3105; 2007, № 52, ст. 2123), такі зміни:
1). Абзац другий пункту 5 викласти в такій редакції:
«Забороняється торгівля неякісними та фальсифікованими лікарськими засобами, а також лікарськими засобами і виробами медичного призначення, ціни на які підлягають державній реєстрації, та не зареєстровані у встановленому порядку.».
2). Пункт 11 після абзацу одинадцятого доповнити новим абзацом такого змісту:
«надавати Держлікінспекції інформацію про оптово-відпускні та закупівельні ціни на лікарські засоби і вироби медичного призначення, що включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480);».
3). Пункт 23 після абзацу восьмого доповнити новим абзацом такого змісту:
«надавати Держлікінспекції інформацію про закупівельні та роздрібні ціни на лікарські засоби і вироби медичного призначення, що включені до Переліку лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затвердженого постановою Кабінету Міністрів України від 5 вересня 1996 р. № 1071 (Зібрання постанов Уряду України, 1996, № 17, ст. 480);». 2. Порядок здійснення державного контролю за якістю лікарських засобів, що ввозяться в Україну, затвердженого постановою Кабінету Міністрів України від 14 вересня 2005 р. № 902 (Офіційний вісник України, 2005, № 37, ст. 2297), після пункту 4 доповнити новим пунктом 4–1 такого змісту:
«Суб’єкт господарювання до початку митного оформлення вантажу подає заяву до органу державного контролю за місцем провадження господарської діяльності для отримання довідки щодо ввезення лікарських засобів на митну територію України та їх ціну (далі — довідка) в паперовому та електронному вигляді за формою, затвердженою Держлікінспекцією спільно з Держмитслужбою.
Для отримання довідки суб‘єкт господарювання подає органові державного контролю заяву за формою, затвердженою Держлікінспекцією.
Орган державного контролю протягом п‘яти робочих днів здійснює розгляд поданих документів, проведення моніторингу цін, підтвердження факту, що лікарські засоби не належать до таких, обіг яких було заборонено відповідними органами державного контролю, в тому числі за ознаками фальсифікації.
За результатами розгляду, орган державного контролю видає суб‘єкту господарювання довідку та один екземпляр поданої копії рахунку-фактури (інвойсу) з відміткою про видачу довідки.
Довідка щодо ввезення лікарських засобів на митну територію України та їх ціну дійсна протягом двох тижнів та подається суб‘єктом господарювання до відповідного митного органу»; 3. Підпункт двадцять п‘ятий пункту 4 Положення про Державну інспекцію з контролю якості лікарських засобів, затвердженого постановою Кабінету Міністрів України від 20 грудня 2008 р. № 1121 («Офіційний вісник України», 2008 р., № 100, ст. 3312), викласти в такій редакції:
«25) організовує і проводить державну реєстрацію граничних оптово-відпускних і граничних роздрібних цін на лікарські засоби і медичну продукцію, ведення Державного реєстру граничних оптово-відпускних і роздрібних цін, здійснює моніторинг цін на лікарські засоби і медичну продукцію;». 4. Абзац четвертий пункту 1 постанови Кабінету Міністрів України від 17 жовтня 2008 р. № 955 «Про заходи щодо стабілізації цін на лікарські засоби і вироби медичного призначення» («Офіційний вісник України», 2008 р., № 84, ст. 2825; 2009, № 27, ст. 906) викласти в такій редакції:
«На лікарські засоби і вироби медичного призначення вітчизняного виробництва, включені до Національного переліку основних лікарських засобів і виробів медичного призначення (крім наркотичних, психотропних лікарських засобів, прекурсорів та медичних газів) та оптово-відпускна ціна яких нижча ніж 12 грн. за одну упаковку, встановити граничні постачальницько-збутові надбавки не вище ніж 15 відсотків оптово-відпускної ціни та граничні торговельні (роздрібні) надбавки не вище ніж 35 відсотків закупівельної ціни.» 5. Внести до постанови Кабінету Міністрів України від 25 березня 2009 р. № 333 «Деякі питання державного регулювання цін на лікарські засоби і вироби медичного призначення» («Офіційний вісник України», 2009, № 27, ст. 906), такі зміни:
1) Пункт 4 Порядку формування цін на лікарські засоби і вироби медичного призначення, щодо яких запроваджено державне регулювання, затвердженого постановою Кабінету Міністрів України від 25 березня 2009 р. № 333, викласти в такій редакції: «4. Оптово-відпускна ціна є ціною одиниці імпортованого товару або ціною одиниці товару, що встановлюється у договорі, укладеному між вітчизняним товаровиробником та суб‘єктом господарювання, в межах зареєстрованої граничної оптово-відпускної ціни.».
| Міністр охорони здоров’я України | В.М. Князевич |
Додаток 1
до п. 2 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
ЗАЯВА
ПРО ДЕРЖАВНУ РЕЄСТРАЦІЮ ГРАНИЧНИХ ОПТОВО-ВІДПУСКНИХ ТА РОЗДРІБНИХ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ
|
Дата надходження: “___” _____________ 20__ р. |
Зареєстровано за № _______/ДІ |
Заявник:
|
Назва |
|
|
Країна |
|
|
Юридична адреса |
|
|
Фактична адреса |
|
|
Тел., факс, ел. пошта |
|
|
Посада, П.І.Б. керівника підприємства |
|
|
Контактна особа |
Виробник:
|
Назва |
|
|
Країна |
|
|
Адреса |
|
|
Тел., факс, ел. пошта |
|
|
Посада, П.І.Б. керівника підприємства |
|
|
Контактна особа |
|
|
Номер, дата видачі, термін дії ліцензії на виробництво лікарських засобів для вітчизняного виробника або дозвільного документу на здійснення виробництва лікарських засобів для іноземного виробника |
Лікарські засоби, заявлені для державної реєстрації граничних оптово-відпускних та роздрібних цін:
|
№ з/п |
Міжнародна непатентована назва |
Код АТХ |
Торговельна назва лікарського засобу |
Лікарська форма, дозування, упаковка, кількість в первинній та споживчій упаковці |
Гранична оптово-відпускна ціна за споживчу упаковку, грн. |
Гранична роздрібна ціна за споживчу упаковку, грн. |
Реєстраційне посвідчення / Сертифікат про державну реєстрацію |
||
|
№ |
дата видачі |
термін дії |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
До заяви додаються такі документи згідно з пунктом 2 Порядку:
П.І.Б., посада і підпис керівника
(представника) Заявника ________________________
МП
Дата заповнення заяви “____” ______________ 20__ р.
Додаток 2
до п. 2 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
ЗАЯВА
ПРО ДЕРЖАВНУ РЕЄСТРАЦІЮ ГРАНИЧНИХ ОПТОВО-ВІДПУСКНИХ ТА РОЗДРІБНИХ ЦІН
НА ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
|
Дата надходження: “___” _____________ 20__ р. |
Зареєстровано за № _______/ДІ |
Заявник:
|
Назва |
|
|
Країна |
|
|
Юридична адреса |
|
|
Фактична адреса |
|
|
Тел., факс, ел. пошта |
|
|
Посада, П.І.Б. керівника підприємства |
|
|
Контактна особа |
Виробник:
|
Назва |
|
|
Країна |
|
|
Адреса |
|
|
Тел., факс, ел. пошта |
|
|
Посада, П.І.Б. керівника підприємства |
|
|
Контактна особа |
|
|
Номер, дата видачі, термін дії дозвільного документу на здійснення виробництва виробів медичного призначення (для іноземного виробника) |
Вироби медичного призначення, заявлені для державної реєстрації граничних оптово-відпускних та роздрібних цін:
|
№ з/п |
Назва медичного виробу |
Тип, вид, марка тощо |
Клас безпеки |
Код УКТЗЕД |
Гранична оптово-відпускна ціна, грн. |
Гранична роздрібна ціна, грн. |
Свідоцтво про державну реєстрацію |
||
|
№ |
дата видачі |
термін дії |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
До заяви додаються такі документи згідно з пунктом 2 Порядку:
П.І.Б., посада і підпис керівника
(представника) Заявника ________________________
МП
Дата заповнення заяви “____” ______________ 20__ р.
Додаток 3
до п. 2 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
ДАНІ ЩОДО ГРАНИЧНОЇ ОПТОВО-ВІДПУСКНОЇ ЦІНИ
(ДЛЯ ЛІКАРСЬКИХ ЗАСОБІВ ІМПОРТНОГО ВИРОБНИЦТВА)
Заявник (назва, країна) ________________________________________________
Виробник (назва, країна) ______________________________________________
|
№ з/п |
Торговельна назва лікарського засобу |
Лікарська форма, дозування, упаковка, кількість в первинній та споживчій упаковці |
Код УКТЗЕД |
Обсяги реалізації в Україні |
Контрактна ціна у валюті |
Середній курс валюти на міжбанківському валютному ринку |
Курс НБУ |
Митні витрати |
Гранична оптово-відпускна ціна за споживчу упаковку з урахуванням митних витрат, грн. |
||||
|
звіт*, к-ть, тис. уп. |
в країні походження |
в Україні |
прогноз |
попередня реєстрація |
|||||||||
|
звіт* |
прогноз |
звіт* |
прогноз |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
П.І.Б., посада і підпис керівника
(представника) Заявника ________________________
МП
Дата заповнення заяви “____” ______________ 20__ р.
*звіт – звітний період (6 місяців, що передують даті заяви щодо державної реєстрації граничної оптово-відпускної ціни).
Додаток 4
до п. 2 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
ДАНІ ЩОДО ОПТОВО-ВІДПУСКНОЇ ЦІНИ
(ДЛЯ ВИРОБІВ МЕДИЧНОГО ПРИЗНАЧЕННЯ ІМПОРТНОГО ВИРОБНИЦТВА)
Заявник (назва, країна) ________________________________________________
Виробник (назва, країна) ______________________________________________
|
№ з/п |
Назва медичного виробу |
Тип, вид, марка тощо |
Код УКТЗЕД |
Обсяги реалізації в Україні |
Контрактна ціна у валюті |
Середній курс валюти на міжбанківському валютному ринку |
Курс НБУ |
Митні витрати звіт*, к-ть, тис. уп. |
Гранична оптово-відпускна ціна за споживчу упаковку з урахуванням митних витрат, грн. |
||||
|
звіт*, |
в країні походження |
в Україні |
прогноз |
попередня реєстрація |
|||||||||
|
звіт* |
прогноз |
звіт* |
прогноз |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
П.І.Б., посада і підпис керівника
(представника) Заявника ________________________
МП
Дата заповнення заяви “____” ______________ 20__ р.
*звіт – звітний період (6 місяців, що передують даті заяви щодо державної реєстрації граничної оптово-відпускної ціни).
Додаток 5
до п. 2 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
КАЛЬКУЛЯЦІЯ
(ВИЗНАЧЕННЯ ЦІНИ)
Заявник _____________________________________________________________
Виробник ___________________________________________________________
Назва лікарського засобу, лікарська форма, дозування, упаковка, кількість у первинній та споживчій упаковці або назва, тип, вид, марка тощо виробу медичного призначення
____________________________________________________________________
|
№ з/п |
Статті витрат |
Одиниця виміру |
На одиницю лікарського засобу (споживчу упаковку) |
Питома вага, % |
|
1 |
2 |
3 |
4 |
5 |
|
1 |
Сировина (або “ін балк”) та матеріали, у т.ч.: |
|||
|
1.1. |
Діюча речовина 1, виробник, країна виробника |
|||
|
1.2. |
Діюча речовина 2, виробник, країна виробника |
|||
|
1.n. |
Діюча речовина n, виробник, країна виробника |
|||
|
1.3 |
Матеріали |
|||
|
2 |
Напівфабрикати та комплектуючі вироби |
|||
|
3 |
Паливо та енергія на технологічні цілі |
|||
|
4 |
Зворотні відходи |
|||
|
5 |
Основна заробітна плата |
|||
|
6 |
Додаткова заробітна плата |
|||
|
7 |
Відрахування на соціальне страхування |
|||
|
8 |
Витрати на утримання та експлуатацію обладнання |
|||
|
9 |
Загальновиробничі витрати |
|||
|
10 |
Збитки від браку |
|||
|
11 |
Інші виробничі витрати |
|||
|
12 |
Попутна продукція |
|||
|
13 |
Виробнича собівартість1 |
|||
|
14 |
Адміністративні витрати |
|||
|
15 |
Витрати на збут |
|||
|
16 |
Інші витрати |
|||
|
17 |
Повна собівартість2 |
|||
|
18 |
Прибуток |
|||
|
19 |
Ціна3 |
100 |
||
|
Рентабельність, %4 |
П.І.Б., посада і підпис керівника
(представника) Заявника ________________________
МП
Дата заповнення заяви “____” ______________ 20__ р.
Примітка. Для іноземного виробника у випадку неможливості заповнення встановленої форми, допускається її заповнення в довільній.
1 Виробнича собівартість = сума рядків ((01+02+03)-04+(05+06+07+08+09+10+11))-12;
2 Повна собівартість = сума рядків (13+14+15+16);
3 Ціна = сума рядків (17 + 18);
4 Рентабельність = (18:17 100).
Додаток 6
до п. 2 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
ДОВІДКА ЩОДО РЕЄСТРАЦІЇ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ
В КРАЇНАХ, ДЕ ЗАСТОСОВУЄТЬСЯ ДЕРЖАВНЕ РЕГУЛЮВАННЯ
Заявник _____________________________________________________________
Виробник ___________________________________________________________
|
№ з/п |
Торговельна назва лікарського засобу в Україні |
Лікарська форма, дозування, упаковка, кількість в первинній та споживчій упаковці |
Назва країни |
Назва країни |
Назва країни |
||||||
|
Торговельна назва |
Ціна за уп. |
Валюта |
Торговельна назва |
Ціна за уп. |
Валюта |
Торговельна назва |
Ціна за уп. |
Валюта |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Примітка. У випадку, якщо ціна зареєстрована більше ніж у трьох країнах, тоді рядок дублюється (повторюються дані, зазначені у графах 2, 3, без зазначення наступного порядкового номеру).
П.І.Б., посада і підпис керівника
(представника) Заявника ________________________
МП
Дата заповнення заяви “____” ______________ 20__ р.
Додаток 7
до п. 4 Порядку державної реєстрації граничних оптово-відпускних
цін на лікарські засоби і вироби медичного призначення
ПОЛОЖЕННЯ
ПРО МІЖВІДОМЧУ ЕКСПЕРТНУ РАДУ
1.Міжвідомча експертна рада (далі – Рада) є постійно діючим міжвідомчим органом.
2. Рада у своїй діяльності керується Конституцією і законами України, а також указами Президента України та постановами Верховної Ради України, прийнятими відповідно до Конституції і законів України, актами Кабінету Міністрів України та цим Положенням.
3.Рада діє на принципах відкритості та прозорості.
4. Основним завданням Ради є:
- прийняття рішення про рекомендацію про здійснення державної реєстрації граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення або їх перереєстрацію;
- визначення необхідності проведення перереєстрації зареєстрованих граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення.
5.Рада відповідно до покладених на неї завдань має право:
- розглядати документи, що подаються на державну реєстрацію граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення;
- приймати рекомендації щодо здійснення державної реєстрації граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення;
- приймати рекомендації щодо здійснення перереєстрації граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення;
- одержувати в установленому порядку від центральних та місцевих органів виконавчої влади, підприємств, установ та організацій документи, інформацію, експертні висновки необхідні для виконання покладених на неї завдань;
- направляти документи щодо державної реєстрації (перереєстрації) граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення на експертизу.
6.Рада під час виконання покладених на неї завдань взаємодіє із органами державної влади, органами місцевого самоврядування, підприємствами, установами та організаціями.
7.До складу Ради входить представник від МОЗ, Мінфіну, Держцінінспекції, ДПА, по представники Мінекономіки та Держлікінспекції. Один з представників Держлікінспекції є секретарем Ради.
Персональний склад Ради затверджує Міністерство економіки України.
8.Голова Ради, заступник голови обираються зі складу її членів на першому засіданні. Голова Ради здійснює керівництво її діяльністю, затверджує регламент роботи, порядок денний засідань.
9.За дорученням голови Ради його обов’язки виконує заступник голови або секретар Ради.
10. Секретар Ради забезпечує організацію її роботи, зокрема веде протоколи засідань Ради та контролює стан виконання прийнятих нею рішень.
11. Голова, заступник голови та секретар Ради представляють її у відносинах з органами державної влади, органами місцевого самоврядування, підприємствами, установами та організаціями.
12. Регламент Ради затверджує голова за поданням секретаря Ради.
13. Формою роботи Ради є засідання, які проводяться за необхідності, але не рідше ніж один раз на місяць.
14. Засідання Ради проводить її голова або особа, яка виконує його обов‘язки.
15. Засідання Ради є правоможним, якщо на ньому присутні більш як половина її членів.
16. Рішення Ради вважається прийнятим, якщо за нього проголосувало більш як половина присутніх на засіданні членів Ради. У випадку поділу голосів порівну, прийнятим є те, рішення, за яке проголосував голова Ради.
17. Рішення Ради оформляється протоколом, який підписується секретарем Ради та її головою.
18. Рішення Ради стосовно державної реєстрації та/або перереєстрації граничних оптово-відпускних та роздрібних цін на лікарські засоби і вироби медичного призначення мають обов‘язковий характер для суб’єктів господарювання та Держлікінспекції.
19. Організаційне, інформаційне та матеріально-технічне забезпечення діяльності Ради здійснює Держлікінспекція.
20. Рада використовує в роботі бланк із своїм найменуванням.
Додаток
до Положення про Державний реєстр
цін на лікарські засоби і вироби медичного призначення
ДЕРЖАВНИЙ РЕЄСТР
ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
|
Реєстраційний № |
№ і дата наказу Мінекономіки про державну реєстрацію цін |
Міжнародна непатентована назва |
Код АТХ |
Торговельна назва |
Лікарська форма, дозування, упаковка, кількість у первинній і споживчій упаковці |
Номер реєстраційного посвідчення на лікарський засіб або сертифікату про державну реєстрацію медичного імунобіологічного препарату, дата видачі і термін дії |
Ціна за споживчу упаковку |
Валюта |
Гранична оптово-відпускна ціна, грн. |
Гранична роздрібна ціна, грн. |
Гранична роздрібна ціна при закупівлі за бюджетні кошти, грн. |
Включення до Національного переліку |
Примітка |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
(для лікарських засобів і медичних імунобіологічних препаратів)
|
Реєстраційний № |
№ і дата наказу Мінекономіки про державну реєстрацію цін |
Назва медичного виробу |
Тип, вид, марка тощо |
Код УКТЗЕД |
Ціна за споживчу упаковку |
Валюта |
Гранична оптово-відпускна ціна, грн. |
Гранична роздрібна ціна, грн. |
Гранична роздрібна ціна при закупівлі за бюджетні кошти, грн. |
Включення до Національного переліку |
Примітка |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
(для виробів медичного призначення)
Додаток 1
до п. 3.1 Порядку проведення моніторингу
цін на лікарські засоби і вироби медичного призначення
ІНФОРМАЦІЯ ЩОДО ОПТОВО-ВІДПУСКНИХ ЦІН НА ІМПОРТНІ
ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ
Назва установи ____________________________________________
Період за який надається інформація з __,___,__ по ___,___,____
|
№ |
Торговельна назва |
Код товару згідно УКТЗЕД |
Номер реєстраційного посвідчення |
Назва та країна виробника |
Країна походження |
Назва та адресавідправника / експортера |
Назва та адреса одержувача / імпортера, код ЄДРПОУ |
Митниця на кордоні |
Дата митного оформлення |
Умови поставки |
Валюта інвойсу |
Курс валюти |
Одиниця виміру |
Кількість |
Ціна за одиницю |
Вартість |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|||
|
Керівник _____________________ (П.І.Б.) |
||||
|
МП |
||||
Додаток 2
до п. 3.2 Порядку проведення моніторингу
цін на лікарські засоби і вироби медичного призначення
|
ФОРМА ЗВІТНОСТІ З МОНІТОРИНГУ ОПТОВО-ВІДПУСКНИХ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ |
|
вітчизняного виробництва |
|
Назва виробника _______________ |
|
Код ЄДРПОУ ______________________ |
|
Ліцензія: серія ______ № ____________ |
|
Адреса, контактні телефони, e-mail ______________________________ |
|
Період за який надається інформація з __,___,__ по ___,___,____ |
|
№ |
Міжнародна непатентована назва |
Код АТХ |
№ реєстраційного посвідчення |
Торговельна назва |
Лікарська форма, дозування, первинна і споживча упаковка |
Кількість у споживчій упаковці |
Середня оптово-відпускна ціна за уп., грн. |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Керівник підприємства _____________________ (П.І.Б.) |
||||
|
МП |
||||
Додаток 3
до п. 3.3 Порядку проведення моніторингу
цін на лікарські засоби і вироби медичного призначення
|
ФОРМА ЗВІТНОСТІ З МОНІТОРИНГУ ЗАКУПІВЕЛЬНИХ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ |
|||
|
Назва суб’єкта господарської діяльності __________________ |
|||
|
Регіон провадження діяльності _____________________ |
|||
|
Код ЄДРПОУ ______________________ |
|||
|
Ліцензія: серія ______ № ____________ |
|||
|
Адреса місця провадження діяльності, контактні телефони, e-mail _______________________________________ |
|||
|
Період за який надається інформація з __,___,__ по ___,___,____ |
|
№ |
Міжнародна непатентована назва |
Код АТХ |
Торговельна назва |
Лікарська форма, дозування, первинна і споживча упаковка |
Кількість у споживчій упаковці |
Виробник |
Країна |
Кількість проданих упаковок за період, шт. |
Ціна за уп., грн. |
Сума, грн. |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
Примітка: Графи 1-8, 11 автоматично заповнюються Держлікінспекцією; суб’єкт господарювання заповнює тільки графи 9-10. |
|
Керівник підприємства ___________________ (П.І.Б.) |
|
МП |
Додаток 4
до п. 3.3 Порядку проведення моніторингу
цін на лікарські засоби і вироби медичного призначення
|
ФОРМА ЗВІТНОСТІ З МОНІТОРИНГУ РОЗДРІБНИХ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ |
|
Назва суб’єкта господарської діяльності __________________ |
|
Регіон провадження діяльності _____________________ |
|
Код ЄДРПОУ ______________________ |
|
Ліцензія: серія ______ № ____________ |
|
Адреса місця провадження діяльності, контактні телефони, e-mail ______________________________________________________________ |
|
Період за який надається інформація з __,___,__ по __,___,____ |
|
№ з/п |
Міжнародна непатентована назва |
Код АТХ |
Торговельна назва |
Лікарська форма, дозування, первинна і споживча упаковка |
Кількість у споживчій упаковці |
Виробник |
Країна |
Кількість проданих упаковок за період, шт. |
Ціна за уп., грн. |
Сума, грн. |
|||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|||||||||||||
|
Примітка: Графи 1-8, 11 автоматично заповнюються Держлікінспекцією; суб’єкт господарювання заповнює тільки графи 9-10. |
|
Керівник підприємства _________________________ (П.І.Б.) |
|
МП |
Додаток 5
до п. 3.4 Порядку проведення моніторингу
цін на лікарські засоби і вироби медичного призначення
|
ФОРМА ЗВІТНОСТІ З МОНІТОРИНГУ ЦІН НА ЛІКАРСЬКІ ЗАСОБИ І ВИРОБИ МЕДИЧНОГО ПРИЗНАЧЕННЯ, ЩО ЗАКУПОВУЮТЬСЯ ЗА БЮДЖЕТНІ КОШТИ |
|
Назва установи, організації __________________ |
|
Код ЄДРПОУ ______________________ |
|
Адреса, контактні телефони, e-mail ___________________________________________ |
|
Період за який надається інформація з __,___,__ по __,___,____ |
|
№ з/п |
Міжнародна непатентована назва |
Код АТХ |
Торговельна назва |
Лікарська форма, дозування, первинна і споживча упаковка |
Кількість у споживчій упаковці |
Виробник |
Країна |
Кількість проданих упаковок за період, шт. |
Ціна за уп., грн. |
Сума, грн. |
Примітка (назва програми) |
||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
||||||||||||||
|
Примітка: Графи 1-8, 11 автоматично заповнюються Держлікінспекцією; суб’єкт господарювання заповнює тільки графи 9-10. |
||
|
Керівник (посада) _________________________ (П.І.Б.) |
||
|
МП |

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим