Суть вопроса
 В прошлом месяце на страницах нашего издания была поднята тема государственных закупок лекарственных средств, применяемых для лечения муковисцидоза у детей. Мы сообщали о том, что редакция «Еженедельника АПТЕКА» получила обращение благотворительного фонда «Щаслива дитина» к министру здравоохранения Раисе Богатыревой, в котором сообщалось о том, что в фонд обратились родители детей, больных муковисцидозом. Они были обеспокоены тем, что за средства госбюджета Министерство здравоохранения в 2013 г. намерено приобрести препарат КРЕАЗИМ 10 000 (ЧАО «Технолог»). Их беспокойство было вызвано сомнениями в отношении клинической эффективности и безопасности этого препарата.
В прошлом месяце на страницах нашего издания была поднята тема государственных закупок лекарственных средств, применяемых для лечения муковисцидоза у детей. Мы сообщали о том, что редакция «Еженедельника АПТЕКА» получила обращение благотворительного фонда «Щаслива дитина» к министру здравоохранения Раисе Богатыревой, в котором сообщалось о том, что в фонд обратились родители детей, больных муковисцидозом. Они были обеспокоены тем, что за средства госбюджета Министерство здравоохранения в 2013 г. намерено приобрести препарат КРЕАЗИМ 10 000 (ЧАО «Технолог»). Их беспокойство было вызвано сомнениями в отношении клинической эффективности и безопасности этого препарата.
Мы обратились в фонд и выяснили, что его представители не обращались ни к производителю (ЧАО «Технолог»), ни в Министерство здравоохранения Украины с вопросом о наличии доказательств эффективности и безопасности препарата КРЕАЗИМ.
В свою очередь, ЧАО «Технолог» предоставило в редакцию «Еженедельника АПТЕКА» отчет открытого сравнительного параллельного клинического исследования «Оценка эффективности и переносимости препарата КРЕАЗИМ 10 000 в капсулах производства ЗАО «Технолог» (Умань) в лечении больных с хроническим панкреатитом»*. В исследовании приняли участие 60 пациентов в возрасте 18–25 лет с диагнозом хронический панкреатит с внешнесекреторной недостаточностью, находящихся на лечении в клинике кафедры гастроэнтерологии и диетологии Киевской медицинской академии последипломного образования им. П.Л. Шупика, поликлиниках № 1, № 2, № 3 Оболонского р-на Киева. Оценка эффективности и безопасности препарата КРЕАЗИМ 10 000 в капсулах производства ЗАО «Технолог» проводилась в сравнении с препаратом Креон® 10 000 (производитель — «Solvay Pharmaceuticals»). Анализ результатов этих исследований позволил заключить, что сравнительное изучение эффективности лекарственных средств КРЕАЗИМ 10 000 в основной группе и препарат сравнения в контрольной свидетельствует о выраженной терапевтической эффективности обоих ферментных препаратов. Таким образом, терапевтическая эквивалентность лекарственного средства КРЕАЗИМ 10 000 референтному препарату подтверждена.
КРЕАЗИМ находится на фармацевтическом рынке 7 лет. В течение этого времени постоянно отслеживаются и фиксируются его побочные реакции и эффективность, предприятие также располагает сведениями о результатах пострегистрационного надзора при медицинском применении препаратов КРЕАЗИМ 10 000, КРЕАЗИМ 20 000. Так, на запрос ЧАО «Технолог» касательно результатов пострегистрационного надзора при медицинском применении препаратов КРЕАЗИМ 10 000, КРЕАЗИМ 20 000 (капсулы твердые кишечно-растворимые, № 20 (10х2) в блистерах; регистрационные удостоверения № UA/2822/01/01, № UA/2822/01/02 от 07.04.2010 г.) ГП «Государственный экспертный центр» в письме от 05.11.2012 г. № 951/ПР сообщило о том, что за период с 25.09.2009 г. по 04.10.2012 г. в Департамент пострегистрационного надзора поступила информация об 1 случае возникновения побочной реакции у девочки в возрасте 8 лет с диагнозом кистозный фиброз.
В 2013 г. ЧАО «Технолог» направило еще один аналогичный запрос в ГП «Государственный экспертный центр». В ответ производитель получил письмо от 15.03.2013 г. № 219/ПР, в котором сообщается, что за период с 05.10.2012 г. по 16.01.2013 г. в Департамент пострегистрационного надзора поступила информация о 4 случаях побочных реакций при использовании препаратов КРЕАЗИМ 10 000 (капсулы твердые кишечно-растворимые, № 20 (10х2) в блистерах; регистрационные удостоверения № UA/2822/01/01, № UA/2822/01/02 от 07.04.2010 г.) у детей с кистозным фиброзом.
Все случаи побочных реакций, описанных в письмах ГП «Государственный экспертный центр», проявлялись в виде нарушений со стороны желудочно-кишечного тракта (учащение дефекации, диарея, боль в животе, вздутие), расцениваются согласно приказу профильного министерства № 690 как несерьезные и описанные в инструкциях по медицинскому применению обоих препаратов.
Исходя из вышеизложенного, можно сделать вывод: информация благотворительного фонда «Щаслива дитина» о том, что эффективность и безопасность препарата КРЕАЗИМ для лечения детей с муковисцидозом не доказана, не соответствует действительности. Более того, сообщения родителей о частых побочных реакциях, якобы возникающих при применении лекарственного средства КРЕАЗИМ 10 000 для лечения муковисцидоза у детей, не подтверждает ГП «Государственный экспертный центр», который сообщил производителю о 5 несерьезных побочных реакциях при применении этого препарата в терапии кистозного фиброза у детей, зарегистрированных с 2009 г.
Препарат сравнения
В открытых официальных источниках Украины нет данных о клинической эффективности препарата сравнения. Однако такие данные мы нашли в досье Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) на это лекарственное средство, датированном сентябрем 2012 г. Отметим, что в США этот препарат был допущен на рынок в 2009 г.
В досье FDA упоминается о 2 исследованиях по применению этого лекарственного средства в терапии кистозного фиброза у детей. В одном из них приняли участие 17 пациентов в возрасте 7–11 лет. Но даже в такой небольшой группе больных возникновение побочных реакций официально зарегистрировано в 6% случаев, что в 2 раза чаще, чем при применении плацебо. Тошноту и головную боль отмечали у 12% детей. Наиболее частыми побочными реакциями были рвота, головокружение и кашель. Среди опасных побочных реакций в досье FDA упоминается фиброз кишечника с развитием кишечной непроходимости.
Также FDA сообщает о том, что постмаркетинговые данные о применении препарата сравнения доступны с 2009 г. В числе побочных реакций — желудочно-кишечные расстройства (включая абдоминальную боль, диарею, вздутие живота, запор, тошноту), расстройства со стороны кожи (зуд, крапивница, высыпания), бессимтомное повышение уровня печеночных ферментов и пр. Среди серьезных побочных реакций зафиксированы фиброколонопатия, обструкция дистальных отделов кишечника, аллергические реакции, включая анафилактический шок.
Таким образом, побочные реакции могут возникать при применении как препарата сравнения, так и генерического продукта.
Сравнение генерика с референтным препаратом
При сравнении генерического лекарственного средства КРЕАЗИМ с референтным препаратом обратим внимание на некоторые их характеристики, указанные в инструкциях по медицинскому применению (таблица).
| Таблица | Сравнительные характеристики генерика и референтного препарата |
| Характеристика | Генерик (КРЕАЗИМ 10 000) | Референтный препарат |
|---|---|---|
| Состав | 1 капсула содержит 140 мг панкреатина (КРЕАЗИМ 10 000) в кишечно-растворимых гранулах, с ферментативной активностью не менее 10 000 ЕД Ph. Eur. липазы, 8000 ЕД Ph. Eur. амилазы и 600 ЕД Ph. Eur. протеазы | 1 капсула содержит 150 мг панкреатина с гастрорезистентными гранулами (минимикросферы™), которые проявляют ферментативную активность (липазы 10 000 ед. ЕФ, амилазы 8000 ед. ЕФ и протеазы 600 ед. ЕФ) |
| Вспомогательные вещества | Метакриловая кислота — этил акрилат сополимер (1:1) дисперсия 30%, симетикон, тальк, триэтил цитрат, сахарная крупка | Ядро гранул — макрогол 4000, оболочка гранул — гипромеллозы фталат, спирт цетиловый, триэтилцитрат, диметикон 1000, оболочка капсул — желатин, железа оксид (E172), титана диоксид (E171), натрия лаурилсульфат |
| Показания | Муковисцидоз, хронический панкреатит, панкреатэктомия, рак поджелудочной железы, обструкция панкреатического или общего желчного протока (например опухолью), синдром Швахмана — Даймонда, другие заболевания, сопровождающиеся экзокринной недостаточностью поджелудочной железы | Муковисцидоз; хронический панкреатит; панкреатэктомия; гастроэктомия; рак поджелудочной железы; операции с наложением желудочно-кишечного анастомоза (например гастроэнтеростомия по Бильрот II); обструкция панкреатического или общего желчного протока (например опухолью); синдром Швахмана — Даймонда; острый панкреатит с момента перевода пациента на энтеральное питание и другие заболевания, сопровождающиеся экзокринной недостаточностью поджелудочной железы |
| Побочные реакции | Со стороны желудочно-кишечного тракта: часто — боль в животе, нечасто — запор, изменение характера испражнений, диарея, рвота и тошнота. Со стороны кожи и подкожной клетчатки: нечасто могут возникать кожные аллергические реакции или реакции гиперчувствительности | Со стороны желудочно-кишечного тракта: часто — тошнота, рвота, запор и вздутие живота. Со стороны кожи и подкожной клетчатки: нечасто — высыпания. Со стороны иммунной системы: частота неизвестна — гиперчувствительность (анафилактические реакции). Отмеченные аллергические реакции, главным образом, но не исключительно, ограничивались кожей и выявлены как побочные реакции при пострегистрационном применении. Поскольку сообщения об этих реакциях были спонтанными и получены от популяции неопределенного размера, точную частоту этих реакций оценить невозможно |
Исходя из информации, изложенной в инструкциях по медицинскому применению, состав препаратов идентичен. В то же время для покрытия гранул при производстве референтного препарата используется полимер, растворяемый в ацетоне. При производстве же лекарственного средства КРЕАЗИМ для покрытия гранул используется полимер, растворяемый в очищенной воде. Поэтому в референтном препарате допускается содержание ацетона, а КРЕАЗИМ его не содержит.
Что касается показаний и побочных реакций, то согласно инструкциям по медицинскому применению обоих препаратов эти характеристики также идентичны.
Качество препарата КРЕАЗИМ подтверждено, о чем свидетельствует наличие у ЧАО «Технолог» сертификата GMP 033/2012/SAUMP/GMP (срок действия до 28.09.2015 г.), выданного Государственной службой Украины по лекарственным средствам по результатам инспектирования производителя, последнее из которых было проведено с 24.09.2012 г. по 28.09.2012 г.
Клинические исследования в педиатрии
Согласно ст. 8 «Защита прав пациента (добровольца)» Закона Украины «О лекарственных средствах» клинические исследования лекарственных средств при участии малолетнего или несовершеннолетнего лица могут проводиться только в случае, если соответствующее лекарственное средство предназначено для лечения детских заболеваний. В случае с препаратом КРЕАЗИМ законодательство Украины не позволяет провести его клинические исследования с участием детей, поскольку он применяется и у взрослых пациентов. Кроме того, клинические исследования проводятся до получения разрешения на маркетинг препарата (в Украине — регистрационное свидетельство). После того, как препарат получает доступ на рынок, проводятся постмаркетинговые исследования его эффективности и безопасности.
КРЕАЗИМ завоевывает лояльность украинских потребителей
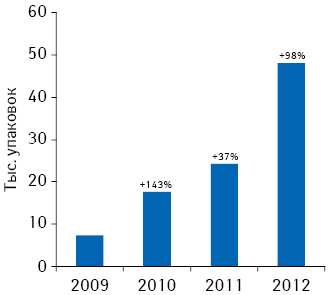
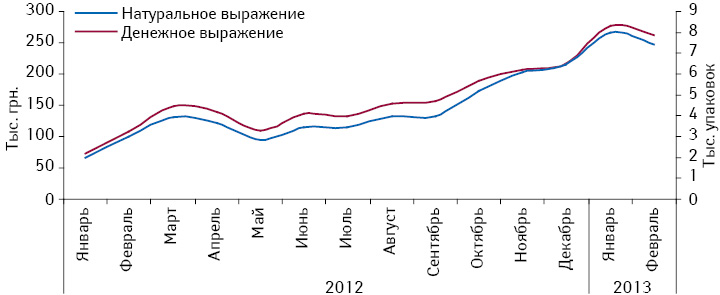
Об эффективности и благоприятном профиле безопасности препарата КРЕАЗИМ красноречиво свидетельствует растущая из года в год лояльность украинских потребителей, что подтверждает динамика его аптечных продаж (рис. 1). Так, согласно данным аналитической системы исследования рынка «PharmXplorer»/«Фармстандарт» компании «Proxima Research», по итогам 2009–2012 г. объем продаж препарата КРЕАЗИМ в натуральном выражении увеличился почти в 7 раз при среднегодовых темпах прироста на уровне 93% (!). В 2012 г. был найден оптимальный баланс между ценовой политикой компании и потребительским спросом, и, начиная с минувшего года, динамика продаж препарата КРЕАЗИМ как в деньгах, так и в упаковках «шагает» практически в унисон при стабильной цене препарата (рис. 2).
Государственные закупки
В Государственном бюджете на 2013 г. предусмотрены средства на закупку препаратов панкреатина для лечения детей, больных муковисцидозом, в размере 931 тыс. грн. Учитывая доказанную терапевтическую эквивалентность препарата КРЕАЗИМ референтному лекарственному средству, его подтвержденное качество, благоприятный профиль безопасности, а также стоимость при госпитальных закупках, которая, по данным аналитической системы исследования рынка «PharmXplorer»/«Фармстандарт» компании «Proxima Research», в 2012 г. для 1 упаковки препарата КРЕАЗИМ 10 000, № 20, составляла 28 грн., а для препарата сравнения — 59 грн., ответ на вопрос, какой препарат должно закупать Министерство здравоохранения, очевиден.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим